Ацетат кадмия
Текущая версия страницы пока не проверялась опытными участниками и может значительно отличаться от версии, проверенной 8 июня 2019 года; проверки требуют 5 правок.
| Ацетат кадмия | |
|---|---|
 | |
| Общие | |
| Систематическое наименование |
Ацетат кадмия |
| Традиционные названия | Уксуснокислый кадмий |
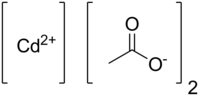
| Хим. формула | C4H6CdO4 |
| Рац. формула | Cd(CH3COO)2 |
| Физические свойства | |
| Состояние | бесцветные кристаллы |
| Молярная масса | 230,50 г/моль |
| Плотность | 2,341 г/см³ |
| Термические свойства | |
| Температура | |
| • плавления | 255; 256 °C |
| • разложения | 235-290 °C |
| Химические свойства | |
| Растворимость | |
| • в воде | растворяется |
| • в метаноле | растворяется |
| • в диэтиловом эфире | не растворяется |
| Классификация | |
| Рег. номер CAS | 543-90-8, дигидрат - CAS 5743-04-4 |
| PubChem | 6537495 |
| Рег. номер EINECS | 208-853-2 |
| SMILES | |
| InChI | |
| RTECS | AF7505000 |
| ChemSpider | 10521 |
| Безопасность | |
| Предельная концентрация | 0,2 мг/м³ |
| ЛД50 | 100 мг/кг |
| Токсичность |
токсично |
| NFPA 704 | |
| Приведены данные для стандартных условий (25 °C, 100 кПа), если не указано иное. | |
Ацетат кадмия — органическое химическое соединение, соль кадмия и уксусной кислоты с формулой Cd(CH3COO)2, бесцветные кристаллы, растворяется в воде, образует кристаллогидраты. Как и все кадмийорганические вещества, очень ядовит.
Получение[править | править код]
- Растворение оксида кадмия в уксусной кислоте:
Физические свойства[править | править код]
Ацетат кадмия образует бесцветные кристаллы
Растворяется в воде и метаноле.
Образует кристаллогидраты состава Cd(CH3COO)2•n H2O, где n = 1, 2 и 3, которые теряют воду при температуре 90-150°С.
Cd(CH3COO)2•2H2O — бесцветные моноклинные кристаллы с плотностью 2,01 г/см³, расплывающиеся на воздухе.
Химические свойства[править | править код]
- Разлагается при нагревании:
Литература[править | править код]
- Справочник химика / Редкол.: Никольский Б.П. и др.. — 3-е изд., испр. — Л.: Химия, 1971. — Т. 2. — 1168 с.
- CRC Handbook of Chemistry and Physics. — 89th Edition. — Taylor and Francis Group, LLC, 2008-2009.
- Карякин Ю. В., Ангелов И. И. Чистые химические вещества. — М.: Химия, 1974. — 408 с.
Это заготовка статьи о неорганическом веществе. Помогите Википедии, дополнив её. |


