Болезнь Рандю — Ослера
| Болезнь Рандю — Ослера | |
|---|---|
 | |
| МКБ-11 | LA90.00 |
| МКБ-10 | I78.0 |
| МКБ-10-КМ | I78.0 |
| МКБ-9 | 448.0 |
| МКБ-9-КМ | 448.0[1] |
| OMIM | 187300 |
| DiseasesDB | 9303 |
| MedlinePlus | 000837 |
| eMedicine | med/2764 ped/1668derm/782 |
| MeSH | D013683 |
Болезнь Рандю́ — О́слера (Рандю — Ослера — Ве́бера), синдром Ослера, семейная наследственная телеангиэктазия, наследственная геморрагическая телеангиэктазия, геморрагический ангиоматоз (НГТ) — наследственное заболевание, в основе которого лежит неполноценность сосудистого эндотелия, в результате чего на разных участках кожи и слизистых оболочках губ, рта, во внутренних органах образуются множественные ангиомы и телеангиэктазии (аномалии сосудов), которые кровоточат. Названа по именам сэра Уильяма Ослера, Анри Жюля Луи Мари Рандю и Фредерика Паркса Вебера, описавших её в конце XIX — начале XX века[2]. Передаётся по аутосомно-доминантному типу; встречается примерно у одного из 5000 человек.
Симптомы[править | править код]
Телеангиэктазии[править | править код]
Телеангиэктазии (мелкие сосудистые мальформации) могут возникать на коже и слизистых оболочках носа и желудочно-кишечного тракта. Наиболее распространенной проблемой являются носовые кровотечения, которые часто случаются в детском возрасте и встречаются у около 90–95% людей с НГТ. Поражения на коже и во рту реже кровоточат, но могут рассматриваться как неприятные с косметической точки зрения; они затрагивают около 80% больных [3][4]. Поражения кожи обычно возникают на губах, носу и пальцах, а также на коже лица в местах, подверженных воздействию солнца. Они появляются внезапно, и их число со временем увеличивается[4].
Приблизительно у 20% пациентов наблюдаются симптоматическими поражениями пищеварительного тракта, хотя у более высокого процента есть поражения, которые не вызывают симптомов. Эти поражения могут периодически кровоточить, что редко бывает достаточно значительным, чтобы его можно было заметить (в виде кровавой рвоты или черного стула), но в конечном итоге может привести к истощению запасов железа в организме, что приводит к железодефицитной анемии[3][4].
Артериовенозные мальформации[править | править код]
Артериовенозные мальформации (АВМ, более крупные сосудистые мальформации) встречаются в крупных органах, преимущественно в легких (легочные АВМ) (50%), печени (30–70%) и головном мозге (церебральные АВМ, 10%), редко ( <1%) АВМ в спинном мозге[3][4].
Сосудистые мальформации в легких могут вызвать ряд проблем. В норме легкие «отфильтровывают» бактерии и сгустки крови из кровотока; АВМ обходят капиллярную сеть легких и позволяют им мигрировать в мозг, где бактерии могут вызвать абсцесс головного мозга, а тромбы могут привести к инсульту[3]. НГТ является наиболее распространенной причиной АВМ легких: из всех людей, у которых обнаружены АВМ легких, 70–80% связаны с НГТ[5][6]. Кровотечение из АВМ легких встречается относительно редко, но может вызывать кровохарканье (кашель с кровью) или гемоторакс (кровь скапливается в грудной полости)[3][4][6]. Крупные сосудистые мальформации в легких позволяют обедненной кислородом крови из правого желудочка миновать альвеолы, а это означает, что эта кровь не имеет возможности поглощать свежий кислород. Это может привести к одышке[5][6]. Большие АВМ могут привести к платипноэ, затруднению дыхания, которое более выражено в положении сидя, чем в положении лежа; это, вероятно, отражает изменения кровотока, связанные с позиционированием[5]. Очень большие АВМ вызывают заметную неспособность поглощать кислород, что может проявляться цианозом (посинение губ и кожи), изменением формы ногтей (часто встречается при хронически низком уровне кислорода) и гудящим шумом над пораженной частью легкого, который можно обнаружить с помощью стетоскопа[5][6].
Симптомы, вызываемые АВМ в печени, зависят от типа аномальной связи, которую они образуют между кровеносными сосудами. При соединении между артериями и венами большое количество крови минует органы тела, что сердце компенсирует увеличением сердечного выброса. В конце концов развивается застойная сердечная недостаточность («сердечная недостаточность с высоким выбросом»), с одышкой и отеком ног, среди других проблем. Если АВМ создает связь между воротной веной и кровеносными сосудами печени, результатом может быть портальная гипертензия (повышенное давление в воротной вене), при которой в пищеводе образуются коллатеральные кровеносные сосуды (варикозно расширенные вены пищевода), которые могут сильно кровоточить; кроме того, повышенное давление может привести к скоплению жидкости в брюшной полости (асцит). Если поток в АВМ направлен в другую сторону, портальная венозная кровь течет непосредственно в вены, а не через печень; это может привести к печеночной энцефалопатии (спутанность сознания из-за портальных продуктов жизнедеятельности, пагубно влияющих на головной мозг). В редких случаях желчные протоки лишаются крови, что приводит к тяжелому холангиту (воспалению желчных протоков)[3][7]. АВМ печени обнаруживаются более чем у 70% людей с НГТ, но в результате только у 10% возникают проблемы[4].
В головном мозге АВМ иногда оказывают давление на окружающие ткани, что приводит к головным болям. Они также могут увеличить риск судорог, как и любая аномальная ткань в головном мозге. Наконец, кровоизлияние из АВМ может привести к внутримозговому кровоизлиянию, которое вызывает любой из симптомов инсульта, например слабость в какой-либо части тела или трудности с речью. Если кровотечение происходит в субарахноидальное пространство (субарахноидальное кровоизлияние), обычно возникает сильная внезапная головная боль, снижение уровня сознания и часто слабость в какой-либо части тела[3][4].
Другие проблемы[править | править код]
Очень небольшая часть пациентов (те, у кого мутации SMAD4 (MADH4), см. ниже) имеют множественные доброкачественные полипы в толстой кишке, которые могут кровоточить или трансформироваться в колоректальный рак. Столь же небольшая часть страдает легочной гипертензией, состоянием, при котором давление в легочных артериях увеличивается, оказывая давление на правую часть сердца и вызывая периферические отеки (отек ног), обмороки и приступы боли в груди. Было замечено, что может повышаться риск тромбоза (особенно венозного тромбоза в форме тромбоза глубоких вен или легочной эмболии). Есть подозрение, что люди с НГТ могут иметь легкий иммунодефицит и, следовательно, подвержены несколько повышенному риску инфекций[3].
Генетика[править | править код]

НГТ — генетическое заболевание с аутосомно-доминантным типом наследования. У людей с симптомами НГТ, у которых нет родственников с этим заболеванием, может быть новая мутация[8]. Гомозиготность оказывается фатальной внутриутробно[3].
Доказано существование пяти генетических типов НГТ. Из них три связаны с определенными генами, а два оставшихся в настоящее время связаны только с определенным локусом. Более 80% всех случаев НГТ связаны с мутациями в ENG или ACVRL1[9]. Всего известно более 600 различных мутаций. Вероятно, в определенных популяциях преобладает тот или иной тип, но данные противоречивы. Мутации MADH4, которые вызывают полипоз толстой кишки в дополнение к НГТ, составляют около 2% мутаций, вызывающих заболевание. Помимо MADH4, неясно, приводят ли мутации в ENG и ACVRL1 к определенным симптомам[3], хотя в некоторых сообщениях предполагается, что мутации ENG с большей вероятностью вызывают проблемы с легкими, в то время как мутации ACVRL1 могут вызывать больше проблем с печенью[4][6], и легочная гипертензия могут быть особой проблемой у людей с мутациями ACVRL1[9]. Люди с точно такими же мутациями могут иметь различную природу и тяжесть симптомов, что позволяет предположить, что дополнительные гены или другие факторы риска могут определять скорость развития поражений; они еще не идентифицированы[4][9].
| Название | OMIM | Ген | Локус | Описание |
| НГТ 1 | 187300 | ENG | 9q34.1 | ENG кодирует эндоглин, рецептор TGF-β1 (трансформирующий фактор роста бета 1) и TGF-β3; генетическая связь была выявлена в 1994 г[10]. Наблюдалась высокая доля мутаций со сдвигом рамки считывания[3]. Практически все мутации происходят во внеклеточной части белка (той части, которая находится на поверхности клетки)[9]. |
| НГТ 2 | 600376 | ACVRL1 | 12q11-q14 | ACVRL1 кодирует Alk-1 (ACVR1, активин-рецептор-подобная киназа 1), рецептор TGF-β1; генетическая связь была выявлена в 1996 году[11]. |
| НГТ 3 | 601101 | Неизвестно | 5q31 | Функция неизвестна, связь выявлена в 2005 г[12]. |
| НГТ 4 | 610655 | Неизвестно | 7p14 | Функция неизвестна, связь выявлена в 2006 г[13]. |
| JPHT | 175050 | MADH4 | 18q21.1 | MADH4 кодирует SMAD4, внутриклеточный сигнальный белок для рецепторов суперсемейства TGF. Мутации в этом гене вызывают НГТ и ювенильный полипоз. Связь была выявлена в 2004 году[14]. Мутации в основном в экзонах 8–11, часто de novo (вновь приобретенные, не унаследованные)[3]. |
Патофизиология[править | править код]

Считается, что телеангиэктазии и артериовенозные мальформации при НГТ возникают из-за изменений в ангиогенезе, развитии кровеносных сосудов из существующих. Развитие нового кровеносного сосуда требует активации и миграции различных типов клеток, главным образом эндотелия, гладких мышц и перицитов. Точный механизм, с помощью которого мутации HГT влияют на этот процесс, еще не ясен, и вполне вероятно, что они нарушают баланс между про- и антиангиогенными сигналами в кровеносных сосудах. Стенка телеангиэктазий необычайно рыхлая, что объясняет склонность этих поражений к кровотечению[3].
Все известные до сих пор гены связаны с кодом HГT для белков в сигнальном пути TGF-β. Это группа белков, которые участвуют в передаче сигнала гормонов надсемейства трансформирующих факторов роста бета (трансформирующий фактор роста бета, костный морфогенетический белок и классы факторов дифференцировки роста), в частности BMP9/GDF2 и BMP10. Гормоны не проникают в клетку, а связываются с рецепторами на клеточной мембране; затем они активируют другие белки, в конечном итоге влияя на клеточное поведение несколькими способами, такими как выживание клеток, пролиферация (увеличение количества) и дифференцировка (становление более специализированным). Для адекватной передачи гормонального сигнала необходима комбинация белков: по два каждого из двух типов серин/треонин-специфических мембранных рецепторов киназного типа и эндоглин. При связывании с гормоном рецепторные белки типа II фосфорилируют (переносят фосфат) на рецепторные белки типа I (одним из которых является Alk-1), которые, в свою очередь, фосфорилируют комплекс белков SMAD (главным образом SMAD1, SMAD5 и SMAD8). Они связываются с SMAD4 и мигрируют в ядро клетки, где действуют как факторы транскрипции и участвуют в транскрипции определенных генов. В дополнение к пути SMAD, мембранные рецепторы также действуют на путь MAPK, который дополнительно влияет на поведение клеток.[2] И Alk-1, и эндоглин экспрессируются преимущественно в эндотелии, что, возможно, объясняет, почему вызывающие HГT мутации в этих белках приводят преимущественно к проблемам с кровеносными сосудами[4][9]. Мутации как ENG, так и ACVRL1 приводят преимущественно к недопроизводству родственных белков, а не к неправильному функционированию белков[9].
Диагностика[править | править код]
Диагностические тесты могут проводиться по разным причинам. Некоторые тесты необходимы для подтверждения или опровержения диагноза. Другие - для выявления возможных осложнений[8].
Телеангиэктазии[править | править код]
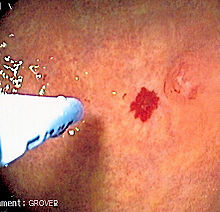
Телеангиэктазии на коже и в полости рта визуально определяются при физикальном обследовании, и аналогичным образом поражения в носу можно увидеть при эндоскопии носоглотки или при ларингоскопии. Тяжесть носовых кровотечений можно объективно количественно оценить с помощью вопросника, в котором регистрируется количество эпизодов носового кровотечения и их продолжительность[4].
Телеангиэктазии желудочно-кишечного тракта могут быть выявлены при эзофагогастродуоденоскопии (эндоскопия пищевода, желудка и начального отдела тонкой кишки). Эта процедура обычно проводится только в том случае, если анемия более выражена, чем ожидается, из-за тяжести носовых кровотечений, или если есть признаки сильного кровотечения (рвота с кровью, черный стул). Если количество поражений, видимых при эндоскопии, неожиданно мало, остальную часть тонкой кишки можно исследовать с помощью капсульной эндоскопии, при которой пациент проглатывает устройство в форме капсулы, содержащее миниатюрную камеру, которая передает изображения пищеварительного тракта на портативный цифровой рекордер[4].
Артериовенозные мальформации[править | править код]
Идентификация АВМ требует детальной медицинской визуализации органов, наиболее часто поражаемых этими поражениями. Не все АВМ вызывают симптомы или подвержены риску их возникновения, и, следовательно, между специалистами существуют определенные различия в отношении того, будут ли проводиться такие исследования и каким образом; часто решения по этому вопросу принимаются вместе с пациентом[3].
АВМ легких можно заподозрить из-за аномального внешнего вида легких на рентгенограмме грудной клетки или гипоксии (низкий уровень кислорода) при пульсоксиметрии или определении газов артериальной крови. Пузырьковая контрастная эхокардиография (пузырьковое эхокардиографическое исследование) может использоваться в качестве скринингового инструмента для выявления аномальных соединений между легочными артериями и венами. Оно включает в себя инъекцию взболтанного физиологического раствора в вену с последующей ультразвуковой визуализацией сердца. В норме легкие удаляют мелкие пузырьки воздуха из кровотока, поэтому они видны только в правом предсердии и правом желудочке. При наличии АВМ пузырьки появляются в левом предсердии и левом желудочке, обычно через 3–10 сердечных циклов после правого; это происходит медленнее, чем при пороках сердца, при которых имеются прямые связи между правой и левой частями сердца. Большее количество пузырьков с большей вероятностью указывает на наличие АВМ. Пузырьковое эхо не является идеальным инструментом для скрининга, поскольку оно может пропускать более мелкие АВМ и не позволяет определить местонахождение АВМ. Часто для выявления поражений легких используют компьютерную томографию с контрастным усилением (КТ-ангиографию); этот метод имеет чувствительность более 90%[3][4]. На современных КТ-сканерах можно не вводить контраст[6]. Эхокардиография также используется, если есть подозрение на легочную гипертензию или сердечную недостаточность с высоким выбросом из-за больших поражений печени, иногда с последующей катетеризацией сердца для измерения давления внутри различных камер сердца.
Заподозрить АВМ печени можно из-за аномальных функциональных проб печени в крови, из-за развития симптомов сердечной недостаточности или из-за желтухи или других симптомов дисфункции печени. Наиболее надежным начальным скрининговым тестом является ультразвуковая допплерография печени; это имеет очень высокую чувствительность для выявления сосудистых поражений в печени. При необходимости для дальнейшей характеристики АВМ можно использовать КТ с контрастным усилением[3][4][7]. Чрезвычайно часто обнаруживаются случайные узлы при сканировании печени, чаще всего из-за фокальной узловой гиперплазии (ФНГ), поскольку они в сто раз чаще встречаются при ГГТ по сравнению с населением в целом. ФНГ считается безвредным. Как правило, онкомаркеры и дополнительные методы визуализации используются для дифференциации ФНГ и злокачественных опухолей печени. Биопсия печени не рекомендуется людям с ГГТ, так как риск кровотечения из АВМ печени может быть значительным[7][8]. Сканирование печени может быть полезным, если кто-то подозревается в ГГТ, но не соответствует критериям (см. ниже), за исключением случаев, когда можно продемонстрировать поражение печени[8].
АВМ головного мозга можно обнаружить при компьютерно-томографической ангиографии (КТА или КТ-ангиографии) или магнитно-резонансной ангиографии (МРА); КТА лучше показывает сами сосуды, а МРА дает более подробную информацию о взаимоотношениях между АВМ и окружающей тканью головного мозга[15].В целом рекомендуется МРТ[3][8]. Могут встречаться различные типы сосудистых мальформаций: АВМ, микро-АВМ, телеангиэктазии и артериовенозные фистулы[8]. Если предполагается хирургическое вмешательство, эмболизация или другое лечение (см. ниже), может потребоваться церебральная ангиография, чтобы получить достаточную детализацию сосудов. Эта процедура сопряжена с небольшим риском инсульта (0,5%) и поэтому ограничена конкретными обстоятельствами[8][15]. Недавние профессиональные руководства рекомендуют всем детям с подозрением или подтвержденным диагнозом НГТ пройти МРТ головного мозга в раннем возрасте для выявления АВМ, которые могут вызвать серьезные осложнения[8]. Другие предполагают, что скрининг на церебральные АВМ, вероятно, не нужен тем, кто не испытывает каких-либо неврологических симптомов, потому что большинство поражений, обнаруженных при скрининговом сканировании, не требуют лечения, что создает нежелательные загадки.
Генетическое тестирование[править | править код]
Генетические тесты доступны для мутаций ENG, ACVRL1 и MADH4. Тестирование не всегда необходимо для постановки диагноза, потому что симптомов достаточно, чтобы отличить болезнь от других диагнозов. Есть ситуации, в которых тестирование может быть особенно полезным. Во-первых, дети и молодые люди, у родителей которых имеется определенная НГТ, могут иметь ограниченные симптомы, но при этом подвергаться риску некоторых из упомянутых выше осложнений; если мутация известна у родителя, отсутствие этой мутации у ребенка предотвратит необходимость проведения скрининговых тестов. Кроме того, генетическое тестирование может подтвердить диагноз у лиц с ограниченными симптомами, которые в противном случае были бы помечены как «возможный НГТ» (см. ниже)[8].
Генетическая диагностика при НГТ затруднена, поскольку мутации возникают во многих различных местах в сцепленных генах, при этом конкретные мутации не встречаются очень часто (в отличие, например, от мутации ΔF508 при муковисцидозе). Таким образом, анализ последовательности вовлеченных генов является наиболее полезным подходом (чувствительность 75%), за которым следует дополнительное тестирование для обнаружения крупных делеций и дупликаций (дополнительно 10%). Не все мутации в этих генах связаны с болезнью[8].
Мутации в гене MADH4 обычно связаны с ювенильным полипозом, и обнаружение такой мутации указывает на необходимость скрининга пациента и его родственников на наличие полипов и опухолей толстой кишки[8].
Критерии[править | править код]
Диагноз может быть поставлен в зависимости от наличия четырех критериев, известных как «критерии Кюрасао»[16]. Если встречаются три или четыре критерия, у пациента есть «определенный HГT», а два дают «возможный HHT»:
- Спонтанное рецидивирующее носовое кровотечение
- Множественные телеангиэктазии в типичных местах (см. выше)
- Доказанная висцеральная АВМ (легкие, печень, головной мозг, позвоночник)
- Член семьи первой степени родства с HГT
Несмотря на обозначение «возможный», у кого-то с висцеральной АВМ и семейным анамнезом, но без кровотечений из носа или телеангиэктазий, по-прежнему крайне вероятно наличие НГТ, поскольку эти АВМ очень редко встречаются среди населения в целом. В то же время этого нельзя сказать о носовых кровотечениях и редких телеангиэктазиях, которые возникают у людей без НГТ при отсутствии АВМ. В течение жизни чей-то диагностический статус может меняться, так как у маленьких детей могут еще не проявляться все симптомы; в возрасте 16 лет тринадцать процентов все еще неопределенны, в то время как в возрасте 60-ти лет подавляющее большинство (99%) имеют определенную диагностическую классификацию. Таким образом, дети пациентов с подтвержденной НГТ могут быть помечены как «возможные НГТ», поскольку у 50% может оказаться НГТ в течение их жизни.
Лечение[править | править код]
Направлено на остановку кровотечения, при необходимости проводят переливание крови и назначают препараты железа. Используют также криотерапию, иногда — хирургическое вмешательство. Если дело касается носовых кровотечений, то применение тампонад полости носа только увеличивают рецидив и тяжесть кровотечений. Применение тампонов Merocel, гемостатической губки неэффективно, так как ещё больше повреждает слизистую. Достаточно эффективными оказываются тампоны, сделанные из поролоновой губки и пальца силиконовой перчатки. После проведения эффективной тампонады рекомендуется назначение интенсивной консервативной гемостатической терапии, препаратов, положительно влияющих на сосудистую стенку (транексамовая кислота, этамзилат, аминокапроновая кислота, викасол, витамин C).
Носовое кровотечение[править | править код]
Острое носовое кровотечение можно остановить с помощью различных мер, таких как тампонирование полости носа абсорбирующими тампонами или гелями. Снятие тампонов после кровотечения может привести к открытию хрупких сосудов, поэтому рекомендуется использовать смазку или атравматические тампоны[8]. Некоторые пациенты могут захотеть научиться свсё выполнять самостоятельно, чтобы справиться с кровотечением из носа, не прибегая к медицинской помощи[17].
Частые носовые кровотечения можно частично предотвратить, увлажняя ноздри и применяя физиологический раствор, эстрогенсодержащие кремы или транексамовую кислоту; они имеют мало побочных эффектов и могут иметь небольшую пользу. Ряд дополнительных способов был использован для предотвращения повторного кровотечения, если простые меры не увенчались успехом. Медикаментозная терапия включает пероральный прием транексамовой кислоты и эстрогена; доказательства этого относительно ограничены, а эстроген плохо переносится мужчинами и, возможно, несет риск развития рака и сердечных заболеваний у женщин после менопаузы[3][8]. Назальная коагуляция и прижигание могут уменьшить кровотечение из телеангиэктазий и рекомендуются перед хирургическим вмешательством. Тем не менее, настоятельно рекомендуется использовать наименьшее количество тепла и времени, чтобы предотвратить перфорацию перегородки и чрезмерную травму слизистой оболочки носа, которая уже подвержена кровотечению. Склеротерапия - еще один вариант лечения кровотечения. Этот процесс включает введение небольшого количества аэрированного раздражающего вещества (детергента, такого как тетрадецилсульфат натрия) непосредственно в телеангиэктазии. Детергент вызывает коллапс и затвердевание сосуда, что приводит к образованию остатков рубцовой ткани. Это та же процедура, которая используется для лечения варикозного расширения вен и подобных заболеваний.
Возможна эмболизация сосудистых поражений с помощью интервенционной радиологии; для этого требуется провести катетер через крупную артерию и найти верхнечелюстную артерию под рентгенологическим контролем с последующей инъекцией в сосуд частиц, закупоривающих кровеносные сосуды. Польза от процедуры, как правило, недолговечна [8], и она может быть наиболее подходящей при эпизодах сильного кровотечения [17]
Чтобы более эффективно свести к минимуму рецидивы и тяжесть носового кровотечения, в сочетании с терапией, перечисленной выше, можно использовать другие варианты. Вводимые внутривенно вещества против VEGF, такие как бевацизумаб (торговая марка Avastin), пазопинаб и талидомид или его производные, препятствуют образованию новых кровеносных сосудов, которые слабы и поэтому склонны к кровотечениям. Из-за прошлого опыта назначения талидомида беременным женщинам для облегчения симптомов тошноты и ужасных врожденных дефектов, которые последовали за этим, талидомид является терапией последнего средства. Кроме того, талидомид может вызывать невропатию. Хотя это можно смягчить, изменяя дозировку и назначая его производные, такие как ленолидомид и помалидомид, многие врачи предпочитают альтернативные ингибиторы VEGF. Было показано, что бевацизумаб значительно снижает тяжесть носового кровотечения без побочных эффектов.
Если другие вмешательства оказались безуспешными, сообщалось, что несколько операций принесли пользу. Одна из них — септальная дермопластика или процедура Сондерса[17], при которой кожа пересаживается в ноздри, а другая — процедура Янга[17], при которой ноздри полностью закрываются[8][17].
После купирования носовых кровотечений рекомендуется применение местных эпителизирующих и регенерирующих препаратов, содержащих ланолин, витамин E, дексапантенол. Чем чаще будет применение (7—8 раз в день), тем выше шансы благоприятного исхода.
Очень важно в период купирования носовых кровотечений максимально контролировать АД, ЧСС, избегать любых физических нагрузок вплоть до назначения слабительных препаратов, чтобы исключить повышение давления, связанное с потугами во время акта дефекации.
Кожа и пищеварительный тракт[править | править код]
Поражения кожи при НГТ могут быть неэстетичными и могут поддаваться лечению длинноимпульсным Nd:YAG-лазером[4]. Повреждения кожи на кончиках пальцев могут иногда кровоточить и вызывать боль. Иногда для лечения этой проблемы требуется пересадка кожи.
Что касается поражений желудочно-кишечного тракта, легкое кровотечение и умеренная возникающая в результате анемия лечатся добавками железа, и никакого специального лечения не проводится. Имеются ограниченные данные о гормональной терапии и транексамовой кислоте для уменьшения кровотечения и анемии. Тяжелая анемия или эпизоды сильного кровотечения лечатся эндоскопической аргоноплазменной коагуляцией (АПК) или лазерным лечением любых выявленных поражений; это может снизить потребность в поддерживающем лечении. Ожидаемые преимущества не таковы, чтобы пропагандировать повторные попытки лечения поражений. Внезапное, очень сильное кровотечение необычно — если оно встречается, необходимо учитывать альтернативные причины (например, пептическую язву) [8] — но в таких случаях можно использовать эмболизацию [3].
АВМ легких[править | править код]
Повреждения легких после выявления обычно лечат, чтобы предотвратить эпизоды кровотечения и, что более важно, эмболию головного мозга. В частности, это делается при поражениях с питающим кровеносным сосудом диаметром 3 мм и более, поскольку они с наибольшей вероятностью могут вызвать долговременные осложнения, если их не лечить. Наиболее эффективной современной терапией является эмболизация съемными металлическими спиралями или заглушками [18]. Процедура включает пункцию крупной вены (обычно под общей анестезией) с последующим продвижением катетера через правый желудочек в легочную артерию, после чего вводят рентгеноконтрастное вещество для визуализации АВМ (легочная ангиография). После того, как поражение было идентифицировано, развертываются спирали, которые препятствуют кровотоку и позволяют поражению регрессировать. В опытных руках процедура, как правило, очень эффективна и имеет ограниченные побочные эффекты, но поражения могут повторяться, и могут потребоваться дополнительные попытки. КТ-сканирование повторяется для контроля повторения[4][5][6][7][8]. В настоящее время от хирургического иссечения практически отказались из-за успеха эмболотерапии.
Те, у кого есть определенные легочные АВМ или аномальная контрастная эхокардиограмма без четко видимых поражений, считаются подверженными риску эмболии головного мозга. Поэтому им рекомендуется избегать подводного плавания, во время которого в кровотоке могут образоваться маленькие пузырьки воздуха, которые могут мигрировать в мозг и вызвать инсульт. Точно так же рекомендуется антимикробная профилактика во время процедур, при которых бактерии могут попасть в кровоток, таких как стоматологические процедуры, и избегать пузырьков воздуха во время внутривенной терапии.
АВМ печени[править | править код]
Учитывая, что АВМ печени, как правило, вызывают сердечную недостаточность с высоким выбросом, акцент делается на ее лечении диуретиками для уменьшения объема циркулирующей крови, ограничением потребления соли и жидкости и антиаритмическими средствами при нерегулярном сердцебиении. Этого может быть достаточно для лечения симптомов отека и одышки. Если это лечение неэффективно или приводит к побочным эффектам или осложнениям, единственным оставшимся вариантом является трансплантация печени. Это предназначено для людей с тяжелыми симптомами, так как смертность составляет около 10%, но в случае успеха приводит к хорошим результатам. Точный момент, когда должна быть предложена трансплантация печени, еще полностью не установлен[7]. Была предпринята попытка лечения эмболизацией, но она приводит к серьезным осложнениям у части пациентов и не рекомендуется [6][7][8].
Другие осложнения, связанные с печенью (портальная гипертензия, варикозное расширение вен пищевода, асцит, печеночная энцефалопатия) лечат теми же методами, что и при циррозе печени, хотя использование трансъюгулярного внутрипеченочного портосистемного шунтирования не рекомендуется из-за отсутствия документированных преимуществ [7].
Мозговые АВМ[править | править код]
Решение о лечении артериовенозных мальформаций головного мозга зависит от симптомов, которые они вызывают (например, судороги или головные боли). Риск кровотечения прогнозируется по предшествующим эпизодам кровотечения, а также по тому, является ли АВМ глубоко расположенным или имеет глубокий венозный отток на КТА или МРА. Размер АВМ и наличие аневризм, по-видимому, имеют меньшее значение[15]. При HГT некоторые поражения (артериовенозные фистулы с высоким потоком) имеют тенденцию вызывать больше проблем, и лечение оправдано. Другие АВМ могут со временем регрессировать без вмешательства[8]. Доступны различные методы, в зависимости от расположения АВМ и ее размера: хирургическое вмешательство, лучевое лечение и эмболизация. Иногда для одного и того же поражения используются несколько методов[4][15].
Хирургическое вмешательство (трепанация черепа, открытая операция на головном мозге) может быть предложено на основании рисков лечения, определяемых по шкале Шпецлера-Мартина (степень I-V); этот показатель выше при более крупных поражениях, близких к важным структурам головного мозга и имеющих глубокий венозный отток. Повреждения высокой степени (IV и V) имеют неприемлемо высокий риск, и в таких случаях хирургическое вмешательство обычно не предлагается. Радиохирургия (с использованием направленной лучевой терапии, такой как гамма-нож) может использоваться, если поражение небольшое, но близко к витальным структурам. Наконец, эмболизация может использоваться при небольших поражениях, имеющих только один питающий сосуд[15].
Экспериментальные методы лечения[править | править код]
Несколько препаратов против ангиогенеза, одобренных для лечения других состояний, таких как рак, были исследованы в ходе небольших клинических испытаний[19]. Например, бевацизумаб, антитело против VEGF, использовалось не по прямому назначению в нескольких исследованиях. В крупном клиническом исследовании инфузия бевацизумаба ассоциировалась со снижением сердечного выброса и уменьшением продолжительности и количества эпизодов носового кровотечения у пациентов, получавших лечение НГТ[20]. Сообщалось также, что талидомид, другой препарат против ангиогенеза, оказывает благоприятное воздействие на пациентов с НГТ[21]. Было обнаружено, что лечение талидомидом индуцирует созревание сосудов в экспериментальной мышиной модели HГT и снижает тяжесть и частоту носовых кровотечений у большинства из небольшой группы пациентов с HГT. Уровни гемоглобина в крови этих пролеченных пациентов повысились в результате уменьшения кровотечения и улучшения стабилизации кровеносных сосудов[22].
Эпидемиология[править | править код]
Популяционные исследования во многих регионах мира показали, что HГT встречается примерно с одинаковой частотой почти во всех популяциях: где-то около 1 на 5000. В некоторых районах это встречается гораздо чаще; например, во французском регионе Верхняя Юра этот показатель составляет 1:2351 — в два раза чаще, чем в других популяциях. Это было связано с эффектом основателя, при котором популяция, происходящая от небольшого числа предков, имеет высокий уровень определенного генетического признака, потому что один из этих предков обладал этим признаком. Было показано, что в Верхней Юре это является результатом конкретной мутации ACVRL1 (названной c.1112dupG или c.1112_1113insG) [4]. Самый высокий показатель HГT составляет 1: 1331, зарегистрированный на Бонайре и Кюрасао, двух островах в Карибском море, принадлежащих Нидерландским Антильским островам.
У большинства людей с НГТ нормальная продолжительность жизни[3].Поражения кожи и носовые кровотечения, как правило, развиваются в детстве. АВМ, вероятно, присутствуют с рождения, но не обязательно вызывают какие-либо симптомы. Частые кровотечения из носа являются наиболее распространенным симптомом и могут существенно повлиять на качество жизни[8].
История[править | править код]
Несколько английских врачей XIX века, начиная с Генри Гавена Саттона (1836–1891), затем Бенджамина Гая Бабингтона (1794–1866)[23] и Джона Уикхема Легга (1843–1921)[24], описали наиболее распространенные особенности НГТ, особенно рецидивирующие носовые кровотечения и наследственный характер заболевания. Французский врач Анри Жюль Луи Мари Рендю (1844–1902) наблюдал поражения кожи и слизистых оболочек и отличил это состояние от гемофилии. Родившийся в Канаде сэр Уильям Ослер (1849–1919), затем работавший в больнице Джона Хопкинса, а затем в Оксфордском университете, внес дополнительный вклад в отчет 1901 года, в котором он описал характерные поражения пищеварительного тракта. Английский врач Фредерик Паркес Вебер (1863–1962) в 1907 г. сообщил об этом заболевании в серии случаев. Термин «наследственная геморрагическая телеангиэктазия» впервые был использован американским врачом Фредериком М. Хейнсом (1883–1946) в статье 1909 года об этом заболевании.
Диагноз HГT оставался клиническим до тех пор, пока исследовательская группа Медицинского центра Университета Дьюка не выявила генетические дефекты, вызывающие патологию, в 1994 и 1996 годах соответственно. В 2000 году международный научно-консультативный комитет по лечению HГT, ранее называвшийся HHT Foundation International, опубликовал широко используемые в настоящее время критерии Кюрасао.
Примечания[править | править код]
- ↑ Disease Ontology (англ.) — 2016.
- ↑ Uichiro Fuchizaki, Hirotoshi Miyamori, Shunsuke Kitagawa, Shuichi Kaneko, Kenichi Kobayashi. Hereditary haemorrhagic telangiectasia (Rendu-Osler-Weber disease) (англ.) // The Lancet. — 2003-11. — Vol. 362, iss. 9394. — P. 1490–1494. — doi:10.1016/S0140-6736(03)14696-X. Архивировано 18 июня 2022 года.
- ↑ 1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 16 17 18 19 20 Fatima S Govani, Claire L Shovlin. Hereditary haemorrhagic telangiectasia: a clinical and scientific review (англ.) // European Journal of Human Genetics. — 2009-07. — Vol. 17, iss. 7. — P. 860–871. — ISSN 1476-5438 1018-4813, 1476-5438. — doi:10.1038/ejhg.2009.35. Архивировано 27 сентября 2022 года.
- ↑ 1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 16 17 18 S. Dupuis‐Girod, S. Bailly, H. Plauchu. Hereditary hemorrhagic telangiectasia: from molecular biology to patient care (англ.) // Journal of Thrombosis and Haemostasis. — 2010-07. — Vol. 8, iss. 7. — P. 1447–1456. — doi:10.1111/j.1538-7836.2010.03860.x. Архивировано 14 марта 2023 года.
- ↑ 1 2 3 4 5 James R. Gossage, Ghassan Kanj. Pulmonary Arteriovenous Malformations: A State of the Art Review (англ.) // American Journal of Respiratory and Critical Care Medicine. — 1998-08-01. — Vol. 158, iss. 2. — P. 643–661. — ISSN 1535-4970 1073-449X, 1535-4970. — doi:10.1164/ajrccm.158.2.9711041. Архивировано 28 апреля 2023 года.
- ↑ 1 2 3 4 5 6 7 8 M. E. Faughnan, J. T. Granton, L. H. Young. The pulmonary vascular complications of hereditary haemorrhagic telangiectasia (англ.) // European Respiratory Journal. — 2009-05-01. — Vol. 33, iss. 5. — P. 1186–1194. — ISSN 1399-3003 0903-1936, 1399-3003. — doi:10.1183/09031936.00061308.
- ↑ 1 2 3 4 5 6 7 Elisabetta Buscarini, Henry Plauchu, Guadalupe Garcia Tsao, Robert I. White, Carlo Sabbà, Franklin Miller, Jean Cristophe Saurin, Jean Pierre Pelage, Gaetan Lesca, Marie Jeanne Marion, Annalisa Perna, Marie E. Faughnan. Liver involvement in hereditary hemorrhagic telangiectasia: consensus recommendations (англ.) // Liver International. — 2006-11. — Vol. 26, iss. 9. — P. 1040–1046. — ISSN 1478-3231 1478-3223, 1478-3231. — doi:10.1111/j.1478-3231.2006.01340.x. Архивировано 28 апреля 2023 года.
- ↑ 1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 16 17 18 19 20 M. E. Faughnan, V. A. Palda, G. Garcia-Tsao, U. W. Geisthoff, J. McDonald, D. D. Proctor, J. Spears, D. H. Brown, E. Buscarini, M. S. Chesnutt, V. Cottin, A. Ganguly, J. R. Gossage, A. E. Guttmacher, R. H. Hyland, S. J. Kennedy, J. Korzenik, J. J. Mager, A. P. Ozanne, J. F. Piccirillo, D. Picus, H. Plauchu, M. E. M. Porteous, R. E. Pyeritz, D. A. Ross, C. Sabba, K. Swanson, P. Terry, M. C. Wallace, C. J. J. Westermann, R. I. White, L. H. Young, R. Zarrabeitia. International guidelines for the diagnosis and management of hereditary haemorrhagic telangiectasia (англ.) // Journal of Medical Genetics. — 2011-02-01. — Vol. 48, iss. 2. — P. 73–87. — ISSN 1468-6244 0022-2593, 1468-6244. — doi:10.1136/jmg.2009.069013.
- ↑ 1 2 3 4 5 6 S A Abdalla. Hereditary haemorrhagic telangiectasia: current views on genetics and mechanisms of disease (англ.) // Journal of Medical Genetics. — 2005-06-17. — Vol. 43, iss. 2. — P. 97–110. — ISSN 1468-6244. — doi:10.1136/jmg.2005.030833.
- ↑ K.A. McAllister, K.M. Grogg, D.W. Johnson, C.J. Gallione, M.A. Baldwin, C.E. Jackson, E.A. Helmbold, D.S. Markel, W.C. McKinnon, J. Murrel, M.K. McCormick, M.A. Pericak-Vance, P. Heutink, B.A. Oostra, T. Haitjema, C.J.J. Westerman, M.E. Porteous, A.E. Guttmacher, M. Letarte, D.A. Marchuk. Endoglin, a TGF-β binding protein of endothelial cells, is the gene for hereditary haemorrhagic telangiectasia type 1 (англ.) // Nature Genetics. — 1994-12. — Vol. 8, iss. 4. — P. 345–351. — ISSN 1546-1718 1061-4036, 1546-1718. — doi:10.1038/ng1294-345. Архивировано 17 января 2023 года.
- ↑ D.W. Johnson, J.N. Berg, M.A. Baldwin, C.J. Gallione, I. Marondel, S.-J. Yoon, T.T. Stenzel, M. Speer, M.A. Pericak-Vance, A. Diamond, A.E. Guttmacher, C.E. Jackson, L. Attisano, R. Kucherlapati, M.E.M. Porteous, D.A. Marchuk. Mutations in the activin receptor–like kinase 1 gene in hereditary haemorrhagic telangiectasia type 2 (англ.) // Nature Genetics. — 1996-06. — Vol. 13, iss. 2. — P. 189–195. — ISSN 1546-1718 1061-4036, 1546-1718. — doi:10.1038/ng0696-189. Архивировано 17 января 2023 года.
- ↑ S G Cole. A new locus for hereditary haemorrhagic telangiectasia (HHT3) maps to chromosome 5 (англ.) // Journal of Medical Genetics. — 2005-07-01. — Vol. 42, iss. 7. — P. 577–582. — ISSN 1468-6244. — doi:10.1136/jmg.2004.028712.
- ↑ Pinar Bayrak-Toydemir, Jamie McDonald, Nurten Akarsu, Reha M. Toydemir, Fernanda Calderon, Timur Tuncali, Wei Tang, Franklin Miller, Rong Mao. A fourth locus for hereditary hemorrhagic telangiectasia maps to chromosome 7 (англ.) // American Journal of Medical Genetics Part A. — 2006-10-15. — Vol. 140A, iss. 20. — P. 2155–2162. — doi:10.1002/ajmg.a.31450. Архивировано 28 апреля 2023 года.
- ↑ Carol J Gallione, Gabriela M Repetto, Eric Legius, Anil K Rustgi, Susan L Schelley, Sabine Tejpar, Grant Mitchell, Éric Drouin, Cornelius JJ Westermann, Douglas A Marchuk. A combined syndrome of juvenile polyposis and hereditary haemorrhagic telangiectasia associated with mutations in MADH4 ( SMAD4) (англ.) // The Lancet. — 2004-03. — Vol. 363, iss. 9412. — P. 852–859. — doi:10.1016/S0140-6736(04)15732-2. Архивировано 20 марта 2023 года.
- ↑ 1 2 3 4 5 Robert M. Friedlander. Arteriovenous Malformations of the Brain (англ.) // New England Journal of Medicine. — 2007-06-28. — Vol. 356, iss. 26. — P. 2704–2712. — ISSN 1533-4406 0028-4793, 1533-4406. — doi:10.1056/NEJMcp067192.
- ↑ C. L. Shovlin, A. E. Guttmacher, E. Buscarini, M. E. Faughnan, R. H. Hyland, C. J. Westermann, A. D. Kjeldsen, H. Plauchu. Diagnostic criteria for hereditary hemorrhagic telangiectasia (Rendu-Osler-Weber syndrome) // American Journal of Medical Genetics. — 2000-03-06. — Т. 91, вып. 1. — С. 66–67. — ISSN 0148-7299. — doi:10.1002/(sici)1096-8628(20000306)91:1<66::aid-ajmg12>3.0.co;2-p. Архивировано 4 мая 2023 года.
- ↑ 1 2 3 4 5 U. W. Geisthoff, M. L. Fiorella, R. Fiorella. Treatment of Recurrent Epistaxis in HHT (англ.) // Current Pharmaceutical Design. — Vol. 12, iss. 10. — P. 1237–1242. — doi:10.2174/138161206776361255. Архивировано 28 апреля 2023 года.
- ↑ Lucas R. Cusumano, Gary R. Duckwiler, Dustin G. Roberts, Justin P. McWilliams. Treatment of Recurrent Pulmonary Arteriovenous Malformations: Comparison of Proximal Versus Distal Embolization Technique (англ.) // CardioVascular and Interventional Radiology. — 2020-01. — Vol. 43, iss. 1. — P. 29–36. — ISSN 1432-086X 0174-1551, 1432-086X. — doi:10.1007/s00270-019-02328-0.
- ↑ Claire L. Shovlin. Hereditary haemorrhagic telangiectasia: Pathophysiology, diagnosis and treatment (англ.) // Blood Reviews. — 2010-11. — Vol. 24, iss. 6. — P. 203–219. — doi:10.1016/j.blre.2010.07.001. Архивировано 3 августа 2022 года.
- ↑ Sophie Dupuis-Girod, Isabelle Ginon, Jean-Christophe Saurin, Denis Marion, Elsa Guillot, Evelyne Decullier, Adeline Roux, Marie-France Carette, Brigitte Gilbert-Dussardier, Pierre-Yves Hatron, Pascal Lacombe, Bernard Lorcerie, Sophie Rivière, Romain Corre, Sophie Giraud, Sabine Bailly, Gilles Paintaud, David Ternant, Pierre-Jean Valette, Henri Plauchu, Frédéric Faure. Bevacizumab in Patients With Hereditary Hemorrhagic Telangiectasia and Severe Hepatic Vascular Malformations and High Cardiac Output (англ.) // JAMA. — 2012-03-07. — Vol. 307, iss. 9. — ISSN 0098-7484. — doi:10.1001/jama.2012.250. Архивировано 5 мая 2020 года.
- ↑ Massimo Franchini, Francesco Frattini, Silvia Crestani, Carlo Bonfanti. Novel treatments for epistaxis in hereditary hemorrhagic telangiectasia: a systematic review of the clinical experience with thalidomide (англ.) // Journal of Thrombosis and Thrombolysis. — 2013-10. — Vol. 36, iss. 3. — P. 355–357. — ISSN 1573-742X 0929-5305, 1573-742X. — doi:10.1007/s11239-012-0840-5.
- ↑ Franck Lebrin, Samly Srun, Karine Raymond, Sabrina Martin, Stieneke van den Brink, Catarina Freitas, Christiane Bréant, Thomas Mathivet, Bruno Larrivée, Jean-Léon Thomas, Helen M Arthur, Cornelis J J Westermann, Frans Disch, Johannes J Mager, Repke J Snijder, Anne Eichmann, Christine L Mummery. Thalidomide stimulates vessel maturation and reduces epistaxis in individuals with hereditary hemorrhagic telangiectasia (англ.) // Nature Medicine. — 2010-04. — Vol. 16, iss. 4. — P. 420–428. — ISSN 1546-170X 1078-8956, 1546-170X. — doi:10.1038/nm.2131. Архивировано 4 мая 2023 года.
- ↑ J Reynolds. HEREDITARY EPISTAXIS. (англ.) // The Lancet. — 1865-09. — Vol. 86, iss. 2195. — P. 362–363. — doi:10.1016/S0140-6736(02)55197-7.
- ↑ ROYAL MEDICAL AND CHIRURGICAL SOCIETY (англ.) // The Lancet. — 1876-12. — Vol. 108, iss. 2781. — P. 856–858. — doi:10.1016/S0140-6736(02)49594-3.
Ссылки[править | править код]
- Ослера — Рандю болезнь // 1. Малая медицинская энциклопедия. — М.: Медицинская энциклопедия. 1991—96 гг. 2. Первая медицинская помощь. — М.: Большая Российская Энциклопедия. 1994 г. 3. Энциклопедический словарь медицинских терминов. — М.: Советская энциклопедия. — 1982—1984 гг.
- Официальная страница международной организации по борьбе с HHT
- Группа организации по борьбе с HHT
- Международное сообщество HHT
- Международное сообщество распространения информации о HHT
В другом языковом разделе есть более полная статья Hereditary hemorrhagic telangiectasia (англ.). |