Молекулярная орбиталь
Молекулярная орбиталь — математическая функция, описывающая волновое поведение одного электрона в молекуле. Эта функция может использоваться для расчета химических и физических свойств, таких как вероятность нахождения электрона в любой конкретной области. Термины атомная орбиталь и молекулярная орбиталь[1][2] были введены Робертом С. Малликеном в 1932 году для обозначения волновых функций одноэлектронной орбитали[3].
Обычно волновая функция молекулы ищется в виде детерминанта Слэйтера, образованного из молекулярных орбиталей с неизвестными коэффициентами. Коэффициенты находятся из решения уравнения Шрёдингера одним из методов квантовой механики, например вариационным методом, одним из которых является метод Хартри — Фока.
Одноэлектронная волновая функция описывает движение электрона в эффективном поле ядер и других электронов молекулы как целого. Такая орбиталь простирается на всю молекулу или на много атомов в молекуле и представляется как комбинация атомных орбиталей. Графически дается контурной диаграммой, на которой волновая функция имеет определённое значение, или указанием области пространства с фиксированной высокой вероятностью нахождения электрона, занимающего эту орбиталь, с указанием знака (+ или -) волновой функции в каждой части этой области.

Симметрия МО[править | править код]
Молекулярные орбитали (МО) строятся в виде разложения по nb базисным функциям (атомным орбиталям (АО)):
Энергии МО () и коэффициенты находят путем решения системы уравнений Рутана:
Здесь — интегралы перекрывания:
а — матричные элементы оператора Фока ():
Метод Хартри1-Фока2-Рутана3 (ХФ или HF) основан на вариационном принципе, применение которого к данной задаче состоит в нахождении набора коэффициентов , минимизирующих энергию многоэлектронной системы.
Полная волновая функция строится путем распределения ne электронов по nb молекулярным орбиталям (МО) () в соответствии с «принципом заполнения»: МО упорядочены по возрастанию энергии и заселяются в этой последовательности, при этом соблюдается принцип Паули4, согласно которому реализуются только те состояния, которые описываются волновыми функциями, антисимметричными по отношению к перестановке электронов. И в атоме, и в молекуле каждый способ расселения электронов по орбиталям соответствует электронной конфигурации. Чтобы задать электронную конфигурацию, требуется перечислить орбитали и указать число заполнения (количество электронов) в каждой. Например, для атома азота электронная конфигурация основного состояния 1s22s22p3. В приближении HF волновая функция соответствует единственной конфигурации.
1Douglas Rayner Hartree (1897—1958) — английский математик и физик, специализировавшийся в области численного анализа. Под влиянием визита в Кембридж Нильса Бора в 1921 г. занялся применением этих методов к решению дифференциальных уравнений для расчета волновых функций атома и в 1927 предложил процедуру, которая известна как метод самосогласованного поля.
2 Владимир Александрович Фок (1898—1974) — советский физик, работавший в Ленинградском университете. Помимо фундаментальных работ по квантовой механике, известен также исследованиями в области механики, теоретической оптики, теории гравитации, физики сплошных сред. В 1930 г. одновременно со Слэтером показал, что метод Хартри не обеспечивает антисимметрии волновой функции и предложил для реализации вариационного принципа использовать волновую функцию, представленную детерминантом Слэтера. Метод Хартри-Фока лежит в основе современной вычислительной квантовой химии.
3 Clemens C.J. Roothaan родился в 1918 г. в Неймегене в Нидерландах. В 1946 г. уехал в США, под руководством Р. Малликена занимался полуэмпирической теорией МО. В 1951 г. предложил решение уравнений Хартри-Фока для молекул, используя в качестве базисных функций молекулярные орбитали в форме ЛКАО. Уравнения Рутана положили начало широкому распространению неэмпирических или ab initio ("из первых принципов") расчетов молекулярных систем. Аналогичные уравнения в 1950 г. предложил George Garfield Hall, который основное внимание уделил частному случаю nb=ne.
4 Wolfgang Pauli (1900—1958) — австрийско-швейцарский физик-теоретик, один из основоположников квантовой механики. Получил нобелевскую премию по физике в 1945 г. В 1924 г. ввел в квантовую механику новую величину, названную Д. Уленбеком и С. Гудсмитом спином электрона. В 1930 г. предсказал нейтрино. Сформулировал принцип запрета Паули — закон, согласно которому никакие два электрона в системе не могут иметь одинаковые наборы квантовых чисел.
Пример 1. Матричные элементы оператора Фока и уравнения Рутана для молекулы аммиака.[править | править код]
В качестве базисных функций будем рассматривать симметризованные орбитали.
Строим симметризованные комбинации из s-орбиталей атомов водорода. Атомные орбитали (АО) и атома азота относятся к неприводимым представлениям (НП) , две орбитали, и образуют базис двумерного НП e.
| E | ||||||
|---|---|---|---|---|---|---|
| h1 | h1 | h2 | h3 | h1 | h3 | h2 |
| h2 | h2 | h3 | h1 | h3 | h2 | h1 |
Получаем три функции:
Нетрудно показать, что функции и не ортогональны. Ортогональную к базисную функцию НП е можно записать в виде: и : . Чтобы определить коэффициент , рассмотрим интеграл
Отсюда:
и
Нормируя эту функцию, получаем
В итоге таблица симметризованных орбиталей молекулы аммиака имеет вид:
| s, | ||
|---|---|---|
| e |
|
|
Но в наш набор не будет включена АО 1s атома азота, то есть используем так называемое «валентное приближение», характерное для полуэмпирических методов расчета.
Согласно теореме Вигнера-Эккарта, матрица оператора Фока (фокиан) будет иметь блочно-диагональный вид ():
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | ||
|---|---|---|---|---|---|---|---|---|
| s | f1 | f2 | f3 | |||||
| 1 | s | 0 | 0 | 0 | 0 | |||
| 2 | 0 | 0 | 0 | 0 | ||||
| 3 | f1 | 0 | 0 | 0 | 0 | |||
| 4 | 0 | 0 | 0 | 0 | 0 | |||
| 5 | f2 | 0 | 0 | 0 | 0 | 0 | ||
| 6 | 0 | 0 | 0 | 0 | 0 | |||
| 7 | f3 | 0 | 0 | 0 | 0 | 0 |
Аналогичную структуру имеет и матрица интегралов перекрывания (). Поэтому уравнение Рутана для имеет вид ():
для и :
для и :
для и :
Приведенные выше уравнения могут быть решены отдельно для блоков, построенных в базисе орбиталей и в базисе орбиталей и . Три молекулярные орбитали первого блока (с энергиями ) могут включать только , преобразующиеся по НП , две МО второго блока с энергиями — только и , преобразующиеся по первой строке НП е, две МО третьего блока с энергиями — только и , преобразующиеся по второй строке НП е. Из этого следует, что соответствующую симметрию имеют и МО
Таким образом, молекулярные орбитали можно классифицировать по симметрии.
Согласное теореме Вигнера-Эккарта: (и то же самое для ), поэтому и это же относится и к коэффициентам В результате два блока симметрии «е» дают две МО с энергиями и две МО с энергиями : одну и ту же энергию имеют пары МО, преобразующиеся по разным строкам одного и того же НП, в итоге каждое состояние вырождено столько раз, какова размерность НП, по которому преобразуются описывающие его функции.
Пример 2. Анализ молекулярных орбиталей молекулы воды.[править | править код]
Для анализа симметрии МО на основании результатов квантовохимического расчета необходимо:
- определить точечную группу молекулы
- проверить, какая система координат использована в расчете и совпадают ли элементы симметрии с приведенными в таблице характеров
- если заранее подготовлена таблица симметризованных орбиталей, полезно ею воспользоваться.
- Декартовы координаты атомов позволяют определить структуру молекулы и её ориентацию в пространстве.
- Точечная группа молекулы —
- Полуэмпирический расчет выполнен в валентном приближении, учитывается восемь электронов (ne=8): шесть электронов атома О и по одному электрону от двух атомов Н. Следовательно, четыре МО из шести заняты.
Декартовы координаты атомов Å
| x | y | z | ||
|---|---|---|---|---|
| 1 | O | 0. | 0. | 0. |
| 2 | H | 0. | 0.76 | 0.59 |
| 3 | H | 0. | -0.76 | 0.59 |
Матрица коэффициентов разложения МО по АО для молекулы воды, полученная полуэмпирическим методом РМЗ, имеет вид:
| 1 | O |
|
0.878
0. 0. −0.108 |
0.
0. 0.770 0. |
0.339
0. 0. 0.826 |
0.
1.000 0. 0. |
0.336
0. 0. −0.552 |
0.
0. 0.638 0. |
| 2 | H | 1s | 0.329 | 0.451 | -0.317 | 0. | 0.539 | -0.545 |
| 3 | H | 1s | 0.329 | -0.451 | -0.317 | 0. | 0.539 | 0.545 |
Чтобы определить симметрию каждой МО, необходимо проанализировать коэффициенты . Так как в одну и ту же МО не могут входить атомные или симметризованные орбитали, преобразующиеся по разным НП (неприводимым представлениям) группы, для определения симметрии МО достаточно рассмотреть лишь некоторые наиболее характерные вклады:
- В молекулярную орбиталь с ненулевыми коэффициентами входят только полносимметричные АО (атомные орбитали): и полносимметричная комбинация из этого следует, что МО имеет симметрию .
- МО имеет симметрию , поскольку она построена из АО и симметризованой орбитали вида преобразующихся по НП .
- МО имеет симметрию , поскольку, как и , она является линейной комбинацией орбиталей, преобразующихся по этому НП. Так как это уже вторая МО симметрии , ей присваивается номер 2: «2» в отличие от МО «1».
- HOMO состоит из АО атома О и имеет симметрию .
- LUMO включает АО 2s(O), этого достаточно, чтобы приписать ей симметрию ; это третья полносимметричная МО.
- МО с большим вкладом АО имеет симметрию .
Таким образом, согласно результатам данного расчета, молекула воды в основном состоянии имеет электронную конфигурацию .
ВЗМО и НВМО[править | править код]
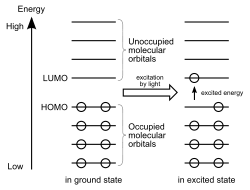
В основном состоянии молекулы её электроны заполняют все орбитали с наименьшими энергиями. Орбиталь, которая среди заполненных в основном состоянии имеет наибольшую энергию, обычно обозначается аббревиатурой ВЗМО (высшая занятая молекулярная орбиталь) или, чаще, английской аббревиатурой HOMO (highest occupied molecular orbital).
Следующая по энергии орбиталь называется НВМО (низшая вакантная молекулярная орбиталь) или LUMO (lowest unoccupied molecular orbital — низшая незаполненная молекулярная орбиталь). НВМО — полностью или частично вакантная молекулярная орбиталь, которая из всех заселённых орбиталей химической частицы имеет наименьшую энергию. Её энергия получается расчётом методом молекулярных орбиталей и представляет сродство к электрону данной молекулярной частицы, а также может характеризовать реактивность такой частицы как электрофила.
Локализованной называется молекулярная орбиталь, простирающаяся не на всю молекулу, а только на определённый её фрагмент, и пространственно выделенная среди других орбиталей. Например, локализована молекулярная орбиталь типа σ, приближенно описывающая связи C-H в метане.
Примечания[править | править код]
- ↑ orbital // Dictionary by Merriam-Webster: America's most-trusted online dictionary. — Merriam-Webster. Архивная копия от 2 ноября 2021 на Wayback Machine
- ↑ Brown, Theodore. Chemistry : the central science. — Upper Saddle River, NJ : Prentice Hall, 2002. — ISBN 0-13-066997-0.
- ↑ Mulliken, Robert S. (July 1932). "Electronic Structures of Polyatomic Molecules and Valence. II. General Considerations". Physical Review. 41 (1): 49—71. Bibcode:1932PhRv...41...49M. doi:10.1103/PhysRev.41.49.
Ссылки[править | править код]
- Молекулярная орбиталь // Физическая энциклопедия : [в 5 т.] / Гл. ред. А. М. Прохоров. — М.: Советская энциклопедия (т. 1—2); Большая Российская энциклопедия (т. 3—5), 1988—1999. — ISBN 5-85270-034-7.
- Приседский В. В. Молекулярные орбитали (Учебное пособие к изучению блока «Химическая связь» в курсах химии для студентов химических специальностей). — Донецк: ДонНТУ, 2009. — 42 с. Архивная копия от 19 сентября 2013 на Wayback Machine
- Java molecular orbital viewer shows orbitals of hydrogen molecular ion.
- The orbitron, a visualization of all atomic, and some molecular and hybrid orbitals
- xeo Visualizations of some atomic and molecular atoms
- OrbiMol Molecular orbital database.







































































































