Ku
| Перекрестно-комплементирующий белок репарации рентгеновских повреждений 5 | |
|---|---|
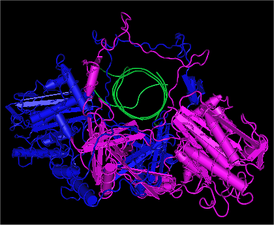
![Кристаллическая структура белка Ku человека, связанного с ДНК. Ku70 показан пурпурным, Ku80 синим, а цепочки ДНК зеленым.[1]](http://upload.wikimedia.org/wikipedia/commons/thumb/6/64/Ku_bound_to_DNA.png/274px-Ku_bound_to_DNA.png) Кристаллическая структура белка Ku человека, связанного с ДНК. Ku70 показан пурпурным, Ku80 синим, а цепочки ДНК зеленым.[1] | |
| Обозначения | |
| Символы | XRCC5; Ku80 |
| Entrez Gene | 7520 |
| HGNC | 12833 |
| OMIM | 194364 |
| PDB | 1JEY |
| RefSeq | NM_021141 |
| UniProt | P13010 |
| Другие данные | |
| Локус | 2-я хр. , 2q35 |
| Перекрестно-комплементирующий белок репарации рентгеновских повреждений 6 | |
|---|---|
 | |
| Обозначения | |
| Символы | XRCC6; Ku70, G22P1 |
| Entrez Gene | 2547 |
| HGNC | 4055 |
| OMIM | 152690 |
| PDB | 1JEY |
| RefSeq | NM_001469 |
| UniProt | P12956 |
| Другие данные | |
| Локус | 22-я хр. , 22q11 -q13 |
Ku — белок, связывающийся с двуцепочечными разрывами в структуре ДНК. Ku необходим для репарации ДНК по пути негомологичного соединения концов (NHEJ). Эволюционно Ku консервативен от бактерий до человека. Древний бактериальный Ku является гомодимером,[2] эукариотический гомолог Ku — гетеродимер, состоящий из двух полипептидов — Ku70 (продукт гена XRCC6) и Ku80 (закодирован геном XRCC5), молекулярная масса этих полипептидов составляет 70 и 80 кДа, соответственно. Субъединицы Ku образуют корзиноподобную структуру, закрепляющуюся на конце молекулы ДНК.[3] После связывания Ku может скользить по цепочке ДНК, на конец которой могут нанизываться новые молекулы Ku. У высших эукариот Ku образует комплекс с каталитической субъединицей ДНК-зависимой протеинкиназы (DNA-PKcs) и образует полную ДНК-зависимую протеинкиназу, DNA-PK.[4] Ku, по-видимому, функционирует как молекулярный остов, к которому прикрепляются другие белки, принимающие участие в процессе NHEJ.
Обе субъединицы Ku были экспериментально удалены из генома мыши. Такие мыши имели различные хромосомные перестройки, что указывает на необходимость NHEJ для поддержания целостности генома.[5][6]
Во многих организмах Ku имеет дополнительные функции по поддержанию структуры теломер.[7]
Обилие Ku80 по-видимому, влияет на продолжительность жизни организмов.[8]
Примечания[править | править код]
- ↑ PDB 1JEY; Walker J.R., Corpina R.A., Goldberg J. Structure of the Ku heterodimer bound to DNA and its implications for double-strand break repair (англ.) // Nature : journal. — 2001. — August (vol. 412, no. 6847). — P. 607—614. — doi:10.1038/35088000. — PMID 11493912.
- ↑ Doherty A.J., Jackson S.P., Weller G.R. Identification of bacterial homologues of the Ku DNA repair proteins (англ.) // FEBS Letters : journal. — 2001. — July (vol. 500, no. 3). — P. 186—188. — doi:10.1016/S0014-5793(01)02589-3. — PMID 11445083.
- ↑ Walker J.R., Corpina R.A., Goldberg J. Structure of the Ku heterodimer bound to DNA and its implications for double-strand break repair (англ.) // Nature : journal. — 2001. — August (vol. 412, no. 6847). — P. 607—614. — doi:10.1038/35088000. — PMID 11493912.
- ↑ Carter T., Vancurová I., Sun I., Lou W., DeLeon S. A DNA-activated protein kinase from HeLa cell nuclei (англ.) // Molecular and Cellular Biology : journal. — 1990. — December (vol. 10, no. 12). — P. 6460—6471. — PMID 2247066. — PMC 362923.
- ↑ Difilippantonio M.J., Zhu J., Chen H.T., Meffre E., Nussenzweig M.C., Max E.E., Ried T., Nussenzweig A. DNA repair protein Ku80 suppresses chromosomal aberrations and malignant transformation (англ.) // Nature : journal. — 2000. — March (vol. 404, no. 6777). — P. 510—514. — doi:10.1038/35006670. — PMID 10761921.
- ↑ Ferguson D.O., Sekiguchi J.M., Chang S., Frank K.M., Gao Y., DePinho R.A., Alt F.W. The nonhomologous end-joining pathway of DNA repair is required for genomic stability and the suppression of translocations (англ.) // Proceedings of the National Academy of Sciences of the United States of America : journal. — 2000. — June (vol. 97, no. 12). — P. 6630—6633. — doi:10.1073/pnas.110152897. — PMID 10823907. — PMC 18682.
- ↑ Boulton S.J., Jackson S.P. Components of the Ku-dependent non-homologous end-joining pathway are involved in telomeric length maintenance and telomeric silencing (англ.) // The EMBO Journal : journal. — 1998. — March (vol. 17, no. 6). — P. 1819—1828. — doi:10.1093/emboj/17.6.1819. — PMID 9501103. — PMC 1170529.
- ↑ Lorenzini A., Johnson F.B., Oliver A., Tresini M., Smith J.S., Hdeib M., Sell C., Cristofalo V.J., Stamato T.D. Significant correlation of species longevity with DNA double strand break recognition but not with telomere length (англ.) // Mech Ageing Dev. : journal. — 2009. — Nov-Dec (vol. 130, no. 11—12). — P. 784—792. — doi:10.1016/j.mad.2009.10.004. — PMID 19896964. — PMC 2799038.
Это заготовка статьи по молекулярной биологии. Помогите Википедии, дополнив её. |