Бета-амилоиды
Бета-амило́иды (англ. amyloid beta, Aβ) — общее название для нескольких пептидов, состоящих из примерно 40 аминокислотных остатков и образующихся из трансмембранного белка — предшественника бета-амилоида. Основными разновидностями являются пептид из 40 аминокислотных остатков (Aβ40) и пептид из 42 аминокислотных остатков (Aβ42)[1]. Их роль в нормальной физиологии остаётся неизвестной, но предполагается, что они могут участвовать в антибактериальной и противогрибковой защите[2]. Пептид Aβ40 не имеет патогенных свойств, но пептид Aβ42 считается одним из основных факторов, провоцирующих болезнь Альцгеймера и часто называется просто бета-амилоидом, без уточнения длины аминокислотной цепочки. В мозге пациента, страдающего болезнью Альцгеймера, этот пептид может образовывать так называемые амилоидные бляшки, состоящие из скоплений пептида, свёрнутого в виде бета-складки. Пептид Aβ42 может также образовывать олигомеры, которые запускают цепные реакции образования амилоидных бляшек и тау-белков по прионному механизму[3].
Структура[править | править код]
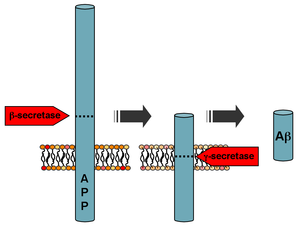
В организме бета-амилоиды образуются из предшественника бета-амилоида (англ. amyloid precursor protein, APP), трансмембранного гликопротеина с неизвестными функциями длиной от 695 до 770 аминокислотных остатков. Протеолиз APP с выходом бета-амилоида выполняют последовательно бета-секретаза и гамма-секретаза[4]. Бета-секретаза (англ. β-site amyloid precursor protein cleaving enzyme 1, BACE1) разрезает цепь аминокислотных остатков APP около плазматической мембраны с внутренней стороны. Гамма-секретаза разрезает цепь APP в трансмембранной области со значительной вариативностью по месту разрыва, вследствие чего возникает целое семейство пептидов с длиной цепочки от 30 до 51 звеньев[5]. Высвобожденные пептиды попадают в плазму крови, спинномозговую жидкость или другие межклеточные жидкости. В спинномозговой жидкости людей, не страдающих болезнью Альцгеймера, соотношение основных бета-амилоидов оценивается примерно как 50 % Aβ40, 16 % Aβ38 и 10 % Aβ42[6]. Функции большинства этих пептидов остаются неизвестными. Лучше всего исследован пептид Aβ42, который считается одним из ключевых патогенных факторов в развитии болезни Альцгеймера. Его аминокислотная последовательность имеет следующий вид[7]:
(N-конец) DAEFRHDSGYEVHHQKLVFFAEDVGSNKGAIIGLMVGGVVIA (C-конец)
Бета-амилоиды разрушаются некоторыми эндопептидазами. В мозге наиболее важную роль в поддержании баланса бета-амилоидов играет неприлизин — цинк-зависимая металлоэндопептидаза, которая в здоровом организме разрушает мономеры и олигомеры бета-амилоидов, компенсируя их образование из APP. Однако она неспособна разрушать амилоидные бляшки[8].
Роль в болезни Альцгеймера[править | править код]
Болезнь Альцгеймера — это одно из наиболее распространённых нейродегенеративных заболеваний пожилого возраста. В настоящее время не существует лекарств, способных замедлить развитие болезни, как не существует и полного понимания причин болезни. В рамках наиболее распространённой амилоидной гипотезы считается, что важную роль в запуске необратимых изменений в мозге пациента играет пептид Aβ42. Эта форма способна образовывать олигомеры и нерастворимые скопления значительного числа монопептидов в структуре бета-складки, которые получили название амилоидных бляшек. В первоначальном варианте амилоидной гипотезы, предложенной в начале 1990-х годов Харди и Хиггинсом, предполагалось, что амилоидные бляшки вызывают патологические изменения в мозге больного, которые проявляются в образовании нейрофибриллярных клубков, нарушении синаптической передачи, гибели нейронов и возникающей вследствие этого деменции[9].
По современным представлениям, Aβ42 запускает сложный комплекс процессов на биохимическом и клеточном уровнях, которые в конечном счёте приводят к нейродегенеративным изменениям в мозге[10]. Олигомеры бета-амилоида, находящиеся вне клеток, связываются с аллостерическим сегментом адренорецепторов типа α2A и модулируют активность рецептора. Рецептор избыточно активирует сигнальный путь с участием киназы гликогенсинтазы (GSK3β), вследствие чего внутри нейронов начинает накапливаться фосфорилированный тау-белок, предшественник патологического тау-белка. При этом для активации рецептора достаточно небольших концентраций бета-амилоидов, и по этой причине лекарства, направленные на борьбу с самими бета-амилоидами, оказываются малоэффективными. Ингибирование сигнального пути GSK3β привело к заметному улучшению когнитивных функций у мышей[11].
В 2015 году в исследованиях британских медиков было установлено, что существует опасность заражения бета-амилоидами ятрогенным путём, то есть в ходе таких медицинских процедур, как, например, хирургические операции или инъекции. При вскрытии в мозговой ткани пациентов, умерших от болезни Крейтцфельдта — Якоба, были найдены бета-амилоидные бляшки. Возраст и генетический портрет части этих пациентов исключал самопроизвольное развитие бета-амилоидных патологий, поэтому исследователи с большой степенью вероятности назвали причиной амилоидного заболевания инъекции гормона роста, получавшегося из гипофиза умерших людей. Эти инъекции проводились в основном для коррекции отставания в росте у детей в период с 1958 по 1985 годы, пока не была установлена опасность заражения прионными заболеваниями.
В 2018 году были опубликованы результаты исследований, подтверждающие возможность заражения болезнью Крейтцфельда — Якоба при введении мышам «загрязненного» бета-амилоидом гормона роста человека. У экспериментальной группы генно-модифицированных мышей, у которых синтезировался предшественник человеческого варианта бета-амилоида, образовывались бляшки в мозговых структурах, в то время как у контрольной группы этого не наблюдалось[12].
Если опасность заражения болезнью Альцгеймера при медицинских процедурах будет признана существенной, это повлечёт за собой серьёзные и потенциально чрезвычайно дорогостоящие изменения в регламенте обеззараживания медицинских инструментов. Бета-амилоиды имеют тенденцию «прилипать» к металлическим инструментам, и их надёжная дезинфекция от прионов потребует гораздо более жёстких условий, чем от бактерий и вирусов[13].
Согласно исследованиям, проведённым на животных, бета-амилоиды могут выступать в роли противовирусного[14], противогрибкового и антибактериального[15] механизма защиты мозга. При заражении вирусом герпеса мышей нервные клетки начинают активно вырабатывать бета-амилоиды, связывающие вирус, что вызывает образование амилоидных бляшек, но препятствует развитию энцефалита[14].
Роль в нарушениях сна и памяти[править | править код]
Уровень растворимых бета-амилоидов повышается в организме во время бодрствования и уменьшается во время сна. В исследованиях на мышах установлено, что депривация сна ускоряет накопление бета-амилоида у мышей, мутантных по гену предшественника бета-амилоида (APP), а накопление бета-амилоида у таких мышей нарушает сон[16]. Нарушение ритма сна и бодрствования с возрастом, приводящее к увеличению концентрации бета-амилоида, коррелирует с ухудшением качества сна и может быть одним из механизмов, влияющих на нарушения памяти при старении и при болезни Альцгеймера[17].
Лекарственные средства[править | править код]
Для снижения уровня Aβ42 ведётся поиск препаратов, которые препятствуют его образованию в мозге или удаляют уже образовавшиеся бляшки в тканях. Эти исследования проводятся по трём основным направлениям: как воспрепятствовать образованию Aβ42, как очистить уже накопившиеся бляшки Aβ42 и как предотвратить олигомеризацию Aβ42. В 1995 году исследователям удалось вывести линию трансгенных мышей с мутантным человеческим геном APP, в мозге которых накапливались амилоидные бляшки[18]. Эти мыши хуже справлялись с задачами, в которых требовалось запоминание информации, и они стали моделью для изучения действий перспективных противоамилоидных препаратов. Однако до сих пор никакие препараты, испытывавшиеся на мышах, не показали свою эффективность на людях. Одной из возможных причин неудач переноса результатов исследований на мышах на человека может быть различие в нейрохимии и патофизиологии мышиных и человеческих нейронов. В 2014 году группе учёных под руководством Рудольфа Танци (Tanzi Rudolph) и Ким Ду Ёна удалось создать трёхмерную культуру человеческих клеток in vitro, в которой в ускоренном темпе воспроизводятся нейродегенеративные изменения, связанные с бета-амилоидами, а также таупатии[19]. Это достижение считается одним из наиболее многообещающих в плане быстрой разработки и тестирования препаратов, способных предотвратить развитие болезни Альцгеймера у человека, и его автор был включен в список ста наиболее влиятельных людей по версии Time 100 в 2015 году[20].
Стратегии создания лекарственных препаратов, направленных на предотвращение накопления амилоидных бляшек при болезни Альцгеймера, включают снижение концентрации амилоидогенных белков путём ингибирования или модулирования секретаз, особенно BACE1, протеолиз Aβ неприлизином или каталитическими антителами, а также удаление амилоидов путём иммунизации[21].
Примечания[править | править код]
- ↑ Gerald Karp. Cell and Molecular Biology: Concepts and Experiments. — 7th ed. — John Wiley & Sons, Inc., 2013. — P. 67. — 864 p. — ISBN 978-1118-30179-1.
- ↑ Олег Лищук. Болезнь Альцгеймера назвали ошибкой защиты от инфекций. nplus1.ru. Дата обращения: 19 февраля 2020. Архивировано 15 ноября 2019 года.
- ↑ Nussbaum Justin M., Seward Matthew E., Bloom George S. Alzheimer disease: a tale of two prions // Prion. — 2013. — Vol. 7. — P. 14-19. — ISSN 1933-6896. — doi:10.4161/pri.22118. Архивировано 23 ноября 2017 года.
- ↑ Wilquet Valérie, Strooper Bart De. Amyloid-beta precursor protein processing in neurodegeneration // Current Opinion in Neurobiology. — 2004. — Vol. 14. — P. 582—588. — ISSN 09594388. — doi:10.1016/j.conb.2004.08.001.
- ↑ Olsson F., Schmidt S., Althoff V., Munter L. M., Jin S., Rosqvist S., Lendahl U., Multhaup G., Lundkvist J. Characterization of Intermediate Steps in Amyloid Beta (Aβ) Production under Near-native Conditions // Journal of Biological Chemistry. — 2013. — Vol. 289. — P. 1540—1550. — ISSN 0021-9258. — doi:10.1074/jbc.M113.498246. Архивировано 28 октября 2016 года.
- ↑ Bibl Mirko, Gallus Marion, Welge Volker, Lehmann Sabine, Sparbier Katrin, Esselmann Hermann, Wiltfang Jens. Characterization of cerebrospinal fluid aminoterminally truncated and oxidized amyloid-β peptides // PROTEOMICS - Clinical Applications. — 2012. — Vol. 6. — P. 163—169. — ISSN 18628346. — doi:10.1002/prca.201100082.
- ↑ Kummer Markus P, Heneka Michael T. Truncated and modified amyloid-beta species // Alzheimer's Research & Therapy. — 2014. — Vol. 6. — P. 28. — ISSN 1758-9193. — doi:10.1186/alzrt258. Архивировано 7 июля 2015 года.
- ↑ Huang S.-M., Mouri A., Kokubo H., Nakajima R., Suemoto T., Higuchi M., Staufenbiel M., Noda Y., Yamaguchi H., Nabeshima T., Saido T. C., Iwata N. Neprilysin-sensitive Synapse-associated Amyloid-beta Peptide Oligomers Impair Neuronal Plasticity and Cognitive Function // Journal of Biological Chemistry. — 2006. — Vol. 281. — P. 17941—17951. — ISSN 0021-9258. — doi:10.1074/jbc.M601372200.
- ↑ Hardy J., Higgins G. Alzheimer's disease: the amyloid cascade hypothesis // Science. — 1992. — Vol. 256. — P. 184-185. — ISSN 0036-8075. — doi:10.1126/science.1566067.
- ↑ Musiek Erik S, Holtzman David M. Three dimensions of the amyloid hypothesis: time, space and 'wingmen' // Nature Neuroscience. — 2015. — Vol. 18. — P. 800-806. — ISSN 1097-6256. — doi:10.1038/nn.4018. — PMID 26007213.
- ↑ Полина Лосева. Найдено связующее звено между двумя маркерами болезни Альцгеймера. nplus1.ru. Дата обращения: 18 января 2020. Архивировано 24 июля 2020 года.
- ↑ John Collinge, Dominic M. Walsh, Sebastian Brandner, Peter Rudge, Takaomi Saido. Transmission of amyloid-β protein pathology from cadaveric pituitary growth hormone (англ.) // Nature. — 2018-12-13. — P. 1. — ISSN 1476-4687. — doi:10.1038/s41586-018-0790-y. Архивировано 13 декабря 2018 года.
- ↑ Abbott Alison. Autopsies reveal signs of Alzheimer’s in growth-hormone patients // Nature. — 2015. — Vol. 525. — P. 165-166. — ISSN 0028-0836. — doi:10.1038/525165a.
- ↑ 1 2 "Как вирус герпеса может вызвать болезнь Альцгеймера". Архивировано из оригинала 16 сентября 2018. Дата обращения: 16 сентября 2018.
{{cite news}}:|first=пропущен|last=(справка) - ↑ "Альцгеймерический белок защищает от инфекций". Архивировано из оригинала 16 сентября 2018. Дата обращения: 16 сентября 2018.
{{cite news}}:|first=пропущен|last=(справка) - ↑ Roh J. H., Huang Y., Bero A. W., Kasten T., Stewart F. R., Bateman R. J., Holtzman D. M. Disruption of the Sleep-Wake Cycle and Diurnal Fluctuation of -Amyloid in Mice with Alzheimer's Disease Pathology // Science Translational Medicine. — 2012. — Vol. 4. — P. 150ra122-150ra122. — ISSN 1946-6234. — doi:10.1126/scitranslmed.3004291.
- ↑ Lucey Brendan P., Bateman Randall J. Amyloid-β diurnal pattern: possible role of sleep in Alzheimer's disease pathogenesis // Neurobiology of Aging. — 2014. — Vol. 35. — P. S29-S34. — ISSN 01974580. — doi:10.1016/j.neurobiolaging.2014.03.035.
- ↑ Games Dora, Adams David, Alessandrini Ree, et. al. Alzheimer-type neuropathology in transgenic mice overexpressing V717F β-amyloid precursor protein // Nature. — 1995. — Vol. 373. — P. 523-527. — ISSN 0028-0836. — doi:10.1038/373523a0.
- ↑ Choi Se Hoon, Kim Young Hye, Hebisch Matthias, Sliwinski Christopher, Lee Seungkyu, d’Avanzo Carla, Chen Hechao, Hooli Basavaraj, Asselin Caroline, Muffat Julien, Klee Justin B., Zhang Can, Wainger Brian J., Peitz Michael, Kovacs Dora M., Woolf Clifford J., Wagner Steven L., Tanzi Rudolph E., Kim Doo Yeon. A three-dimensional human neural cell culture model of Alzheimer’s disease // Nature. — 2014. — Vol. 515. — P. 274-278. — ISSN 0028-0836. — doi:10.1038/nature13800. Архивировано 29 мая 2016 года.
- ↑ Maria Shriver. Alzheimer's pioneer (16 апреля 2015). Дата обращения: 2 июля 2015. Архивировано 4 июля 2015 года.
- ↑ Eisele Y. S., Monteiro C., Fearns C., Encalada S. E., Wiseman R. L., Powers E. T., Kelly J. W. Targeting protein aggregation for the treatment of degenerative diseases (англ.) // Nat. Rev. Drug Discov.. — 2015. — Vol. 14, no. 11. — P. 759-780. — doi:10.1038/nrd4593.
Литература[править | править код]
- Татарникова О. Г. и соавт. Бета-амилоид и Тау-белок: структура, взаимодействие и прионоподобные свойства // Успехи биологической химии. — 2015. — Т. 55. — С. 351–390.
- Прионы и неинфекционные амилоиды млекопитающих — сходства и отличия / Галкин А.П., Велижанина М.Е., Сопова Ю.В., Шенфельд А.А., Задорский С.П. // Биохимия. — 2018. — Т. 83, № 10. — С. 1476-1489. [1]
- Науменко Д. Е. Является ли бета-амилоид причиной болезни Альцгеймера? // Наука и образование сегодня. — 2019. — № 9 (44). — С. 67-74. [2]
Ссылки[править | править код]
- Соотношение изоформ бета-амилоидного пептида — биомаркер риска развития умеренных когнитивных нарушений и деменции // Лечащий Врач. 17.09.2021.
- Видео
- Белковая наследственность, прионы и амилоиды // Президент России — молодым ученым. 29 сентября 2021. (Лектор Антон Нижников, доктор биологических наук)
- Научно-популярные публикации
- Александр Дергалев. Прионные и неприонные амилоиды: определяет ли конформация разницу в инфекционности? // Биомолекула. 25 ноября 2015. (Научно-популярный конкурс «био/мол/текст»-2015)
- Кирилл Стасевич. Альцгеймерический белок защищает от инфекций // Наука и жизнь. 30 мая 2016.
- Евгения Щербина. Белок болезни Альцгеймера путешествует из тела в мозг // ТАСС Наука. 12 ноября 2017.
- Полина Лосева. Бета-амилоиды из мозга людей с болезнью Альцгеймера оказались непохожи на лабораторный аналог // N+1. 29 октября 2019.
- Полина Лосева. Мышей заразили болезнью Альцгеймера через кишечник // Элементы. 24.07.2020.
- Амилоидные бляшки при болезни Альцгеймера — «уборка» биологического мусора? // Наука из первых рук. 19.04.2021.
Эта статья входит в число добротных статей русскоязычного раздела Википедии. |