Антитела из тяжёлых цепей
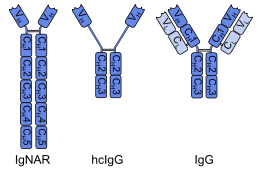
Антитела́ из тяжёлых цепе́й (англ. Heavy-chain antibody) — класс антител, у которых имеются лишь две тяжёлые цепи и отсутствуют две лёгкие. Они связывают антигены вариабельными доменами, расположенными на тяжёлых цепях (VH), в отличие от обычных антител, у которых во взаимодействии с антигеном также принимают участие вариабельные домены лёгких цепей (VL). В природе антитела из тяжёлых цепей имеются только у хрящевых рыб и верблюдовых, но на их основе разрабатываются искусственные терапевтические фрагменты антител — так называемые однодоменные антитела (англ. Single-domain antibody)[1].
История изучения[править | править код]
В 1989 году группа учёных, возглавляемая Раймондом Хэймерсом из Брюссельского свободного университета, изучала иммунную систему одногорбых верблюдов. Кроме обычных антител, состоящих из четырёх цепей, они нашли антитела, состоящие только из двух тяжёлых цепей. Сообщение об этом открытии было опубликовано в журнале Nature в 1993 году[2]. В 1995 году группа исследователей из Университета Майами нашла другие антитела, состоящие только из двух тяжёлых цепей, у акул[3].
У хрящевых рыб[править | править код]
Антитело из тяжёлых цепей у хрящевых рыб называется иммуноглобулином с новым антигеновым рецептором (англ. immunoglobulin new antigen receptor (IgNAR)). IgNAR имеют пять константных доменов на цепь вместо обычных трёх, несколько дисульфидных связей в необычных позициях, а регион определения комплементации 3 (англ. complementarity determining region 3 (CDR3)) формирует вытянутую петлю, которая закрывает участок, который у обычных антител связывается с лёгкой цепью. Эти отличия, вкупе с филогенетическим возрастом хрящевых рыб, дали основу гипотезе, согласно которой IgNAR более близки к первичным антиген-связывающим белкам, чем иммуноглобулины млекопитающих[4]. Акулы и, вероятно, другие хрящевые рыбы имеют и антитела из четырёх цепей: иммуноглобулины M и иммуноглобулины W[5].
У верблюдов[править | править код]
Единственные млекопитающие, у которых есть антитела из тяжёлых цепей, — это представители семейства верблюдовых: верблюды, ламы и викуньи[6]. У этих организмов антитела из тяжёлых цепей возникли в результате утраты одного из константных доменов (CH1) в тяжёлой цепи, а их вариабельный домен (VH) подвергся дополнительным модификациям. Два этих участка необходимы для связывания с лёгкими цепями[1][2]. Антитела из тяжёлых цепей верблюдов и родственных млекопитающих имеют общие черты с аналогичными антителами хрящевых рыб: они тоже имеют вытянутую петлю CDR3 и имеют схожую конформацию CDR1. Считается, что это сходство — результат конвергентной эволюции и появилось в связи с функциональными особенностями. Около 50 % антител верблюдов и близких видов составляют типичные для млекопитающих антитела из четырёх цепей. Существуют ли животные, обладающие только антителами из тяжёлых цепей, неизвестно[7].
Антитела из тяжёлых цепей верблюдов и родственных животных по специфичности не уступают обычным четырёхцепочечным антителам, к ним применимы стандартные методы выделения и наработки ex vivo в больших концентрациях. Благодаря меньшим размерам эти антитела хорошо подходят для бактериальной трансформации, что делает их удобными исследовательскими инструментами[8]. В настоящее время в исследовательских целях получают антитела из тяжёлых цепей, называемые нанотелами (англ. nanobodies), обладающие различными биохимическими свойствами[9]. Например, верблюжьи нанотела используют для оценки количества молекул фактора свёртывания крови VIII в плазме крови человека[10], кроме того, было предложено использовать их для детекции тау-белка в нейронах, что может иметь значение для диагностики и лечения болезни Альцгеймера[11].
Однодоменные антитела (нанотельца)[править | править код]
Альтернативой, природным однодоменным антителам из тяжёлых цепей являются однодоменные антитела искусственно полученные из обычных антител мыши[12], кролика[13] или человека[14]. Опыты с видами верблюдовых и акул труднодоступны поскольку их содержание и иммунизация требуют особых условий. Поэтому удобнее работать с трансгенными грызунами, которые продуцируют функциональные антитела тяжелой цепи верблюдовых или гибридные антитела тяжелой цепи ламы-человека. К примеру, трансгенных мышей, несущих VH альпаки, одногорбого верблюда и двугорбого верблюда, использовали для выделения сильнодействующих нейтрализующих VH, которые распознают эпитопы, недоступные для обычных антител[15]. Трансгенных мышей которые генерируют вариабельные домены тяжелой цепи антител человека с высокой аффинностью, высокой растворимостью и устойчивостью к агрегации можно будет использовать для производства различных терапевтических средств[16].
Примечания[править | править код]
- ↑ 1 2 Harmsen M. M., De Haard H. J. Properties, production, and applications of camelid single-domain antibody fragments. (англ.) // Applied Microbiology And Biotechnology. — 2007. — November (vol. 77, no. 1). — P. 13—22. — doi:10.1007/s00253-007-1142-2. — PMID 17704915.
- ↑ 1 2 Hamers-Casterman C., Atarhouch T., Muyldermans S., Robinson G., Hamers C., Songa E. B., Bendahman N., Hamers R. Naturally occurring antibodies devoid of light chains. (англ.) // Nature. — 1993. — 3 June (vol. 363, no. 6428). — P. 446—448. — doi:10.1038/363446a0. — PMID 8502296.
- ↑ Greenberg A. S., Avila D., Hughes M., Hughes A., McKinney E. C., Flajnik M. F. A new antigen receptor gene family that undergoes rearrangement and extensive somatic diversification in sharks. (англ.) // Nature. — 1995. — 9 March (vol. 374, no. 6518). — P. 168—173. — doi:10.1038/374168a0. — PMID 7877689.
- ↑ Stanfield R. L., Dooley H., Flajnik M. F., Wilson I. A. Crystal structure of a shark single-domain antibody V region in complex with lysozyme. (англ.) // Science (New York, N.Y.). — 2004. — 17 September (vol. 305, no. 5691). — P. 1770—1773. — doi:10.1126/science.1101148. — PMID 15319492.
- ↑ Flajnik, M. F.; Dooley, H. The Generation and Selection of Single-Domain, V Region Libraries from Nurse Sharks (англ.). — 2009. — Vol. 562. — P. 71—82. — (Methods in Molecular Biology). — ISBN 978-1-60327-301-5. — doi:10.1007/978-1-60327-302-2_6.
- ↑ Conrath K. E., Wernery U., Muyldermans S., Nguyen V. K. Emergence and evolution of functional heavy-chain antibodies in Camelidae. (англ.) // Developmental And Comparative Immunology. — 2003. — February (vol. 27, no. 2). — P. 87—103. — PMID 12543123.
- ↑ Nanobodies. Nanobody.org. Дата обращения: 29 мая 2022. Архивировано 16 февраля 2021 года.
- ↑ Ghannam A., Kumari S., Muyldermans S., Abbady A. Q. Camelid nanobodies with high affinity for broad bean mottle virus: a possible promising tool to immunomodulate plant resistance against viruses. (англ.) // Plant Molecular Biology. — 2015. — March (vol. 87, no. 4-5). — P. 355—369. — doi:10.1007/s11103-015-0282-5. — PMID 25648551.
- ↑ Vincke C., Muyldermans S. Introduction to heavy chain antibodies and derived Nanobodies. (англ.) // Methods In Molecular Biology (Clifton, N.J.). — 2012. — Vol. 911. — P. 15—26. — doi:10.1007/978-1-61779-968-6_2. — PMID 22886243.
- ↑ El Amrani M., Donners AAM, Graat G., Lentjes E. G., Huisman A., Musson REA, van Maarseveen E. M. Quantification of coagulation factor VIII in human plasma with liquid chromatography tandem mass spectrometry using a selective sample purification with camelid nanobodies. (англ.) // Journal Of Pharmaceutical And Biomedical Analysis. — 2019. — 25 October (vol. 175). — P. 112781—112781. — doi:10.1016/j.jpba.2019.112781. — PMID 31398627.
- ↑ Dupré E., Danis C., Arrial A., Hanoulle X., Homa M., Cantrelle F. X., Merzougui H., Colin M., Rain J. C., Buée L., Landrieu I. Single Domain Antibody Fragments as New Tools for the Detection of Neuronal Tau Protein in Cells and in Mice Studies. (англ.) // ACS Chemical Neuroscience. — 2019. — 19 August. — doi:10.1021/acschemneuro.9b00217. — PMID 31380615.
- ↑ Pang, Q., Chen, Y., Mukhtar, H., Xiong, J., Wang, X., Xu, T., ... & Wang, J. (2022). Camelization of a murine single-domain antibody against aflatoxin B1 and its antigen-binding analysis. Mycotoxin research, 38(1), 51-60. PMID 35023020 PMC 8754551 doi:10.1007/s12550-021-00433-z
- ↑ Feng R, Wang R, Hong J, Dower CM, Croix BS, Ho M (January 2020). "Isolation of rabbit single domain antibodies to B7-H3 via protein immunization and phage display". Antibody Therapeutics. 3 (1): 10—17. doi:10.1093/abt/tbaa002. PMC 7052794. PMID 32166218.
- ↑ Holt LJ, Herring C, Jespers LS, Woolven BP, Tomlinson IM (November 2003). "Domain antibodies: proteins for therapy". Trends in Biotechnology. 21 (11): 484—90. doi:10.1016/j.tibtech.2003.08.007. PMID 14573361.
- ↑ Xu, J., Xu, K., Jung, S., Conte, A., Lieberman, J., Muecksch, F., ... & Casellas, R. (2021). Nanobodies from camelid mice and llamas neutralize SARS-CoV-2 variants. Nature, 595(7866), 278-282. PMID 34098567 PMC 8260353 doi:10.1038/s41586-021-03676-z
- ↑ Bélanger, K., & Tanha, J. (2021). High-efficacy, high-manufacturability human VH domain antibody therapeutics from transgenic sources. Protein Engineering, Design and Selection, 34:gzab012. PMID 33991089 doi:10.1093/protein/gzab012
Литература[править | править код]
- Jovčevska, I., & Muyldermans, S. (2020). The therapeutic potential of nanobodies. BioDrugs, 34(1), 11-26. PMID 31686399 PMC 6985073 doi:10.1007/s40259-019-00392-z
- Shen Zhuolun, Sang Zhe, Shi Yi (2922). Nanobodies as a powerful platform for biomedicine. Trends in Molecular Medicine doi:10.1016/j.molmed.2022.08.007
Эта статья входит в число добротных статей русскоязычного раздела Википедии. |