Википедия:К переименованию/7 февраля 2014
UPD: туда же Дисульфид(2-) никеля(II) и Дисульфид(2-) кобальта(II) [*]
Или даже в дисульфид железа. Собственно, я её уже переименовывал когда-то, но Tretyak откатил со ссылкой на правила ИЮПАК. ИЮПАКовский пуризм, конечно, требует указания заряда в скобках, но в рекомендациях ясно указано, что в очевидных случаях это не критично (первая ссылка в статье), да и здравый смысл подсказывает, что лучше без лишних скобок. Более того, других дисульфидов у железа тоже нет, так что можно и валентность железа не указывать. starless 20:19, 7 февраля 2014 (UTC)
- Я не нашёл в рекомендациях «что в очевидных случаях это не критично», но в разделе «IR-5.3.3.3 Homopolyatomic anions» говорится, что «в нескольких случаях можно использовать несистематические названия» и приведены эти случаи — дисульфида(2-) там нет. И понятно почему. Название «Дисульфид(2-) железа(II)» исключает неопределённость в строении соединения. Дисульфид железа можно истолковать как сульфид четырёхвалентного железа. Хоть химия четырёхвалентного железа это большая экзотика, но она существует. Дисульфид железа(II) можно представить как Fe=S=S. Соединения четырёхвалентной серы известны. И только официальное ИЮПАКовское полное название «Дисульфид(2-) железа(II)» лишено к.-либо неоднозначности. --Tretyak 20:57, 7 февраля 2014 (UTC)
- Ссылка на конкретный раздел 5.4.2.3 приведена в статье (почему вы пытаетесь воспользоваться другим разделом, неясно). Специально для вас приведу цитату: "In other cases, based on chemical knowledge, (выделение моё) there is no chance of misinterpretation in practice, and the simple stoichiometric name will most often be used, as in Examples 11 and 12 below." В примерах там Пероксид бария и диоксид марганца, для которых рекомендуются именно такие названия. Если вы можете представить дисульфид железа(II) как
[Fe]=S=S, то где статья об этом соединении? Если нет её, то незачем давать излишние уточнения. Сульфид же четырёхвалентного железа не может быть корректно назван дисульфидом, а может только сульфидом железа(IV). Такие дела. starless 21:14, 7 февраля 2014 (UTC)
- Ссылка на конкретный раздел 5.4.2.3 приведена в статье (почему вы пытаетесь воспользоваться другим разделом, неясно). Специально для вас приведу цитату: "In other cases, based on chemical knowledge, (выделение моё) there is no chance of misinterpretation in practice, and the simple stoichiometric name will most often be used, as in Examples 11 and 12 below." В примерах там Пероксид бария и диоксид марганца, для которых рекомендуются именно такие названия. Если вы можете представить дисульфид железа(II) как
Сульфид же [гипотетического] IV-ковалентного железа может быть корректно назван дисульфидом (!), а в равной степени и сульфидом железа(IV). См. Дисульфид углерода/Сульфид углерода(IV), Дисульфид олова/Сульфид олова(IV)… см. также ниже цитатку из IUPAC: Диоксид марганца/Оксид марганца(IV)… --De Riban5 13:03, 12 апреля 2014 (UTC)
- Из вашей цитаты: «there is no chance of misinterpretation in practice» — не может быть неправильно интерпретировано на практике. Я показал, что ваши варианты названия могут быть неправильно интерпретированы. Именно поэтому официальное ИЮПАКовское название предпочтительнее. --Tretyak 21:32, 7 февраля 2014 (UTC)
- Нет-нет, в ИЮПАК разумные люди сидят. Общие химические знания подсказывают нам, что на практике название "дисульфид железа(II)" однозначно не может быть неправильно интепретировано. Нарисовать можно много соединений разных, бумага даже техасский углерод терпит, но пока они должным образом не изучены, уточнения, тем более такие безумные, не нужны. starless 21:44, 7 февраля 2014 (UTC)
- Странный диалог: я показываю как можно неправильно интерпретировать ваши варианты названия, а вы голословно утверждаете «не может быть»; название рекомендовано ИЮПАК, а вы называете его «уточнения, тем более такие безумные, не нужны». Я согласен, что в ИЮПАКе не все гиганты мысли, но называть их рекомендации «безумными» — это слишком. --Tretyak 10:23, 8 февраля 2014 (UTC)
- Рекомендации ИЮПАК по поводу этих уточнений приведены. Моё предложение находится полностью в рамках этих рекомендаций и приводит к созданию более удобочитаемого названия статьи. Уточнения излишни, поскольку ваши альтернативы выдуманы из головы, не основываются на каких-либо реальных источниках и заведомо неправильны, вследствие чего на практике человек, обладающий минимальными знаниями химии, не будет рассматривать их в качестве сколько-нибудь адекватных вариантов. starless 11:14, 8 февраля 2014 (UTC)
- Определите, пожалуйста, на какой минимальный уровень знаний рассчитаны ваши варианты названий. Да, мои альтернативы выдуманы из головы. Я вообще всё выдумываю из головы, а вы из чего? --Tretyak 21:05, 8 февраля 2014 (UTC)
- Не надо выдумывать, надо следовать рекомендациям регулирующего органа. Если орган говорит, что можно, значит, не только можно, но и нужно. starless 21:26, 8 февраля 2014 (UTC)
- Вы неправильно интерпретируете рекомендации ИЮПАК. --Tretyak 21:49, 8 февраля 2014 (UTC)
- Вам привели рекомендации, относящиеся к конкретному случаю. Я их интерпретирую в духе правил проекта. starless 09:23, 9 февраля 2014 (UTC)
- Дайте более точную ссылку на «дух» правил проекта. --Tretyak 20:32, 9 февраля 2014 (UTC)
- ВП:НЕБЮРОКРАТИЯ starless 21:29, 9 февраля 2014 (UTC)
- Ага, по-русски это называется «нет ссылок». --Tretyak 16:31, 10 февраля 2014 (UTC)
- ВП:НЕБЮРОКРАТИЯ starless 21:29, 9 февраля 2014 (UTC)
- Дайте более точную ссылку на «дух» правил проекта. --Tretyak 20:32, 9 февраля 2014 (UTC)
- Вам привели рекомендации, относящиеся к конкретному случаю. Я их интерпретирую в духе правил проекта. starless 09:23, 9 февраля 2014 (UTC)
- Вы неправильно интерпретируете рекомендации ИЮПАК. --Tretyak 21:49, 8 февраля 2014 (UTC)
- Не надо выдумывать, надо следовать рекомендациям регулирующего органа. Если орган говорит, что можно, значит, не только можно, но и нужно. starless 21:26, 8 февраля 2014 (UTC)
- Определите, пожалуйста, на какой минимальный уровень знаний рассчитаны ваши варианты названий. Да, мои альтернативы выдуманы из головы. Я вообще всё выдумываю из головы, а вы из чего? --Tretyak 21:05, 8 февраля 2014 (UTC)
- Рекомендации ИЮПАК по поводу этих уточнений приведены. Моё предложение находится полностью в рамках этих рекомендаций и приводит к созданию более удобочитаемого названия статьи. Уточнения излишни, поскольку ваши альтернативы выдуманы из головы, не основываются на каких-либо реальных источниках и заведомо неправильны, вследствие чего на практике человек, обладающий минимальными знаниями химии, не будет рассматривать их в качестве сколько-нибудь адекватных вариантов. starless 11:14, 8 февраля 2014 (UTC)
- Странный диалог: я показываю как можно неправильно интерпретировать ваши варианты названия, а вы голословно утверждаете «не может быть»; название рекомендовано ИЮПАК, а вы называете его «уточнения, тем более такие безумные, не нужны». Я согласен, что в ИЮПАКе не все гиганты мысли, но называть их рекомендации «безумными» — это слишком. --Tretyak 10:23, 8 февраля 2014 (UTC)
- Нет-нет, в ИЮПАК разумные люди сидят. Общие химические знания подсказывают нам, что на практике название "дисульфид железа(II)" однозначно не может быть неправильно интепретировано. Нарисовать можно много соединений разных, бумага даже техасский углерод терпит, но пока они должным образом не изучены, уточнения, тем более такие безумные, не нужны. starless 21:44, 7 февраля 2014 (UTC)
- Из вашей цитаты: «there is no chance of misinterpretation in practice» — не может быть неправильно интерпретировано на практике. Я показал, что ваши варианты названия могут быть неправильно интерпретированы. Именно поэтому официальное ИЮПАКовское название предпочтительнее. --Tretyak 21:32, 7 февраля 2014 (UTC)
- Если я правильно понял, то (2-) служит для уточнения структуры, а не состава. Если это так, то такое уточнение действительно излишне, потому что структуру как раз можно описать в статье, а не тащить в название. — Maksim Fomich 10:37, 9 февраля 2014 (UTC)
- Более того, там же нет дисульфид-иона, как в дисульфидах щелочных металлов (Na2S2, K2S2), насколько я помню. starless 12:10, 9 февраля 2014 (UTC)
- А куда ж они денутся дисульфид-ионы? Есть они милые, есть. А память — дырявая. --Tretyak 20:32, 9 февраля 2014 (UTC)
- Вы мне лучше расскажите, откуда они там возьмутся, если это не ионное соединение. А ещё лучше расскажите это не мне, а путём размещения в статье нормальной визуализации кристаллической структуры. starless 21:07, 9 февраля 2014 (UTC)
- Интересующиеся могут попробовать поискать дисульфид-ионы в структуре пирита или марказита, хехе. starless 23:03, 9 февраля 2014 (UTC)
- А меня всегда интересовало — для кого рисуют полное содержимое элементарной ячейки. Теперь знаю. Навскидку нашел картинки [1] и [2]. --Tretyak 16:31, 10 февраля 2014 (UTC)
- Вам привели реальные кристаллографические данные из платинового источника, а вы тычете в не пойми какие картинки, нарисованные на коленке. Если вы не умеете пользоваться JMol, то так и скажите, я объясню, куда нажать, чтобы было видно полное содержимое не только элементарной ячейки, но и соседних с ней. starless 17:54, 10 февраля 2014 (UTC)
- А, т.е. вы сами умеете рисовать полное содержимое ячейки. И какие тогда проблемы? --Tretyak 18:22, 10 февраля 2014 (UTC)
- В том-то и дело, что никаких: совершенно очевидно, что никаких дисульфид-ионов там нет. Может быть, потому, что вы не умеете рисовать содержимое ячейки и полагаетесь на детские рисунки? Химия ушла далеко вперёд от вас. starless 18:52, 10 февраля 2014 (UTC)
- Ну давайте вместе посмотрим:
- В том-то и дело, что никаких: совершенно очевидно, что никаких дисульфид-ионов там нет. Может быть, потому, что вы не умеете рисовать содержимое ячейки и полагаетесь на детские рисунки? Химия ушла далеко вперёд от вас. starless 18:52, 10 февраля 2014 (UTC)
- А, т.е. вы сами умеете рисовать полное содержимое ячейки. И какие тогда проблемы? --Tretyak 18:22, 10 февраля 2014 (UTC)
- Вам привели реальные кристаллографические данные из платинового источника, а вы тычете в не пойми какие картинки, нарисованные на коленке. Если вы не умеете пользоваться JMol, то так и скажите, я объясню, куда нажать, чтобы было видно полное содержимое не только элементарной ячейки, но и соседних с ней. starless 17:54, 10 февраля 2014 (UTC)
- А меня всегда интересовало — для кого рисуют полное содержимое элементарной ячейки. Теперь знаю. Навскидку нашел картинки [1] и [2]. --Tretyak 16:31, 10 февраля 2014 (UTC)
- А куда ж они денутся дисульфид-ионы? Есть они милые, есть. А память — дырявая. --Tretyak 20:32, 9 февраля 2014 (UTC)
- Более того, там же нет дисульфид-иона, как в дисульфидах щелочных металлов (Na2S2, K2S2), насколько я помню. starless 12:10, 9 февраля 2014 (UTC)
-
Пирит
-
Марказит
- «имеющий глаза да увидит». Да, а с верхним образованием у нас проблемы. Не только плохо учат, но и с воспитанием большие проблемы. --Tretyak 22:56, 10 февраля 2014 (UTC)
<!-- Давайте стараться меньше переходить на личности, ведущие к повышению накала полемики. Желательно - аргументы по сути! если критика, то правомерная - по существу! --De Riban5 11:45, 13 февраля 2014 (UTC) -->
- Вы меня умиляете. Нарисовать отдельные связи и объявить это дисульфидом -- прямо скажем, это злонамеренная мистификация. Во-первых, там расстояния S—S значительно больше, чем в дисульфиде водорода, во-вторых, они почти равны по длине расстояниям Fe—S, следовательно, ни о каком дисульфид-ионе говорить нельзя. В-третьих, не забывайте, что приоритетом для названия статьи является не слепое следование формализму ИЮПАК (который, напомню, рекомендует пользоваться более простым названием в случаях, когда невозможно альтернативное толкование, что и было показано выше), а узнаваемость и источники. Источники, к счастью, написаны не вами, и там используется нормальное название, которое для каждого нормального человека является более узнаваемым. В связи с этим я не понимаю, о чём спор: вы пытаетесь протолкнуть свою маргинальную точку зрения на именование статьи, для которой есть общепринятое название. Это деструктивно. starless 07:40, 11 февраля 2014 (UTC)
- А какое расстояние S—S должно быть (минимальное), чтобы считать, что это два иона S—? А назвать рекомендацию ИЮПАК «маргинальной точкой зрения» — очень самоуверенно, ну очччень. --Tretyak 16:50, 11 февраля 2014 (UTC)
- …там расстояния S—S значительно больше, чем в дисульфиде водорода, <...> следовательно, ни о каком дисульфид[полисульфид?]-ионе говорить нельзя.
- (физические) радиусы атомов, а равно и ионные радиусы, водорода (H2S2) и железа (FeS2) немного различны, и в свете этого во всех (разных) персульфидах (полисульфидах) связи Metall—S (Kation—S) и/& S—S будут по-любому различаться.. (или же иногда/часто почти равны по длине Fe—S (Kation—S)).. т.е. это не критерий отнесения хим. соединения к сульфидам (& дисульфидам), либо же к полисульфидам-персульфидам... --De Riban5 09:26, 15 марта 2014 (UTC)
В зависимости от природы катиона[1] расстояния S—S меняются. Минимальная длина связи характерна для тех катионов (анионов[1]), которые обладают наименьшей способностью к ковалентному связыванию (то бишь - наибольшей способностью к ионному связыванию), например Cs+, Fr+ …и см. Обсуждение:Дисульфид кобальта(II). --De Riban5 10:49, 16 марта 2014 (UTC)- Такое возможно только в газовой фазе, а в кристалле вообще некорректно о ионах говорить. И маргинальная точка зрения -- это не номенклатура ИЮПАК, а попытка её бездумно использовать там, где есть общеупотребительные названия, особенно если эти названия рекомендованы ИЮПАК. Так, знаете ли, можно и до дигидрогена монооксида дойти. starless 17:16, 11 февраля 2014 (UTC)
- …а в кристалле вообще некорректно о ионах говорить -
Не все так просто и однозначно (правила, как известно, имеют исключения... если нет исключений, то эт не правила)
Структура и даже состав молекул могут изменяться при изменении агрегатного состояния вещества и внешних условий, гл. обр. температуры и давления. (ионы могут наличествовать и в газообразном состоянии, и в твёрдом (кристаллическом), и даже в жидком (расплавленном) - см. ниже в «расплавленных оксидах» [ионных]..) Например, в газообразном оксиде азота (V) [при н.у. представляющем собой газ] существует отдельные молекулы N2O5 (ионов нет[2]), тогда как в твёрдом состоянии в узлах кристалической решётки этого оксида находятся ионы NO2+ и NO3−, т.е. можно сказать, что твёрдый N2O5 — это соль (ионный кристалл) - нитрат нитрония .
В расплавленной соли NaCl (выше 801 ºC), наприм., сохраняются такие же ионы, как и в кристалле; однако когда соль переходит в газообразное состояние (1414 ºC), ионы Na+ и Cl+ объединяются в нейтральные молекулы NaCl. Связь в молекулах NaCl в парообразном хлориде натрия оказывается чрезвычайно полярной [ковалентной], и обобществляемая атомами электронная пара сильно смещена в сторону атома хлора, однако разделение (смещение) электронов в этом случае не такое полное, как у ионов Na+ и Cl+ (в ионном кристалле). --De Riban5 09:22, 21 марта 2014 (UTC)
- Если таки название останется старое название, то нужно быть пунктуальными до конца и заменить дефис в скобках на минус нужной длины. — Maksim Fomich 10:37, 9 февраля 2014 (UTC)
Если я правильно понял, то (2-) служит для уточнения структуры, а не состава. -
(по ИЮПАК) Стехиометрические отношения могут указываться греческими умножающими префиксами (моно- ди-, три-, ...; реже в очень сложных соединениях латинскими: бис-, трис-, тетракис- ...; см. также ниже триоксид дижелеза), и/или валентность катиона (электроположительного элемента) — римскими цифрами (I, II, III, ...). Использование арабских цифр практически не допускается (да и ещё со знаком степени окисления/зарядом иона „−“, „+“; арабские цифры - только в формулах (для ионов)!). Это парадокс! !?!
[Положительная степень окисления элемента (т.е. валентность катиона) указывается в скобках римской цифрой: FeCl3 — хлорид железа (III), FeCl2 — хлорид железа (II); отрицательная степень окисления электроотрицательного элемента (аниона) практически не указывается (арабскими цифрами) (ограничиваются всего лишь анионными окончаниями -ид (сульфид), -ит (сульфит), -ат (сульфат, хлорат-анион)...), т.е. никогда не пишут «хлорид (1-)» (хлорид (1-) железа (II)), несмотря на то что хлор (хлор-катион и хлор-анион) бывает в разных степенях окисления: −1, +1, +3, +5, +7…]
Одновременное применение греческих и римских стехиометрических умножающих показателей не практикуется (или очень редко - в сложных случаях); например: (1-е формульное название) гидроксид железа (II) или (2-е название) дигидроксид железа - в первом случае говорится о том, шо железо двухвалентно и присоединяет 2 гидроксид-аниона (указывать при этом «дигидроксид» нет надобности), во втором формульном названии приставка «ди-» говорит о двух гидроксидах и, опять же, о двувалентности железа (указание в этом случае (II) некорректно). Исходя из этого мы получаем структурную графическую формулу: Fe(OH)2 .
Дисульфид железа(II) - не есть правильно! --De Riban5 09:02, 13 февраля 2014 (UTC)
Дисульфид железа [т.е не Дисульфид(2-) железа(II)!] можно истолковать как сульфид четырёхвалентного железа [S=Fe=S (?!?)]. Хоть химия четырёхвалентного железа это большая экзотика, но она существует. Дисульфид железа (II) [то есть не Дисульфид(2-) железа(II)!!] можно представить как Fe=S=S (?!?). Соединения четырёхвалентной серы известны.
20:57, 7 февраля 2014 (UTC)
для сульфидов, точнее для Серы и Железа (в данном конкретном случае), данные вещи не-характерны...
статью можно было бы (??) назвать Дисульфид, если бы возможно было бы выделить соотв. ионы - одноатомные анионы.
S=Fe=S - формула соответствует (по типу) сероуглероду (сульфиду углерода) или оксиду углерода (Диоксид углерода)... но ни для серы, ни для железа (угол =связи ≈180°) таковых соединений в химии неизвестно (по энтой формуле)!
Соединения четырёхвалентной серы известны,.. но не для сульфидов! ..а для очень сильных окислителей - оксидов (озонидов), фторидов; в частности железо IV стабилизируется в оксоферрат (IV) анионе, типа [FeO3]2- (MgFeO3; типа C (IV) в H2CO3; Fe (IV) - по строению они изотипны соответствующим оксотитанатам (IV): CaTiO3, FeTiO3) и/или [FeO4]4- (Ba2FeO4) (если средняя (срединная) сера S4+, и железо двувалентно Fe2+, то крайняя сера должна была бы быть S6-; Сера со степенями окисления 4- и 6- не бывает, бывает токмо: -2, 0, +2, +4, +6; то бишь формулы Fe=S=S не есть в природе, — это-де надперсульфид?!?)
В данном конкретном случае мы имеем дело [не с сульфидами/дисульфидами, а] с классом хим.соединений - персульфиды, по типу пероксидов (но не оксидов, и не диоксидов!)
Хим. формула: Fe2+ [-S—S-]2- или Fe2+ [S2]2- — угол связи м.б. ≈180°
(по типу Пероксид магния и/или Пероксид водорода, где угол 101,5°...106°, т.е. ближе к 120°, или между 90° и 120°; но не 60°!, не треугольник; карбид кальция (ацетиленид, «перкарбид»; также как и N≡C—C≡N), цианамид кальция - т.е. линейное строение, не треугольное; хотя для нас мало играет роли длина и угол связи! ...[2D-] треугольная структура (≈ 60°) допускается только лишь для объяснения валентности (II), но не для истинного (≈ 60°) угла связи, который в линейно-цепочных (≈180°) и/или зигзазообразных (≈108°...120°, как, наприм., у серы S8) не имеет место быть характерным (структурные формулы отражают лишь последовательность соединения атомов друг с другом, а не взаимное расположение атомов [элементов] в пространстве (в кристалле))! иначе, в противном случае, мы рискуем увлечься кристаллохимией... В упрощенном виде формула может быть представлена т.о.: ½Fe—S—S—½Fe, если соединить половинки железа, получится трёхугольник как иногда изображается для CaC2 …и Hg2O (½O—Hg—Hg—½O));
эти соединения - пириты (персульфиды; [полисульфиды (Sn2−) - строго говоря, не совсем верно, т.к. может (?!?) включать дисульфиды [ (2)S2−], трисульфиды [ (3)S2−] (по путанице; хотя эти последние два - сульфиды) (см. ниже)]) - следует рассматривать как соли полисероводородных кислот; формула также может рассматриваться как -Fe-S—S-...-Fe-S—S-...-Fe-S—S-… — и_железо_ и сера двухвалентны (все три атома: железо и две серы - двовалентны), степень окисления [иона]железа 2+, степень окисления персульфид-иона 2− (или, вернее, заряд иона), а степень окисления серы в персульфид-ионе 1- (или даже дробная, т.к. молекула имеет вид линейно-цепоч(еч)ной структуры, гомоцепи)
Сера (I) всегда обнаруживается в виде димерного иона S22−, причём рентгеноструктурные и магнитные исследования (3D-кристаллов) показывают, что два атома неметалла S связаны друг с другом ковалентной связью (также как и два атома металла в Cl—Hg—Hg—Cl) (см. выше файлы фотоизображений). Т.о., сера имеет в S22− степень окисления −1 лишь в том формальном смысле, в каком кислород имеет степень окисления −1 в пероксиде водорода H—O—O—H (и/или ртуть +1 в Hg2Cl2) (следовательно, Сера II-(двух-)валентна и в этих соединениях (персульфидах), но одна единица валентности каждого атома серы затрачивается здесь на связь с другим атомом серы; эта связь [димерная полисульфидная] сохраняется и в растворах солей серы (I), которые содержат ионы серы ...во всех соединениях серы (I), атомы серы связаны между собой, образуя димерные двухвалентные группы —S2— или —S—S—). …окончательное заключение о строении вещества делают после сопоставления совокупной информации, полученной разными методами.
Структурную формулу пирита FeS2 см. в
Ахметов Н.С. Общая и неорганическая Химия: Учеб. — 2-е изд., перераб. и доп. — М.: Высш. шк., 1988. стр. 313
(структурные формулы, в т.ч. ваша пирита («имеющий глаза да увидит») - координационно-комплексные, каркасные, 3D-пространственные! - они не показывают природу химической ионной связи, а токмо координациооное число (координационную связь), т.е. 4, 6, 8...; хотя нас прежде всего интересуют линейные, плоскостные-2D — где реально видно химическая связь: сульфид (оксид) ли это, персульфид (пероксид), или надпероксид, либо же озонид)
Эту статью предлагается переименовать в Персульфид железа
Степень окисления элемента римской цифрой (II), т.е. Персульфид железа (II) указывать нет необходимости, поскольку Персульфида железа (III) неизвестно такого соединения (?) (есть пероксид водорода, т.е. пероксид водорода (I), но нет пероксида водорода (II) или пероксида водорода (III)).
если строго по ИЮПАК, то надо бы Железа персульфид (катион и в формуле, и в названии - на 1-м месте), хотя чаще использующееся [укоренившееся] в литературе Персульфид железа ([3] , см. также [4], также см. [Пирит#Формальные степени окисления для пирита, марказита и арсенопирита]), тривиальное (несистематическое, случайное) название - Пирит, или серный колчедан, железный колчедан. --De Riban5 11:34, 11 февраля 2014 (UTC)
- IR-5.4.2.3 Multiple monoatomic constituents vs. homopolyatomic constituents // Nomenclature of Inorganic Chemistry. IUPAC Recommendations 2005 / Eds. N. G. Connelly, T. Damhus. — RSC Publishing, 2005. — P. 80. — 366 p. — ISBN 0-85404-438-8. Кроме того, пирит и колчедан -- это не тривиальные названия, а названия минералов. starless 11:52, 11 февраля 2014 (UTC)
- И да, там нет ни дисульфид-ионов, ни персульфид-ионов, как вы их ни назовёте. starless 12:00, 11 февраля 2014 (UTC)
- Соглашусь, ионов может и не быть! Ионы могут быть [в некотором приближении] только в идеальной ионной молекуле, наприм., FrF...
Надеюсь, вы согласитесь также шо идеальных (100%) ионных и/или ковалентных соединений нет! Также как нет идеального газа, также как нет ничего и никого идеального в подлунном мире!
(Ежели ионов нет, тосоветую значение [арабскими цифрами] «2−» убрать из названия [статьи], да и по логике оно там лишнее)
В систематических названиях различие между соединениями ионного и ковалентного хар-ра обычно не отражается.[3] Однако, если нужно особо подчеркнуть ковалентный характер соединения, допускается назвать его одним словом, в котором название электроотрицательной части (анионной составляющей) через гласную «о» соединено с названием электроположительной части (речь о ковалентных соединений неметаллов), напр.: OF2 - фторокислород, HCl - хлороводород, NO оксоазот..
Персульфид (полисульфид) Железа - соединение амфотерного (амбивалентного) слабого металла (относительно слабого восстановителя) и слабого неметалла (относительно слабого окислителя), и больше похоже на соединение ковалентного (а не ионного) характера - полярного ковалентного, т.е. в некотором приближении ионного (по структуре несколько подобен BeF2 [BeCl2 & FeCl2] — ковалентно связанные молекулярные [«полимерные»] цепочки, удерживаемые вместе в кристалле ионными силами; один из немногих случаев, когда ковалентность и корд. число бериллия/железа/ в твёрдом BeCl2 совпадает и равны четырём – [FeCl4]2− ; …VI-ковалентный случай - [FeF6]4−)
([www.chemister.ru/Database/properties.php?dbid=1&id=462 Название вещества с „нормальным“ (не справочным?!? т.е. ненормальным?? с аномальным, квазинаучным (перекрученным)) порядком слов русского языка:
Дисульфид железа (II)] (там же см. стр. формулу; такую же треугольную структурную формулу пирита см.
А.Т. Пилипенко (гл. ред.), В.Я. Починок, И.П. Середа, Ф.Д. Шевченко. Справочник по элементарной химии. — К.: Наукова думка, 1985. — с. 213))
(... ныне в статье стоит в первом примечании ссылка на IUPAC, но там нет такого наименования!)
ИЮПАК:IR-5.3.3.3 Homopolyatomic anions
Examples:
O2− oxide(2−), or oxide
O22− dioxide(2−), peroxide (dioxidanediide)
S2− sulfide(2−), or sulfide
S22− disulfide(2−) < ? > (disulfanediide)
<...>
Na2S3 (Na—S—S—S—Na) — Трисульфид динатрия (указание на наличие много(поли)атомного [димерного] аниона), или Трисульфид(2−) натрия (с зарядом аниона, умножающая префикс [приставка] на катион не обязательна)
Salts which contain anions that are Sn2− chains, as well as those containing several S2− anions, are both referred to as ‘polysulfides’ but, as demonstrated, names may be given that provide a distinction between these cases.
<...>
BaO2 (Ba2+ O22−) [аналогичным образом Mg2+ [—O—O—]2−] — Диоксид(2−) бария (с указанием двухатомного [димерного] аниона), или Пероксид бария (с использованием приемлемого альтернативного имени аниона)
MnO2 (O=Mn=O) — Диоксид марганца (простое стехиометрическое название), или Марганца бис(оксид) (указывает на два оксид-иона (аниона), а не двухатомной [димерный] анион), или Оксид марганца(IV)
<...>
Note the difference from compositional names such as ‘hydrogen peroxide’ for H2O2 and ‘hydrogen sulfide’ for H2S (Chapter IR-5) in which (in English) there is a space between the electropositive and electronegative component(s) of the name.
Compositional names of the above type, containing the word ‘hydrogen’, were classified as ‘hydrogen nomenclature’ in the discussion of oxoacids in Section I-9.5 of Ref. 2, and such names were extensively exemplified. However, in order to avoid ambiguity, their general use is not encouraged here. Consider, for example, that the compositional names ‘hydrogen sulfide’ and ‘hydrogen sulfide(2−)’ can both be interpreted as H2S as well as HS−. The situation with H2S is completely analogous to that with Na2S which may be named sodium sulfide, disodium sulfide, sodium sulfide(2−) and disodium sulfide(2−), except that misinterpretation of the first and third names as denoting NaS− is improbable. In Ref. 2, the names ‘hydrogensulfide(1−)’ and ‘monohydrogensulfide’ for HS− were proposed to avoid ambiguity. (However, in some languages there is no space in compositional names so that very delicate distinctions are required anyway.)— IUPAC page 73-74, 79-80, 136
- Соглашусь, ионов может и не быть! Ионы могут быть [в некотором приближении] только в идеальной ионной молекуле, наприм., FrF...
Персульфид рассмотрен только как анион S22−, [S2]2−, [—S—S—]2− (без примеров)
В наим. `Пероксид бария` валентность катиона-металла (римскими цифрами) нигде не указывается!
Толкование Пероксида (vs оксиды), Сероводорода (& сульфиды), Гидросульфида рассмотрено... но нет подробного сравнительного рассмотрения Сульфидов (& дисульфиды IV-валентных элементов) и Полисульфидов (персульфидов II-валентных металлов)…
--De Riban5 12:05, 11 февраля 2014 (UTC)
- А FeS2 -- это и не молекула, а кристалл. Теперь по источникам. Химический энциклопедический словарь (1983 г.) даёт "дисульфид железа". starless 12:21, 11 февраля 2014 (UTC)
- …Я надеюсь, вы меня поняли... Речь ишла о том, что в первом приближении, по бо́лшему счёту мы ведём разговор именно о «идеальной» ионной бинарной молекуле, и не как о кристалле (координационном комплексе, в котором весьма затруднительно судить о понятия валентности, и степени окисления (заряде иона (атома) бинарного соединения - соли); …здесь мы имеем разговор о химическом соединении (молекуле или, если хотите, о моле[4]), ежели вас интересует [физический] кристалл (минерал/ руда), то вам может быть(?) → сюда… мне трудно понять -зачем вообще нужны координационно-комплексные структурные (3D) хим.формулы?)..
ионов нет, молекул - как бы тоже... а тогды с чем мы имеем дело?
Может это и кристалл, но какой (?), давайте определимся...
В зависимости от природы [элементарных] частиц, находящихся в узлах кристаллической решётки, и от того, какие силы взаимодействия между ними преобладают в данном кристалле, различают молекулярные, атомные (неметаллические), ионные и металлические кристалл. решётки (т.е. кристаллы). Во многих неорг. соединениях, например, FeS, ZnS, FeS2, связь между частицами, находящимися в узлах решетки, является частично ионной и частично ковалентной; решётки (и/или кристаллы) подобных соединений можно рассматривать как промежуточные между ионными и молекулярными (ковалентными).
(…и в молекулах, и в кристаллах ионная связь должна рассматриваться как предельный („идеальный“) случай частично ионной связи)
а какую валентность (степень окисления/заряд иона) железа даёт формульное название дисульфид железа? …IV ?!? --De Riban5 09:36, 12 февраля 2014 (UTC)
- …Я надеюсь, вы меня поняли... Речь ишла о том, что в первом приближении, по бо́лшему счёту мы ведём разговор именно о «идеальной» ионной бинарной молекуле, и не как о кристалле (координационном комплексе, в котором весьма затруднительно судить о понятия валентности, и степени окисления (заряде иона (атома) бинарного соединения - соли); …здесь мы имеем разговор о химическом соединении (молекуле или, если хотите, о моле[4]), ежели вас интересует [физический] кристалл (минерал/ руда), то вам может быть(?) → сюда… мне трудно понять -зачем вообще нужны координационно-комплексные структурные (3D) хим.формулы?)..
- А FeS2 -- это и не молекула, а кристалл. Теперь по источникам. Химический энциклопедический словарь (1983 г.) даёт "дисульфид железа". starless 12:21, 11 февраля 2014 (UTC)
Для того, чтобы понять суть и обозвать соединение необходимо написать его формулу, как ионного химического соединения (молекулы)! Вычислить логически валентности (степени окисления), глянуть к каким классам ионов (анионов) оне относятся - сульфидов (оксидов), персульфидов (пероксидов)... и плясать отсюдова. Насчёт источников, незнаю... может можно найти название формулы для Пероксид магния как „Диоксид магния“ (по типу «дисульфид железа») ...или для H2O2 как „Диоксид водорода“ (или шо-то типа вашей удачной шутки - «Дигидрогена диоксид»)! Подумайте над этим, господа. Эт же не оксид (не диоксид!), а именно пероксид!! содержит одинарные связи непосредственно между атомами кислорода —O—O—, в водн. р-ре диссоциирует на (или может диссоциировать, — точнее, наличествует в окисл.-восст. реакциях) дискретные пероксид-ионы (=оксид-ионов не имеет[2])! --De Riban5 09:51, 12 февраля 2014 (UTC)
Сульфид железа (II) - FeS,
Сульфид железа (III) - Fe2S3,
а также Сульфид железа (III) меди (I) - Cu5FeS4 (Cu3FeS3) (пёстрая медная руда, борнит) — сульфиды (персульфидами не являются).
NO2 - диоксид азота (оксид азота (IV), двуокись),
CO2 - диоксид углерода,
FeO - оксид железа (II) (закись),
Fe2O3 - оксид железа (III) (триоксид дижелеза, окись) — эти оксиды (диоксиды, триоксиды) пероксидами (перекисями) не являются
Пероксид магния - MgO2,
Пероксид натрия - Na2O2 — думаю, эти перекиси (пероксиды) не являются оксидами.
Персульфид аммония - (NH4)2S2,
Персульфид натрия - Na2S2 — не думаю, што эти персульфиды (полисульфиды) относятся к классу сульфидов. --De Riban5 09:34, 13 февраля 2014 (UTC)
Давайте вспомним определения (номенклатурные понятия), в т.ч. в свете рекомендаций ИЮПАК:
Научные названия строятся по определённым правилам, позволяющим перейти от них к формуле... и/или обратно. Для того чтобы химики разных стран понимали друг друга, номенклатура должна быть единой. Об этом в настоящее время заботятся комиссии ИЮПАК (т.о. не перекладывайте ихние заботы (проблемы) на себя). То бишь, давайте, наверно, меньше будем заниматься изобретением велосипеда — народно-оригинальным творчеством; велосипед придуман задолго до нас, и он называется - Персульфид железа.
Сульфидами называются соединения элементов с серой, в которых сера соединяется только с атомами др. элементов (одинарными или дв. связями, не важно), наприм., Na—S—Na (в органике соответствует тиоэфирам), Mg=S, S=C=S, P2S5 (исключение - галогениды и оксиды серы как катиона (электроположительного элемента)).
Соединения элементов с серой, в которых осуществляется связь между двумя атомами серы —S—S— (в органике соответствует полисульфидным мостикам - в вулканизированной каучуковой резине), называются персульфидами, наприм., (NH4)—S—S—(NH4), Na—S—S—Na, Персульфид железа [—Fe—]2+[—S—S—]2-, FeCuS2 (смешанный коорд. комплекс со смешанной атомной связью (металлической, ковалентной и ионной), комплекс персульфида железа и металлической (нуль-валентной) меди Cu•FeS2, Cu[FeS2][5])[6]; также как и пероксиды,
которые, относясь по составу (стехиометрической молекулярной (брутто; т.е. простейшей эмпирической) формуле) к классу оксидов, по (2D) строению и хим. свойствам относятся к классу солей-пероксидов,
они - персульфиды - являют собой (в строгом смысле) не сульфиды, а соли H2S2 и поэтому называются персульфидами.
Аналогично и другим изоэлектронным аналогам, - перекисноподобным (пероксоподобным) соединениям — Оксиды/Пероксиды (…пернитриды (гидразины, диамиды, диимиды), перйодиды (?) (полийодиды), пероксобораты (пербораты); а также пероксосульфаты (персульфаты, пиросульфаты, надсульфаты), в т.ч. персульфидодисульфат водорода (политионовая - тетратионовая к-та)):
Оксидами называются соединения элементов с кислородом, в которых кислород соединяется только с атомами др. элементов (одинарными или дв. связями, не важно), наприм., оксид серы(VI), Ca=O (исключение - фториды/галогениды кислорода как катиона (электроположительного элемента)).
Соединения элементов с кислородом, в которых осуществляется связь между двумя атомами кислорода —O—O— , называются пероксидами, наприм., пероксид натрия, MgO2; также как и персульфиды,
которые, относясь по составу (стехиометрической (брутто) формуле (наприм., K2S2)) к классу сульфидов, по строению (графической структурной 2D-формуле (к примеру, K—S—S—K)) и хим. свойствам относятся к классу солей-персульфидов,
они являют собой (в строгом смысле) не оксиды, а соли H2O2 и поэтому называются пероксидами.
Классическими исследованиями пероксидов и пероксокислот много занимался Л. В. Писаржевский. --De Riban5 11:09, 13 февраля 2014 (UTC)
Рекомендация (может и не прав?):
Не приемлемые, невероятные, сколь-либо нереальные, весьма сомнительные (народно-оригинальные (?), абстракционные) названия — Дисульфид(2-) железа(II), Дисульфид железа(II), и новопредложенное Дисульфид железа — предлагается переименовать в систематическое (реальное, конкретное)
Персульфид железа
--De Riban5 11:45, 13 февраля 2014 (UTC)
- Химическая энциклопедия тоже даёт "дисульфид железа" без лишних уточнений. starless 14:23, 17 февраля 2014 (UTC)
Химический энциклопедический словарь (1983 г.) и Химическая энциклопедия дают „Дисульфид железа“. Давайте подумаем, джентльмены! Можно ли по энтому названию перейти (нарисовать) 2D формулу? В принципе можно — FeS2. Но какая валентность у металла? ..у остальных, всех элементов? Об этом низзя понять ни исходя из формулы (этой), ни тем более из названия - Дисульфид железа. Надобно именно структурная графическая формула, с обозначением связей черточками: — , =, ≡.
Строго говоря, исходя из названия (Дисульфид железа) нарисовать формулу не представляется возможным.. Железо и сера двувалентны, и формула (валентнонасыщенная) — FeS. Куда впихнуть ещё одну серу, точнее сульфид-анион (?), ведь железо IV-валентным не бывает (в присутствии серы, - довольно слабый окислитель!). А мы помним, что по ИЮПАК мы должны иметь лёгкий переход от названия к формуле,... и наоборот.
И опять же зададимся теми же вопросами: название формулы для Пероксид магния как „Диоксид магния“ (?!?) (по типу «дисульфид железа») ...или для Пероксида водорода как „Диоксид водорода“ (?!?) ... либо же Пероксид бария как Диоксид бария (а валентность бария?). И пероксиды, и персульфиды - это ведь совершенно другой класс соединений, хим. св-ва у них совершенно различны (по сравнению с оксидами/сульфидами). С почтением --De Riban5 14:59, 17 февраля 2014 (UTC)
Кальций (также как и железо, также как и кобальт и никель, см. ниже) в CaC2 (а равно и в любых др. соединениях) IV-валентным не бывает, да и не может быть... поэтому степень окисления углерода в карбид-анионе −1 (а „валентность“ IV, т.к. между углеродами существует тройная (ацетиленовая) связь [валентность/порядок связи = 3; sp-гибридизация, 180º], + 4-я связь между углеродом и металлом-катионом)..
- Валентность железа в этом соединении, разумеется, 6. В кристалле эти октаэдры хорошо видны. starless 16:08, 17 февраля 2014 (UTC)
Нам кажется, что мы уходим в другое поле (с др. ягодами) - координационную и кристаллохимию (кристаллографию). 6 - это координационная связь (координационное число) (если валентность, то - присоединяет три серы?!?). В химических реакциях (окислит.-восстановит., например) на бумаге (в книгах) координационные комплексы (кристаллы, октаэдры, т.е. 3D-каркасы ...с коорд. связью) не рисуют. В уравнениях хим. реакций отображают обычные 2D-структурные (графические) формулы (хим. топология; в которых реально можно понять и валентность, и степень окисления). Ежели 6 - валентность, то почему в обоих формулах II, а не VI (?): Дисульфид(2-) железа(II) → Дисульфид железа(II)?!?
Если VI, то почему же Дисульфид (Дисульфид железа)
(В твёрдом состоянии) 3D-кристаллы (наприм., NaCl; Коорд. число 6, Валентность I, Степень окисления +1 (по Na)) в химических реакциях не участвуют — в водн. р-рах кристаллы р-ряются с образованием молекул – ионных и/или ковалентных (наприм., водн. р-р сахарозы — обычный чай, - молекулярный [ковалентный] раствор; ионов там точно ни одного нет!).
Координационные связи (6, 8…; простых веществ NaCl, FeS2, не сложных коорд. комплексов) в процессе хим. реакций участия не принимают, и для химии (и хим. номенклатуры) маловато имеют значения (а играют роль только в физ. химии и/или хим. физике; это скорее физ. свойства). Валентность и Степень окисления иногда (не всегда!) ещё можно отождествить и/или спутать; но давайте не путать Координационное число и Валентность (не следует также путать ковалентность и коорд. число; а равно ковалентность с валентностью).
…Состав и строение координационных соединений не укладывается в рамки обычной теории валентности.
Большинство элементов, по теории строения комплексных соединений А. Вернера, проявляют два типа «валентности»: а) главную валентность, и б) побочную валентность. В современной терминологии (а) соответствует степени окисления (которую с нек-рой натяжкой ещё можно отождествить с валентностью), и (б) – координационному числу.
Координационные числа для железа:
Fe0 (нуль-валентное металлическое[7] железо): 5 (Fe(CO)5, Fe(PF3)5)
Fe2+: 4, & 6 (FeO, FeS, [Fe(H2O)6]2+), гем (Fe в гемоглобине)
Fe3+: 4, и 6 (Fe(III) в Fe3O4 (а равно и в Fe3S4), [Fe(H2O)6]3+, [Fe(NH3)6]3+)
(для IV-валентного железа также хар-рно коорд. число 6)
--De Riban5 08:57, 18 февраля 2014 (UTC)
В кристаллах веществ стехиометрического сотава A-B координационные числа атомов (ионов) A & B (и катионов, и анионов) равны, т.е. отвечают соотношению 1:1 (в скобках соотношение коорд. чисел):
NaCl (6:6), FeS, FeO (6:6), CsCl (8:8), ZnS (4:4), PbS, FeS2 (у катиона Fe2+ коорд. ч. 6,
и у S22− аниона - тоже 6, т.е. 6:6[8]).
Структура кристалла FeS2 абсолютно не соответсвует (не похоже, не подобны, не изоморфны) [AB2 и] соотношению координационных чисел 2:1, как у CaF2 (8:4), TiO2 (6:3), SnS2, SiO2, PbS2, HfS2, TaS2, MoS2, IrS2, CS2 ..., - катионы всех соединений, за исключением первого Ca и Pb, IV-валентны (кальций в CaC2 & CaF2 и железо в FeS2, а равно и в FeS (Pb в PbS2), II-валентны).
Чтобы «вычислить» валентность (соотношение валентностей), необходимо определить координационные числа обоих ионов — и катионов, и анионов! Если говорить о II-валентных металлах (катионах), то соотношение коорд. чисел в оксидах и сульфидах у них будет 1:1 (соотношение валентностей II : II, ...); в пероксидах и персульфидах — также 1:1 (соотношение валентностей II : II...) (поскольку персульфид-анион [также как и пероксид-анион в перекисях] - единый димерный; см. выше- фотоизображения; …Валентность (стехиометрическую валентность) элементов соединений, например NaCl (I) & ZnS (II) [допустим, которую мы не знаем; ведь соотношение корд. чисел у них обоих 1:1], определяется по эквиваленту (эквивалентной массе)). --De Riban5 10:57, 26 марта 2014 (UTC)
…В отличие от ковалентных соединений координационное число в «чисто» ионных (или почти ионных) соединениях не зависит от специфики электронной структуры элементов, а определяется соотношением размеров ионов. Так, при соотношении ионных радиусов в пределах 0,41–0,73 имеет место октаэдрическая координация ионов (структура NaCl), при соотношении 0,73–1,37 — кубическая [объёмно-центрированная] координация (структура CsCl) и т.д. Наприм., при взаимодействии ионов Fe2+ (r(Fe2+) = 0,080) и S2− (r(S2−) = 0,182), соотношение значений радиусов которых равно 0,439, возникает октаэдрическая координация – простая кубическая кристаллическая решётка хлорида натрия (соотношение коорд. чисел = 6:6).
- ↑ 1 2 Полисульфид-радикал —[S—S]— (также как и в случае кислородного полиоксид-радикала —[O2]— ) в зависимости от присутствия катиона/аниона может быть и электроположительным и Сера будет здесь иметь степень окисления +1 и, т.о., выступать в качестве катиона. К примеру в галоген(ид)сульфанах S2Cl2; корректные (систематические) названия [по типу полиоксония] строятся след. обр.: Хлорид полисульфония, Хлорид полисульфида, Хлоридополисульфид (по типу ковалентного Фторидополиоксида) ((поли)сульфОний пишется через «о», а не через «а», т.е. Хлорсульфаны — не совсем верное наименование; хотя они [наверняка] строятся по аналогии - бораны, алканы (карбаны, этины - перкарбиды), силаны, азаны, оксиданы (H2O2), сульфаны (H2S2)…)
- ↑ 1 2 …присоединение последующих электронов [сверх присоединения одного (первого) электрона] к атомам O, S, N, C..., т.е. двух, трёх электронов и более к атому, согласно квантово-механическим (теор.) расчетам, невозможно. Поэтому образование одноатомных (простых) многозарядных анионов (O2−, S2−, N3−, C4−) оказывается энергетически невыгодным, - строго говоря, sensu stricto, (ионы) в свободном состоянии существовать не могут.. ни в твердом кристалле, ни в газе [присоединение второго электрона к атому любого неметалла требует затраты энергии; поскольку энергия присоединения двух электронов (сродство к электрону второго порядка) отрицательна] (& образованию многозарядных анионов мешает электростатическое отталкивание электрона и однозарядного аниона; поэтому такие устойчивые анионы, как O2−, N3−, C4−, обнаружить довольно-таки затруднительно).
(частицы O2− могут существовать в расплавленных оксидах [а также, вероятно, в жёстких условиях - в электрохим. реакциях], но в воде (водн. растворах) O2− превращается в 2OH− в результате реакции с молекулами воды;
...в оксиде магния [& оксидах щелочных металлов], наприм., преобладает ионный тип хим. связи. Доказано наличие в кристалл. решётке MgO ионов Mg2+ и O2−)
(…100%-ными ионами не будут, вероятно, также Fr+ F−.. но могут быть (почти в идеале) - Эка-Франций и F−, — как хим. соединение элементов с самой низкой и самой высокой электроотрицательностью) - ↑ Не существует и принципиального различия между этими двумя типами связи — они лишь являются предельными (крайними, «маргинальными») случаями непрерывного ряда связей с различной полярностью.
- ↑ формулы веществ также указывают (показывают) не только состав вещества [хим. соединения], но и его количество и массу. Каждая формула изображает или одну молекулу в-ва, или один моль вещества (один моль молекул), или массу в-ва, равную (или пропорциональную) его мольной массе. В нашем примере, FeS2 обозначает или одну молекулу персульфида железа, или один моль персульфида железа, или 119,96 единиц массы (обычно 119,96 г) персульфида железа.
- ↑ Валентности подтверждаются реакциями:
2CuFeS2 + 5O2 + 2SiO2 = 2Cu + 2FeSiO3 + 4SO2 (здесь медь (0) и железо (II) степень окисления не меняют), и
4CuFeS2 + 13O2 = 4CuO + 2Fe2O3 + 8SO2 (медь (0) окисляется до меди (II), железо (II) - до железа (III))
Некоторые авторы (источники) интерпретируют данное соединение как смесь сульфидов CuS•FeS (железо и медь — II-валентны); скорее это смесь персульфида Cu•FeS2 и [примеси] сульфидов CuS•FeS; хотя хим. реакции говорят в пользу именно соединения Персульфида и 0-валентной меди Cu•FeS2
попробуйте (для прикола) задать решение [своим коллегам/студентам] этих окислительно-восстановительных реакций без коэфициентов (!), т.е. чтобы проставить коэфициенты... ведь если не знаешь валентность меди будешь очень долго чесать затылок.. - ↑ …двойная связь (персульфидная) S= присутствует, к примеру, в - Сульфидотриоксосульфат (VI) натрия [тиосульфат Na2SO3S, Na2S2O3]
- ↑ металлические [не ковалентные, и не ионно-ковалентные] карбиды (перкарбиды) d-элементов [т.е. побочных] IV—VIII (IVб—VIIIб, т.е. Fe, Co, Ni в т.ч.) групп ПСХЭ (короткого варианта таблицы), наприм., углеродистая сталь и/или чугун — карбид железа Fe3C, Fe98C2, где и железо, и углерод 0-(нуль-)валентны; углерод имеет металлическую/металлоподобную (алмазную/графитную) кристаллическую структуру. …ковалентные каркасные (самые твёрдые, т.е. металлоподобные) кристаллы — алмаз (ковалентный), графит (внутри слоя связи ковалентно-металлические, а между слоями – межмолекулярные)
- ↑ У серы, точнее у димерного полисульфидного аниона, координационное число 6; в кристалле эти октаэдры достаточно отчётливо просматриваются… они смещены относительно ЖЕЛЕЗных (катионных) октаэдров на величину [длины] атомной (ионной) связи.
Общие подобия: Персульфиды, подобно пероксидам, проявляют восстановительные и окислительные свойства, а также диспропорционируют.
Важная отличительная черта: Персульфиды обладают как свойствами восстановителей, так и окислителей, что отличает их от сульфидов, для которых характерны только свойства восстановителей. ... сульфиды и персульфиды - эт разные классы химических соединений!!
Относительно источников. Мы не ратуем на количество, а уповаем токмо на качество содержимого:
- Ахметов Н.С. Общая и неорганическая Химия: Учеб. — 2-е изд., перераб. и доп. — М.: Высш. шк., 1988. — стр. 313-314, 368, 381, 409, 459, 463, 465, 469, а также 290-293, 351 (перфосфиды), 378 (пероксиды, пернитриды, перкарбиды),
- Оганесян Эдуард Тоникович. Неорганическая химия: Учебник для вузов по спец. «Фармация». — М.: Высш. шк., 1984. — стр. 193, 288-290, а также 313 (автор - профессор ПятФА; книжка есть во 2-м Московском мединституте им. Н.И. Пирогова (и 1-м), а также НФармУ и Витебском мед-университете, а равно и в др. мед. библиотеках)
дают название „Персульфид железа“.. иногда встречается в литературе названия Полисульфид железа - устаревшие, и не совсем верны, хотя и приемлемы (также как и Полисульфид, Полисероводородная кислота)... .
Персульфид железа ~ Ссылок сгенерировано около: 3,462
Iron persulfide (латинское (международное): Ferrosi persulfidum / Ferri persulfidum)
Персульфид железа
Персульфид железа Приблизительное количество результатов: 3 560 (0,24 сек.) (https://www.google.com.ua/ даёт 3 570 (0,12 сек.)) --De Riban5 09:42, 18 февраля 2014 (UTC)
- Учебник для вузов по специальности "фармация", изданный в 1984 году, не может быть АИ по неорганической номенклатуре. starless 19:17, 18 февраля 2014 (UTC)
- Почему эт не может? По каким критериям? Доводы, (контр)аргументы? (Может вы считаете химико-фармацевтическую (медико-химическую) специализацию весьма отдалённой от Химической?..) (мы не знаем ВУЗов, где на таком высоком уровне изучается Химия, и количественно и качественно: органика, неорганика, аналитика, физ.-коллоидная, биологическая химия (+ с курсом микробиологии), фармацевтическая и токсикологическая (судмедэкспертная) химии...)
А Ахметов Н.С.?? А немерянные гиперссылки в ИнтерНэте?
<!-- …Хорошо.. Допустим, мы не предоставили вам источников - ни книжек, ни интернет-ссылок (предположим). А написали всё с головы (с бухты-барахты). Што можно сказать по поводу вышеизложенного - доводов, аргументов, фактов? (может где-то мы сплошали, допустив погрешность?) -->
…Можно ли считать АИ Химический энциклопедический словарь (1983 г.) и Химическую энциклопедию, содержащими порой явно нереальные, весьма сомнительные (народно-оригинальные) номенклатурные названия (?),..
ВозМожно ли считать АИ Химический энциклопедический словарь (1983 г.)? Как бы да, в принципе можно. Может ли Химический энциклопедический словарь (1983 г.) и Химическая энциклопедия содержать явно ошибочные, абстрактные определения? Почему бы и нет... ведь его пишут люди, а они, также как и мы с вами, могут иногда ошибаться, вполне... (не ошибается только Иисус Христос).. --De Riban5 09:25, 19 февраля 2014 (UTC)
- Почему эт не может? По каким критериям? Доводы, (контр)аргументы? (Может вы считаете химико-фармацевтическую (медико-химическую) специализацию весьма отдалённой от Химической?..) (мы не знаем ВУЗов, где на таком высоком уровне изучается Химия, и количественно и качественно: органика, неорганика, аналитика, физ.-коллоидная, биологическая химия (+ с курсом микробиологии), фармацевтическая и токсикологическая (судмедэкспертная) химии...)
Диоксид углерода не относится к классу пероксидов (полиоксидов). Если бы относился, то как это отобразить в названии??? Очевидно с помощью приставки - пероксид (гипотетически - пероксид углерода).
Пероксид водорода (... MgO2, BaO2, (NH4)2O2; нужное дополнить, лишнее - можно убрать) не обзывают полиоксидом, ни тем более диоксидом (по типу Дисульфид железа), потому как, по ИЮПАК, — это именно пероксид.
Точно также Персульфид железа не надобно обзывать полисульфидом (хотя, если не строго, то и можно), ни тем более дисульфидом (Дисульфид железа), потому как, строго по ИЮПАК, — это именно персульфид – Персульфид железа! (Дисульфид H - тоже некорректное наименование! ..не совсем правильно; весьма желательно переименовать (перенаправление удалить)) (Дисульфид олова, Дисульфид гафния, Дисульфид тантала, Дисульфид молибдена, Дисульфид иридия, Дисульфид углерода - правильные названия, т.к. валентность катиона (электроположительной составляющей) IV (четыре)!)
Название «Дисульфид железа» не приемлемо, т.к. железо (в данном случае II-валентное) (или любой др. катион; см. ниже) химически присоединяет не два сульфид-аниона (=S или —S—) (2S2−),
а один (!) персульфид-ион (—S—S—) (S22−).
Мы бы рекомендовали переименовать, не только это (энту статью) в т.ч., в Персульфид железа, но и также все:
Дисульфид(2-) кобальта(II), Дисульфид(2-) никеля(II), Дисульфид(2-)калия (Полисульфиды калия), и Дисульфид(2-) меди(II) (Сульфиды меди),
и все содержащие в названиии «Дисульфид(2-)». С глубоким уважением --De Riban5 10:05, 19 февраля 2014 (UTC)
- А вот с этим полностью согласен. От кадавров надо избавляться. starless 18:06, 20 февраля 2014 (UTC)
…По поводу ИЮПАК [чтобы не быть чрезмерно педантичными и «выплеснуть вместе с водой и котёнка»]. Надо наверно помнить, что оне содержат рекомендации, и носят рекомендательно-консультативный характер. Строгих законодательных (упорядоченных, регламентных) наставлений там нет {вместо того чтобы переназвать все (абсолютно все) хим. соединения, там содержатся всего лишь рекомендации}. К тому же разные национальные научные школы сохраняют свою традиционную (укоренившуюся, въевшуюся) номенклатуру: наприм., химики говорят "возьмите 5 ml соды (Na2CO3)", но не говорят "5 ml карбоната натрия" и т.п. Успехов! …
…Можно в равной мере переименовать данное соединение, и в т.ч. Дисульфид(2-) кобальта(II), Дисульфид(2-) никеля(II), в Полисульфид:
Полисульфид железа (и, соотв., Полисульфид кобальта, Полисульфид никеля)
но, наверно, надо помнить и учитывать, что для некоторых соединений (и из разных источников-литературы) - это разные классы, например в случае с кислородом (пероксиды & полиоксиды): ионные пероксиды (т.е. соли или солеобразные соединения (Na2O2), но, строго говоря, ни в коем случае не класс оксидов) и ковалентные полиоксиды (с более электроотрицательным элементом чем сам кислород, т.е. кислород в данном случае с положительной (+) степенью окисления; ..и/или весьма близкой относительной электроотрицательностью) O2F2 (F—O—O—F; в данном примере используется название Фторид полиоксония, Фторид полиоксида, Фторидополиоксид (по типу Фторокислород - см. выше), т.к. кислород выступает как катион) ...некотрые источники включают в группу полиоксидов диоксиды, триоксиды (т.е. оксиды), то бишь в данном случае полиоксиды и пероксиды - суть разные есть; другие источники полиоксиды ассоциируют с пероксидами (также как и полисульфиды с персульфидами).
Полисульфиды E2Sn – как говорят в Одессе, понятие растяжимое;
n = 2 … 23, т.е. E2S2, E2S3, E2S4 …
Сопоставим эти факты, господа, — Дисульфид в названии неприемлемо, т.к. металл (Fe, Co либо Ni) в данном конкретном случае II-валентен (не IV !!) и присоединяет не 2 сульфид-иона (S= , с одинарной или двойной связью, не важно!), а 1 (один) персульфид-анион (—S—S—). С уважением --De Riban5 11:33, 28 февраля 2014 (UTC)
Кобальт и Никель…
Устойчивы и стабильны для этих металлов (также как и для железа) соединения со степенью окисления +2.
Максимальная степень окисления для кобальта и никеля +3. Лишь в ряде соединений кобальту (ещё реже никелю) можно формально приписать степени окисления +3 и +4 (для никеля, наприм., Cs2NiF6; т.е. только в присутствии кислорода/фтора, не серы!).
Относительная простота химии никеля (& кобальта) с точки зрения числа [ковалентных] состояний компенсируется значительным разнообразием комплексных соединений.
Т.е. примём как должное, IV-валентными эти металлы не бывают (за редкими исключениями; IV-валентными металлы эти как катионы быть не могут (!) в принципе, априори (!), а могут быть только как амфотерные комплексные (или/и даже координационные) анионы - в присутствии очень сильных окислителей), и присоединить 2 (два) сульфид-аниона физически (и химически) не в состоянии. А относятся эти соединения (все три) к классу персульфидов (полисульфидов).
IV-Валентные соединения Fe, Co, Ni весьма редки, и/или неустойчивы, и/или не изучены.
...Даже для Co3+-иона бинарные соединения и соли нехарактерны, но за-то известны многочисленные комплексы (чаще всего анионные). А, наприм., IV-валентные CoO2 & NiO2 (Оксид никеля;… если таковые вообще известны) обладают сильной склонностью к восстановлению в Co2+ и Ni2+, т.е. в стабильные (устойчивые) II-валентные CoO & NiO. О IV-валентных соединениях с серой — сульфидах, вернее дисульфидах, — вести разговор пожалуй вообще несеръёзно (ещё с фтором/кислородом — ладно... но с серой?!?)…
--De Riban5 10:20, 4 марта 2014 (UTC) Удачи! --De Riban5 09:25, 17 марта 2014 (UTC)
Предварительный итог
В обсуждении было показано, что (подробное) название «Дисульфид(2−) железа(II)» соответствует номенклатуре, но не была показана необходимость в уточнении «(2−)» в названии статьи. Неоднозначность лишь возможная в принципе, согласно обычаям Википедии, не является основанием для добавления в название статьи уточнений, не способствующих узнаваемости, а аргументы в пользу существования отдельного соединения Fe=S=S приведены не были. С другой стороны, предложенное сверхупрощённое название «Дисульфид железа» не соответствует существующей в русской ВП схеме наименования солей железа. Также, не было убедительно показано наличие в кристалле обсуждаемого соединения связи S–S, что было бы необходимо для применения названия «персульфид». Если возражений не поступит, тот статья будет переименована в Дисульфид железа(II) с сохранением перенаправления.
Также обращаю внимание участников дискуссии на то, что подробное обсуждение химического строения вещества было бы уместно в обсуждении статьи, а помещение изображения его кристаллической структуры — в статье, а не тут. Incnis Mrsi 09:46, 2 апреля 2014 (UTC)
- Коллега, добавьте, пожалуйста, про кобальт и никель. Они там в первой строчке указаны и вынесены сюда же. starless 10:28, 2 апреля 2014 (UTC)
- Да-да, ссылки с них сюда же указывают. Насколько я понял, ситуация аналогична: Дисульфид кобальта(II) согласно большинству в Категория: Соединения кобальта и Дисульфид никеля(II) согласно большинству в Категория: Соединения никеля. Вопрос о желательности указания степеней окисления в подобных соединениях прошу обсуждать отдельно (если есть желание): если менять существующий порядок, то придётся переименовывать много статей (по большинству металлов или отдельным металлам), а не только эти три по трём разным металлам. Incnis Mrsi 16:16, 2 апреля 2014 (UTC)
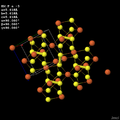
«Также, не было убедительно показано наличие в кристалле обсуждаемого соединения связи —S—S—, что было бы необходимо для применения названия „персульфид“» — в обсуждении на них не однажды обращалось внимание: [5] (жёлтые (yellow=sulfur) димерные анионы S22−),
-
Пирит
-
Марказит
Персульфид водорода H2S2 – аналог пероксида водорода [H2O2]. Персульфиды встречаются в природе. Например, широко распространённый минерал пирит FeS2 представляет собой персульфид железа (рис.).
— Ахметов Н.С. Общая и неорганическая Химия: Учеб. — 2-е изд., перераб. и доп. — М.: Высш. шк., 1988. — стр. 313-314
рис. почти полностью соответствует 5-й ссылке...
примерно то же описано и у Оганесяна:
.. --De Riban5 11:20, 4 апреля 2014 (UTC)Наибольшее значение имеют персульфиды щелочных и щелочно-земельных металлов, а также (NH4)2Sn и FeS2 – пирит.
— Оганесян Э. Т. Неорганическая химия: Учебник для вузов по спец. «Фармация». — М.: Высш. шк., 1984. — стр. 288-290
- Вы полагаете, что разместив ту же картинку по второму разу в обсуждении (и ни разу в статье) и запуская разговор по третьему кругу, и открыв ещё три обсуждения без ссылки на это, ещё не закрытое обсуждение, Вы делаете Википедию лучше? Любой может сравнить Поиск: Google · Google Books · Google Scholar. с Поиск: Google · Google Books · Google Scholar., Поиск: Google · Google Books · Google Scholar. с Поиск: Google · Google Books · Google Scholar. (как словосочетание вообще не находится), Поиск: Google · Google Books · Google Scholar. с Поиск: Google · Google Books · Google Scholar. (как словосочетание вообще не находится). Ссылки на академические работы, утверждающие что персульфидами эти соединения называть правильно, а дисульфидами — неправильно, приведены? Тоже нет, хотя дискуссия разбухла уже до размеров хорошей статьи. https://en.wikipedia.org/wiki/Special:WhatLinksHere/Pyrite?hidelinks=1 — есть слово «disulfide», но нет слова «persulfide», и такая страница как en:Iron persulfide тоже не создана. По-моему, разумному человеку всё уже должно быть ясно. Прошу невовлечённого участника подвести окончательный итог. Incnis Mrsi 07:02, 4 апреля 2014 (UTC)
- И не надо ни в коем случае совать эту картинку в статью, поскольку она имеет своей целью ввести в заблуждение (иногда это именуют POV-pushing). Все связи должны быть изображены как равнозначные. starless 09:13, 4 апреля 2014 (UTC)
- Вы полагаете, что разместив ту же картинку по второму разу в обсуждении… [каковую даже не мы предоставили - т.е. не по второму разу] - это к тому, што не желательно писать [не подумав?!?]: „Также, не было убедительно показано наличие в кристалле обсуждаемого соединения связи —[S—S]—, что было бы необходимо для применения названия «персульфид»“
Ваш Google-поиск не совсем понятно для чего приведён?!?... в интернете можно написать всё шо душе пожелаешь... (тем более что, по всей вероятности, там наименования взяты (импортированы) из RU-wiki) [...можно и не написать по определенным причинам: «как словосочетание вообще не находится»; т.е. Интернет - это не критерий] (см. также выше ссылки „Мы не ратуем на количество“ («немногочисленные»-неколичественные — подчеркнуто)).. Надеюсь, вы понимаете чем отличается количество от качества.. Все три атома металла - Fe, Co, Ni - чётырехвалентными не бывают (и не могут быть как катионы - Fe4+, Co4+, Ni4+), и называться, соответственно, Дисульфидами не могут по определению... Ti, Sn, Pb могут быть IV-валентны, и для них могут существовать Дисульфиды... Be, Mg, Ca, Ba, Fe, Co, Ni, Zn… IV-валентными ну просто не могет быть. Все хим. реакции в статьях Дисульфид(2-) железа(II) (en:Pyrite#Formal oxidation states for pyrite, marcasite, and arsenopyrite - упоминания persulfide вроде есть (или нет?)), Дисульфид(2-) кобальта(II) (…неорганическое соединение, соль металла кобальта и полисульфидной кислоты с формулой CoS2), Дисульфид(2-) никеля(II) (…соль металла никеля и полисульфидной кислоты с формулой NiS2), а равно и Персульфид
приведены как для II-валентного (ведь по своей [хим.] природе эти металлы IV-валентными быть не в состоянии)
именно поэтому само слово Дисульфид в названии не приемлемо!.. (водород II-валентным не бывает, и именно поэтому его H2O2 (а равно и H2S2) никто не обзывает диоксидом/дисульфидом/ S<HH>S (т.е. якобы циклический квадратный; ≈ по образцу «Дигидрогена монооксид» :) ), по типу S=Fe=S - но такой ведь формулы не-возможно нарисовать, зная химию Fe ...и H, который бывает токмо I-валентным). (вижу, шо увлёкся.. но разговаривать, когда тебя водят по нескольку раз по кругу - не совсем интересно) --De Riban5 11:39, 4 апреля 2014 (UTC)
«…поскольку она имеет своей целью ввести в заблуждение» — в чём заключается заблуждение [не моей картинки - файла изображения]?!? …POV-pushing - проталкивают свое мнение в той или иной мере каждый (любой) участник обсуждения... другое дело што это делают иногда агрессивно и упрямо (чаще без обсуждений), и это мнение может быть более-менее неправильным (необоснованным, не-аргументированным) и/или правильным (обоснованным, аргументированным). [совет: проталкивайте-обсуждайте свое мнение, аргументируя его, каким бы оно не было правильным/ошибочным/не очень правильным... за место/«разбухание» особо не заботьтесь - места на сервере всем хватит :) ]
„«К переименованию» — не голосование, а обсуждение. Неаргументированные «голоса» не учитываются!“- Предлагаю: статью переименовать в основное название Персульфид железа
некорректные, неприемлемые Дисульфид(2-) железа(II), Дисульфид железа(II) (а равно неприемлемое, не конкретное Дисульфид железа) сделать перенаправлениями (3-е — Дисульфид железа — создавать вообще нет надобности).. --De Riban5 12:37, 4 апреля 2014 (UTC) (с праздниками [одесского] смеха и ...Весны!) - Прошу участников, подводящих итоги, учесть тот неоспоримый очевидный факт, что участниками-оппонентами хоть и приведено строгое следование букве рекомендаций IUPAC, но это название (эти наименования – Дисульфид(2-) железа(II), Дисульфид(2-) кобальта(II) и Дисульфид(2-) никеля(II), а равно и Дисульфид железа(II), Дисульфид кобальта(II) & Дисульфид никеля(II) – как замысловатые и невероятные …распространённые заблуждения (?!?)) абсолютно [практически] нигде не используются в русскоязычной научной литературе (…ежели следовать данной логике, то можно переименовать/переназвать и все персульфиды-полисульфиды?!? …и тем более у нас не хим. энциклопедия [энцикл. словарь], где требуется строгая (скрупулёзная) педантичность).
Дисульфид железа (без арабских и римских цифр; и их соответствующие названия Co и Ni) – хоть и встречается (используется – в некоторых справочниках-литературе, как было показано Участником Starless), но интерпретировать его верно
мало представляется возможным. «Дисульфид» подразумевает [по логике] IV-валентность металла (катиона). Но сам по себе катион (металл) Fe, Co, Ni
IV-валентным не может быть по своей природе (из логики выходит его II-валентность!).
[Сопоставьте эти факты, господа! также как, напр., пероксиды щёлочноземельных (II-валентных) металлов никто никогда нигде не называет подобным [абстрактным] образом, —
лат. ad exemplum Диоксид(2-) магния(II), Диоксид магния(II), и/или Диоксид магния (поскольку, в последнем случае (2-м и 3-м), Диоксид говорит о четырёх-валентности элементов, но эти металлы IV-валентными не бывают!); корректное, конкретное наименование — Пероксид магния ... Google, Metabot… 1-е назв. Диоксид(2-) магния(II) - IUPAC`овское, т.е. допустимое и приемлемое. Проводя некоторые аналогии можно заметить, что практически нигде не утверждается о правильности первых двух-трёх наименований и «неправильности» последнего – пероксид… и/или наоборот. Просто принято так (!): распространённое (широкоупотребительное) название Пероксид… и в равной мере – Персульфид (Персульфид железа). ]
Вопрос: зачем импортировать (множить) ошибки--лат. lapsus из АИ [какими бы академическими они ни были, и какими бы не были эти ошибки широкоупотребительными (количество vs качество)]? --De Riban5 12:34, 8 апреля 2014 (UTC)
- Предлагаю: статью переименовать в основное название Персульфид железа
- Вы полагаете, что разместив ту же картинку по второму разу в обсуждении… [каковую даже не мы предоставили - т.е. не по второму разу] - это к тому, што не желательно писать [не подумав?!?]: „Также, не было убедительно показано наличие в кристалле обсуждаемого соединения связи —[S—S]—, что было бы необходимо для применения названия «персульфид»“
- И не надо ни в коем случае совать эту картинку в статью, поскольку она имеет своей целью ввести в заблуждение (иногда это именуют POV-pushing). Все связи должны быть изображены как равнозначные. starless 09:13, 4 апреля 2014 (UTC)
«Вопрос о желательности указания степеней окисления в подобных соединениях прошу обсуждать отдельно (если есть желание): если менять существующий порядок, то придётся переименовывать много статей (по большинству металлов или отдельным металлам), а не только эти три по трём разным металлам.» —
Менять порядок не желательно/не обязательно - надо помнить, что многие [строгие] ИЮПАК’овские наименования не распространены и мало используются… просто можно сделать ссылку-примечание на ИЮПАК (как ныне есть) на Дисульфид(2-) железа(II)
Если писать «Дисульфид», то только со степенью окисления (зарядом аниона) «2−»: «Дисульфид(2−)», — без него все [прочие подобные] названия теряют смысл.
Валентность (римскими цифрами) можно указать, т.к. теоретически (?) Персульфид (Полисульфид) может быть и для Fe (III) — Fe2(S2)3 (т.к. гипотетически существует Сульфид железа (III) — Fe2S3).
Валентность (в данном случае Степень окисления, римскими цифрами) в принципе можно не указывать, поскольку Пероксиды/Персульфиды для III/IV-ковалентных элементов не известны (исключение — Персульфид селена (II) [Сульсен] SeS2); известны только для I- и II-ковалентных.
Оба названия наверняка будут правильны — с указанием/без указания валентности металла (римскими цифрами)!
Из всех трёх наименований — Дисульфид(2-) железа(II), Дисульфид железа(II), Дисульфид железа (и соответствующие наим. Co & Ni) — как подметил уч. Tretyak, только Первое IUPAC’овское отвечает правильности (лат. litera scripta manet) и здравому смыслу (лат. in optima forma)…
Арабскими цифрами (2-) обозначается степень окисления не серы, а персульфид-иона S22− (димерного дисульфид-аниона); не следует путать её со степенью окисления серы, которая формально (результирующе) составляет -1. Римскими цифрами указывается валентность катиона-металла Fe, который может быть и III-валентным (но IV-валентным не бывает). Поскольку персульфидов железа с валентностью III и IV не известно, то особой необходимости указывать валентность II не обязательно (также как и в Пероксиде бария, см. выше)... Ди- (Дисульфид) с указанием степени окисления 2− — Дисульфид(2−) — подразумевает не два сульфид-аниона, а один [димерный] дисульфидный, точнее персульфидный анион.
Повторюсь… Второе название — Дисульфид железа(II) — немножко вводит в заблуждение. Дисульфид в этом случае говорит о IV-валентности металла, но для металла тут же указывается валентность II, — внутреннее противоречие-диссонанс.
Третье — Дисульфид железа — подразумевает IV-валентность металла, но эти металлы (Fe, Co, Ni) в присутствии S по логике & common sense не могут быть IV-валентными (2-е и 3-е наименования — это Нонсенс! (стоит ли удивляться, стоит ли ожидать версию очередного назв. Дисульфид → Сульфид железа (II) (а-ля Паганель?!?)).
Дисульфид(2-) железа(II), Дисульфид железа(II), Дисульфид железа и Персульфид железа
1-е и 4-е названия — не распространённое, но правильное (малораспространенное (1-е) – т.к. громоздкое и замысловатое)
2-е и 3-е — более-менее распространённое, но неправильное (иррациональное)… по этим названиям невозможно нарисовать и понять структуру хим. соединения. Именно из-за этого предложены эти варианты названий в Википедии и за её пределами. Без преувеличения можно сказать, именно из-за непонимания структуры (класса соединений – сульфиды (дисульфид IV-валентного металла) vs/или полисульфиды (персульфид II-валентного элемента)) обсуждение затянулось-«разбухло»…
Резюме-подитог — два варианта:
1-й — статью можно переименовать в Персульфид железа
2-й — статью вовсе не переименовывать (лат. dura lex, sed lex)
(мы бы рекомендовали все же переименовать в Персульфид железа, т.к. это наз. более удобное [более удобочитаемое] и узнаваемое)
В шапке статьи (в самом начале статьи) перечислить основные названия Персульфид железа и Дисульфид(2-) железа(II) (или в обратном порядке - в зависимости от варианта переименования/не переименования); в скобках можно добавить остальные Дисульфид железа(II), Дисульфид железа [с созданием перенаправлений] (этот последний, может не стоит перечислять и, соотв., делать ссылку?!?)
и обязательно указать пометой: «эти названия малораспространены и являются не совсем (досто)верными» или подобным образом... В любом случае, В статье (шапке статьи, в самом начале) необходимо указывать [перечислить] абсолютно все названия, синонимы.. Успехов и удачи!! --De Riban5 14:15, 11 апреля 2014 (UTC)
Итог
Как было уже сказано в предварительном итоге, в обсуждении не была показана достаточная необходимость в уточнении «(2−)» в названии статьи. Следует также учитывать узнаваемость и удобочитаемость названия, а существующее название «Дисульфид(2-) железа(II)» практически нигде не попадается, во всяком случае, перечитав не один десяток книг по неорганической химии, я такого названия нигде не встречал, зато повсеместно встречается «Дисульфид железа», в т. ч. в статье «Железа сульфиды» Химической энциклопедии 1990 г.. Также верно и то, что теоретически возможная неоднозначность не может служить основанием для добавления в название статьи уточнений, не способствующих узнаваемости. Название «Дисульфид железа(II)», кроме того, соответствует стандартам именования в Википедии соединений железа (см. Категория:Соли железа). Убедительных доказательств, что данное соединение следует назвать персульфидом, не приведено. Таким образом, предпочтительным является название Дисульфид железа(II), в которое статья и переименовывается с сохранением перенаправления. Тара-Амингу 10:18, 14 апреля 2014 (UTC)
По аналогичным соображениям переименованы Дисульфид(2-) никеля(II), Дисульфид(2-) кобальта(II). Тара-Амингу 11:09, 14 апреля 2014 (UTC)
Украинское левое политическое движение по русски переводится «БОРЬБА» -- Dgeise 19:02, 7 февраля 2014 (UTC)
- АИ не переводят. 1790 упоминаний Боротьбы в Новостях. --Ivandemidov 09:37, 8 февраля 2014 (UTC)
- Переводят на , пример Фронт перемен → украинское название Фронт Зимин -- Dgeise 16:49, 20 февраля 2014 (UTC)
- Обратите внимание, что, например, украинская партия, название которой на переводится не иначе «Отечество», написано в Википедии на языке оригинала с русскоязычным вариантом кириллицы. Но нигде эта партия в тех же российских СМИ так не называется, тоже самое и с «Боротьбой». Думаю, что можно просто создать страницу-перенаправление. --WowanRemesz 04:02, 22 марта 2014 (UTC)
- Переводят на , пример Фронт перемен → украинское название Фронт Зимин -- Dgeise 16:49, 20 февраля 2014 (UTC)
- Сохранение изначального написания имеет свой колорит и упрощает поиск в рунете. К и в случае с Батькивщиной оставить как есть. Название является чем-то вроде лексической эмблемы, «вывеской» организации, а не, скажем, обычным названием партии, типа «Демократическая партия Украины». — 193.169.36.21 10:08, 27 апреля 2014 (UTC)
Итог
Действительно, как и «Батькивщина», «Громада» и «Рух» в русскоязычных источниках в подавляющем большинстве передаётся как «Боротьба». GAndy 12:40, 5 мая 2014 (UTC)
„Более известен просто как Притхвирадж“ (как сказано в самом тексте статьи). В титрах большинства своих фильмов он упомянут именно по имени. Актеры южного кино Индии часто пользуются мононимами. --Sudzuki Erina 18:00, 7 февраля 2014 (UTC)
- Изначально я статью так и называла, только имя, без фамилии, поскольку действительно есть особенность в южноиндийском кино актеров называть исключительно по имени. Позже статью переименовали проверяющие. Мне кажется, логичным, если бы название было только с именем, часто фамилию зрители просто не знают. Oksanchic 07:41, 4 марта 2014 (UTC)
- Спорно. По-моему, предпочтительнее оставить имя и фамилию данной персоны. Если Притхвирадж - имя, а Сукумаран - фамилия, а не отчество, и более того, данная персона использует фамилию в профессии, в этом случае нет достаточных оснований для удаления фамилии. В индийской киноиндустрии широко распространена традиция называть деятелей этой индустрии только по именам (зачастую - по уменьшительным), что обусловлено множеством причин личного и общественного характера, но это не обозначает, что в официальных данных (а Википедия - это энциклопедия, пусть и виртуальная) не указываются или не нужно указывать фамилии персон. Тот факт, что часть современной зрительской аудитории развлекательной киноиндустрии не знает и даже не желает узнать полные имена и фамилии тех или иных деятелей индустрии, характеризует эту часть зрительской аудитории и современное время, но вряд ли может быть аргументом или, тем более, стать правилом при написании статей энциклопедии. Mari-lance 22:16, 11 марта 2014 (UTC)
- У малаяли нет такого, как у нас, понятия фамилии. Скажем, у отца Притхвираджа фамилия была Наир. Но у Притхвираджа - Сукумаран, как и у его матери, поскольку "фамилия" жены и детей это имя мужа/отца соответственно. Т.е. у жены Притхвираджа фамилия не Сукумаран, как у него, а его имя, поэтому ее зовут Суприя Притхвирадж (а не Суприя Сукумаран). Т.е. их фамилии это нечто среднее между нашим отчеством и фамилией, и всех кинозвезд знают исключительно по именам или производным от имени - Маммутти, Моханлал, Нараин, Дилип. На практике многие совершенно не знают фамилию актера. В Болливуде такой особенности нет (но там и не малаяли по национальности, и язык хинди). Там фамилия это именно фамилия. Скажем, Притхвирадж Капур - основатель кинодинастии Капуров, всегда употребляется именно так "Притхвирадж Капур", никому не придет в голову сказать просто Притхвирадж и надеяться, что его поймут. В Керале наоборот - крайне редко назовут еще и фамилию, поскольку это не совсем фамилии. Если кто-то приходит в киноиндустрию, и есть уже звезда с таким именем, то он просто возьмет себе псевдоним, или сократит имя как-то иначе.
Если брать рунет, то вряд ли получится найти фильмы, где в списке актеров вы увидите "Притхвираджа Сукумарана", я сама перевожу малаяламские фильмы, никогда не указываю "Сукумаран", т.к. знают его просто как Притхвираджа. Из всего выше сказанного действительно есть логика в том, чтобы статья называлась просто "Притхвирадж", именно так, как его знают, а фамилия указана была внутри статьи. Oksanchic 14:32, 26 марта 2014 (UTC)
- Не надо вносить путаницу, говоря что Сукумаран — это фамилия. Имя отца в антропониме грамотно называется «отчество». Как уже говорилось у южно-индийцев нет фамилий (не только у малаяли, но также у тамилов). --Sudzuki Erina ✓ 11:58, 20 сентября 2014 (UTC)
Итог
Не переименовано. Сложностей для поиска нет, человек ищущий Притхвираджа легко попадёт на эту статью. Для указания того что Сукумаран - это не фамилия, есть шаблон:малаяльское имя. --Glovacki 08:43, 6 сентября 2015 (UTC)
Согласно нидерландско-русской практической транскрипции сочетание букв Qu передаётся как Кв. --ManFromNord 10:14, 7 февраля 2014 (UTC)
- Судя по таблице, вы правы, если знающий человек подтвердит, нет возражений к переименованию. Slavik Torres 10:37, 7 февраля 2014 (UTC)
 За См., например, написание: Овусу-Абейе, КвинсиNi1ni1 15:55, 9 февраля 2014 (UTC)
За См., например, написание: Овусу-Абейе, КвинсиNi1ni1 15:55, 9 февраля 2014 (UTC)
Итог
Страница была переименована 1 июня 2014 в 12:53 (UTC) в «Промес, Квинси» участником DmitryGrigorev. Данное сообщение было автоматически сгенерировано ботом AeroBot 21:02, 1 июня 2014 (UTC).
- Итог не подведён. GAndy 07:15, 2 июня 2014 (UTC)
- Переименовал согласно транскрипции. В СМИ чаще используется именно правильный вариант Квинси. --ManFromNord 12:03, 5 августа 2014 (UTC)