Восстановительное элиминирование
Восстановительное элиминирование — это один из типов реакций, встречающихся в металлорганической химии.[1][2][3][4][2] Оно заключается в отщеплении органического субстрата от атома металла с одновременным уменьшением его формальной степени окисления на -2. Восстановительное элиминирование часто является частью каталитических циклов наряду с обратной реакцией окислительного присоединения.[5][6]
Общая информация[править | править код]
Восстановительное элиминирование может включать как обмен двумя электронами одним металлическим центром (одноядерное элиминирование), так и обмен по одному электрону каждым из двух металлических центров (биядерное, диядерное или биметаллическое элиминирование).[2][6]
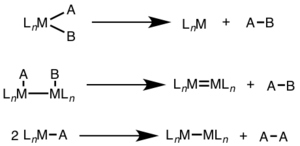
При одноядерном восстановительном элиминировании степень окисления металла уменьшается на два, а число d-электронов металла увеличивается на два, что характерно для d8-металлов Ni(II), Pd(II) и Au(III) и d6-металлов Pt(IV), Pd(IV) , Ir(III) и Rh(III). Кроме того, восстановительное элиминирование протекает только при цис-расположении уходящих групп. [5] [7]

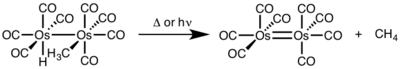
При биядерном восстановительном элиминировании степень окисления каждого металла уменьшается на единицу, а число d-электронов каждого металла увеличивается на единицу. Такое элиминирование характерно для металлов первого переходного ряда, которые предпочитают изменение степени окисления на единицу, но наблюдается также для металлов второго и третьего рядов.[8]
Механизмы восстановительного элиминирования[править | править код]
Как и в случае окислительного присоединения, восстановительное элиминирование может идти по нескольким различным механизмам. Наиболее распространенным является согласованный механизм с образованием трехцентрового переходного состояния с сохранением стереохимии. Кроме того, реакции могут идти по SN2-механизму с инверсией стереохимии или по радикальному механизму. [2]
Октаэдрические комплексы[править | править код]
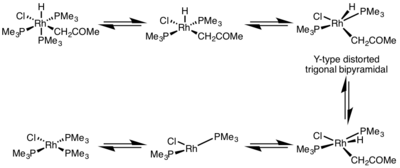
На скорость восстановительного элиминирования большое влияние оказывает геометрия металлокомплекса. В октаэдрических комплексах восстановительное элиминирование идет очень медленно из-за наличия координационно-насыщенного центра и происходит по диссоциативному механизму. Сначала металл разрывает связь с одним из исходных лигандов с образованием 16-электронного интермедиата, к которому затем присоединяется новый лиганд. Диссоциативное замещение можно сравнить с замещением по механизму SN1 в органической химии.[5]
Плоско-квадратные комплексы[править | править код]
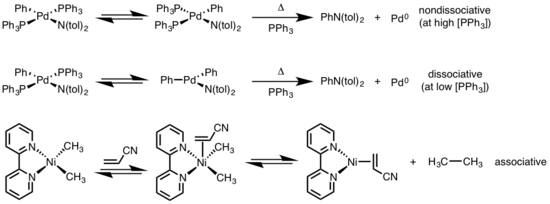
Восстановительное элиминирование плоско-квадратных комплексов может происходить по различным механизмам: диссоциативному, недиссоциативному и ассоциативному. Подобно октаэдрическим комплексам, диссоциативный механизм для плоско-квадратных комплексов инициируется потерей лиганда с образованием трехкоординационного интермедиата, который подвергается восстановительному элминированию с образованием однокоординационного комплекса. По недиссоциативному механизм четырехкоординационный комплекс превращается в двухкоординационный. Если уходящие лиганды расположены в транс-положении, комплекс должен сначала подвергнуться транс-цис-изомеризации. По ассоциативному механизму лиганд должен вначале ассоциироваться с четырехкоординационным комплексом металла с образования пятикоординационного комплекса, который и подвергается восстановительному элиминированию наподобие диссоциативного механизма в октаэдрических комплексов.[9][10]
Факторы, влияющие на восстановительное элиминирование[править | править код]
На восстановительное элиминирование влияет множество факторов, в том числе: 1) Природа металла и электронная плотность; 2) Стерический фактор; 3) Лиганды; 4) Координационное число; 5) геометрия; и 6) Фотолиз/окисление. Кроме того, поскольку восстановительное элиминирование является обратной реакцией окислительного присоединения, то любые стерические или электронные факторы, увеличивающие скорость окислительного присоединения, будут снижать скорость восстановительного элиминирования.[6]
Природа металла и электронная плотность[править | править код]
Комплексы металлов первого переходного ряда, как правило, быстрее подвергаются восстановительному элиминированию, чем комплексы металлов второго и, тем более, третьего рядов. Это связано с прочностью связи: связи металл-лиганд в комплексах первого ряда слабее, чем аналогичные связи в комплексах следующих рядов. Кроме того, бедные электронами металлические центры охотнее вступают в реакцию, чем богатые, поскольку в результате восстановительного элиминирования происходит увеличение электронной плотности на металле. [11]
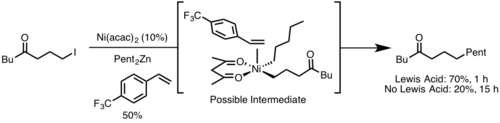
Стерический фактор[править | править код]
Восстановительное элиминирование протекает быстрее в комплексах, где металл пространственно более затруднен. Это связано с тем, что в ходе реакции стерические затруднения уменьшаются. Также более быстрому протеканию реакции способствует сближение уходящих групп и бо́льшее перекрытие орбиталей. [12]
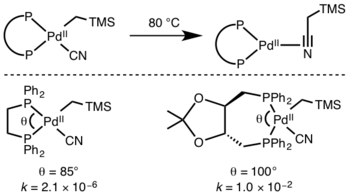
Лиганды[править | править код]
Предсказать кинетику восстановительного элиминирования трудно, но реакции с участием гидридов протекают быстрее из-за перекрывания орбиталей в переходном состоянии. [13]

Координационное число[править | править код]
Восстановительное элиминирование протекает быстрее для трех- или пятикоординационных комплексов, чем для четырех- или шестикоординационных. Для комплексов с четными координационными числами восстановительное элиминирование приводит к интермедиату с сильной разрыхляющей орбиталью металл-лиганд. В случае комплексов с нечетным координационным числом, образующийся интермедиат занимает несвязывающую молекулярную орбиталь. [14]

Геометрия[править | править код]
Восстановительное элиминирование обычно происходит быстрее для комплексов, строение которых схоже со строением продукта.[6]
Фотолиз/окисление[править | править код]
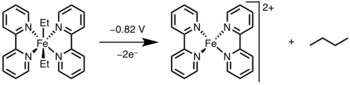
Восстановительное элиминирование может быть вызвано окислением металлического центра до более высокой степени окисления светом или окислителем.[15]
Применения[править | править код]
Восстановительное элиминирование (и обратная ей реакция окислительного присоединения) являются ключевыми стадиями в большинстве каталитических циклов, например, в реакциях Сузуки, Соногаширы и др. Например, в реакции кросс-сочетания Кумады за счет окислительного присоединения активируется исходный субстрат арилбромид, а за счет восстановительного элиминирования регенерируется активная частица L2Ni0 и образуется органический продукт. Движущей силой последнего процесса является формирование прочной связи C–C из относительно слабых связей Ni–C. Кроме того элиминирование дополнительно ускоряет пространственное напряжение вокруг металла, которое создает хелатный фосфиновый лиганд бис(дифенилфосфино)-пропан.[5]
Стоит отметить, что в случаях реакции Хека и Вакер-процесса восстановительное элиминирование участвует только в регенерации катализатора, поскольку продукты этих реакций образуются в результате β-элиминирования.[16][17]
Примечания[править | править код]
- ↑ Jay A. Labinger "Tutorial on Oxidative Addition" Organometallics, 2015, volume 34, pp 4784–4795. doi:10.1021/acs.organomet.5b00565
- ↑ 1 2 3 4 Crabtree, Robert H. The Organometallic Chemistry of the Transition Metals. — 6. — Wiley, 2014. — P. 173. — ISBN 978-1-118-13807-6.
- ↑ Miessler, Gary L. Inorganic Chemistry / Gary L. Miessler, Donald A. Tarr. — 3rd.[ISBN?]
- ↑ Shriver, D. F. Inorganic Chemistry / D. F. Shriver, P. W. Atkins.[ISBN?]
- ↑ 1 2 3 4 Перекалин Д.С. Металлоорганическая химия и немного катализа. — М. : Перо, 2019. — 80 с. — ISBN 978-5-00150-431-3.
- ↑ 1 2 3 4 Hartwig, John F. Organotransition Metal Chemistry, from Bonding to Catalysis. — University Science Books, 2010. — P. 321. — ISBN 978-1-891389-53-5.
- ↑ Gillie, A.; Stille, J. K. (1980). "Mechanisms of 1,1-Reductive Elimination from Palladium". J. Am. Chem. Soc. 102 (15): 4933—4941. doi:10.1021/ja00535a018.
- ↑ Okrasinski, S. J.; Nortom, J. R. (1977). "Mechanism of Reductive Elimination. 2. Control of Dinuclear vs. Mononuclear Elimination of Methane from cis-Hydridomethyltetracarbonylosmium". J. Am. Chem. Soc. 99: 295—297. doi:10.1021/ja00443a076.
- ↑ Driver, M. S.; Hartwig, J. F. (1997). "Carbon−Nitrogen-Bond-Forming Reductive Elimination of Arylamines from Palladium(II) Phosphine Complexes". J. Am. Chem. Soc. 119 (35): 8232—8245. doi:10.1021/ja971057x.
- ↑ Yamamoto, T.; Yamamoto, A.; Ikeda, S. (1971). "Study of Organo(dipyridyl)nickel Complexes. I. Stability and Activation of the Alkyl-Nickel Bonds of Dialkyl(dipyridyl)nickel by Coordination with Various Substituted Olefins". J. Am. Chem. Soc. 93: 3350. doi:10.1021/ja00743a009.
- ↑ Giovannini, R.; Stüdemann, T.; Dussin, G.; Knochel, P. (1998). "An Efficient Nickel-Catalyzed Cross-Coupling Between sp3 Carbon Centers". Angew. Chem. Int. Ed. 37 (17): 2387—2390. doi:10.1002/(SICI)1521-3773(19980918)37:17<2387::AID-ANIE2387>3.0.CO;2-M.
- ↑ Marcone, J. E.; Moloy, K. G. (1998). "Kinetic Study of Reductive Elimination from the Complexes (Diphosphine)Pd(R)(CN)". J. Am. Chem. Soc. 120 (33): 8527—8528. doi:10.1021/ja980762i.
- ↑ Low, J. J.; Goddard, III, W. A. (1984). "Reductive Coupling of Hydrogen-Hydrogen, Hydrogen-Carbon, and Carbon-Carbon Bonds from Palladium Complexes". J. Am. Chem. Soc. 106 (26): 8321—8322. doi:10.1021/ja00338a067.
- ↑ Crumpton-Bregel, D. M.; Goldberg, K. I. (2003). "Mechanisms of C-C and C-H Alkane Reductive Eliminations from Octahedral Pt(IV): Reaction via Five-Coordinate Intermediates or Direct Elimination?". J. Am. Chem. Soc. 125: 9442. doi:10.1021/ja029140u. PMID 12889975.
- ↑ Lau, W.; Huffman, J. C.; Kochi, J. K. (1982). "Electrochemical Oxidation-Reduction of Organometallic Complexes. Effect of the Oxidation State on the Pathways for Reductive Elimination of Dialkyliron Complexes". Organometallics. 1: 155—169. doi:10.1021/om00061a027.
- ↑ de Vries, J. G. (2001). "The Heck reaction in the production of fine chemicals" (PDF). Can. J. Chem. 79 (5—6): 1086—1092. doi:10.1139/v01-033. hdl:11370/31cf3b82-e13a-46e2-a3ba-facb1e2bffbf. Архивировано (PDF) из оригинала 17 февраля 2019. Дата обращения: 13 марта 2022.
- ↑ Dong, J. J.; Browne, W. R.; Feringa, B. L. (2015). "Palladium-Catalyzed anti-Markovnikov Oxidation of Terminal Alkenes". Angew. Chem. Int. Ed. 54 (3): 734—744. doi:10.1002/anie.201404856. PMID 25367376.