Диазометан
| Диазометан | |||
|---|---|---|---|
| |||
| Общие | |||
| Традиционные названия | Диазометан | ||
| Хим. формула | CH2N2 | ||
| Физические свойства | |||
| Состояние | газ жёлтого цвета с неприятным запахом | ||
| Молярная масса | 42.04 г/моль | ||
| Энергия ионизации | 9 ± 0 эВ[3] и 9 эВ[4] | ||
| Термические свойства | |||
| Температура | |||
| • плавления | -145 °C | ||
| • кипения | -23 °C | ||
| Давление пара | 1 ± 1 атм[3] | ||
| Структура | |||
| Дипольный момент | 5,0E−30 Кл·м[4] | ||
| Классификация | |||
| Рег. номер CAS | 334-88-3 | ||
| PubChem | 9550 | ||
| Рег. номер EINECS | 206-382-7 | ||
| SMILES | |||
| InChI | |||
| RTECS | PA7000000 | ||
| ChEBI | 73716 | ||
| ChemSpider | 9176 | ||
| Безопасность | |||
| ЛД50 | 15 мг/кг[1] | ||
| Токсичность | для высших животных высокотоксичен[2]; способен проявлять канцерогенное действие | ||
| NFPA 704 | |||
| Приведены данные для стандартных условий (25 °C, 100 кПа), если не указано иное. | |||
Диазометáн — соединение с брутто-формулой CH2N2, имеющее следующее строение:

В чистом виде диазометан — газ жёлтого цвета. Для лабораторной практики, как правило, он используется в виде раствора в диэтиловом эфире. Удобный источник карбеновых радикалов и мягкий алкилирующий агент.
Получение[править | править код]
- Наиболее удобным лабораторным способом является действие 30 % щёлочи на бис(N-метил-N-нитрозоамид) фталевой кислоты[5]:
- Другой вариант: реакция N-метил-N-нитрозо-пара-толуолсульфонамида или 1-метил-3-нитро-1-нитрозогуанидина с гидроксидом натрия или калия при нагревании[6]:
- Возможно получение из хлороформа и гидразина в щелочной среде[7]:
Химические свойства[править | править код]
Химические свойства диазометана могут быть описаны с точки зрения наличия резонанса[5]:

- При пиролизе диазометана образуется карбен CH2: — высокореакционная короткоживущая частица, которая легко присоединяется по двойной или тройной связи:
1. Первый этап — образование карбена:
CH2=N=N → CH2: + N2 (пиролиз или фотолиз диазометана)
2. Второй этап — присоединение карбена с образованием циклосоединений:
- При протонировании диазометана образуется метилдиазоний-катион:

Благодаря этому свойству, диазометан довольно легко вступает в реакции алкилирования[8]:
R-COOH + CH2N2 → R-COOCH3 + N2
R-OH + CH2N2 → R-OCH3 + N2
R-CHO + CH2N2 → R-CO-CH3 + N2
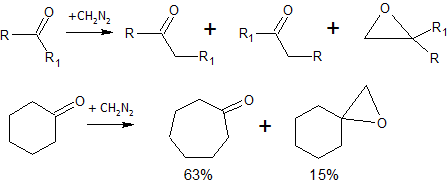
Кетоны в реакции с диазометаном дают смесь продуктов (реакция Бухнера — Курциуса — Шлоттербека)[9]:
- Важнейшей является реакция Арндта — Эйстерта — превращение карбоновой кислоты в её ближайший гомолог с использованием диазометана:
Безопасность[править | править код]
Диазометан токсичен при вдыхании, а также при контакте с глазами и кожей. Симптомы отравления включают дискомфорт в груди, головную боль, слабость, в тяжелых случаях — коллапс.[10] Симптомы могут проявляться не сразу. Описаны случаи смертельных отравлений.[11] Как и другие алкилирующие агенты, диазометан может проявлять канцерогенные свойства, однако обычно их перекрывает острая токсичность диазометана.
CH2N2 способен детонировать при контакте с острыми гранями твёрдых предметов, в частности, с трещинами в стекле и со шлифованными поверхностями. По той же причине, для осушения эфирного раствора CH2N2 рекомендуется использовать гранулированный KOH. Приготовление растворов диазометана следует проводить, используя защитный экран.
Примечания[править | править код]
- ↑ name=https://docs.cntd.ru_Diazomethane (недоступная ссылка)
- ↑ name=https://docs.cntd.ru_Диазометан (недоступная ссылка)
- ↑ 1 2 http://www.cdc.gov/niosh/npg/npgd0182.html
- ↑ 1 2 David R. Lide, Jr. Basic laboratory and industrial chemicals (англ.): A CRC quick reference handbook — CRC Press, 1993. — ISBN 978-0-8493-4498-5
- ↑ 1 2 Травень В. Ф. Органическая химия, М.: ИКЦ «Академкнига», 2004. — ISBN 5-94628-068-6.
- ↑ DIAZOMETHANE. Дата обращения: 24 июня 2009. Архивировано из оригинала 1 июня 2009 года.
- ↑ Рупе, Г. Лекционные опыты по органической химии / пер. со 2 изд. Д. Б. Сциборского и Л. И. Морева, под ред. проф. Ю. С. Залькинда и проф. В. А. Измаильского, перераб. и доп. В. А. Измаильским. — ОНТИ, Химтеорет, 1936. — С. 168-169. — 330 с.
- ↑ Нитро- и диазосоединения. Глава 4. Дата обращения: 24 июня 2009. Архивировано 3 июля 2008 года.
- ↑ [www.xumuk.ru/encyklopedia/678.html XuMuK.ru — БУХНЕРА — КУРЦИУСА — ШЛОТТЕРБЕКА РЕАКЦИЯ — Химическая энциклопедия]
- ↑ Muir, GD (ed.) 1971, Hazards in the Chemical Laboratory, The Royal Institute of Chemistry, London.
- ↑ LeWinn, E.B. «Diazomethane Poisoning: Report of a fatal case with autopsy», The American Journal of the Medical Sciences, 1949, 218, 556—562
Это заготовка статьи по органической химии. Помогите Википедии, дополнив её. |
Некоторые внешние ссылки в этой статье ведут на сайты, занесённые в спам-лист |