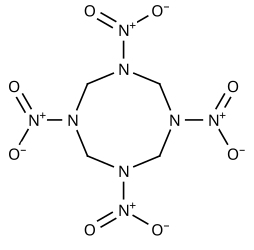
Октоген
| Октоген | |
|---|---|
  | |
| Общие | |
| Систематическое наименование |
1,3,5,7-тетранитро-1,3,5,7-тетраазациклооктан |
| Традиционные названия | Октоген, циклотетраметилентетранитрамин, НМХ |
| Хим. формула | C4H8N8O8 |
| Физические свойства | |
| Состояние | твердое |
| Молярная масса | 296,1 г/моль |
| Термические свойства | |
| Температура | |
| • плавления | 278,5—280 °C |
| Классификация | |
| Рег. номер CAS | 2691-41-0 |
| PubChem | 17596 |
| Рег. номер EINECS | 220-260-0 |
| SMILES | |
| InChI | |
| ChEBI | 33176 |
| ChemSpider | 16636 |
| Приведены данные для стандартных условий (25 °C, 100 кПа), если не указано иное. | |
Октогéн (1,3,5,7-тетранитро-1,3,5,7-тетраазациклооктáн, циклотетраметилентетранитрамин, HMX) — (CH2)4N4(NO2)4, термостойкое бризантное взрывчатое вещество. Впервые был получен как побочный продукт процесса получения гексогена конденсацией нитрата аммония с параформом в присутствии уксусного ангидрида. Представляет собой белый порошок кристаллического характера. Относится к III классу опасности — умеренно токсичен. Впервые был получен американцами в 1942 г. Рассматривался как вредная примесь к гексогену, так как разбавлением водой осаждалась чувствительная α-форма.
Физические и химические свойства[править | править код]
- Плотность: 1905 кг/м³.
- Температура плавления 278,5—280 °C (с разложением).
- Температура вспышки 330 °C.
Октоген почти нерастворим в воде, метаноле, этаноле, бензоле, диэтиловом эфире. Малорастворим в ацетоне, с аминами (ДМФА, диметиланилин) способен образовывать молекулярные комплексы.
Октоген сравнительно химически инертен, устойчив на свету, но гидролизуется при действии растворов щелочей в водном ацетоне либо концентрированных минеральных кислот.
Взрывчатые свойства[править | править код]
- Обладает высокой чувствительностью к удару.
- Скорость детонации 9100 м/с при плотности 1,84 г/см³.
- Объём газообразных продуктов взрыва 782 л/кг.
- Теплота взрыва 5,73 МДж/кг.
- Фугасность 480 мл.
- Тротиловый эквивалент 1,6.
Получение[править | править код]
Получают действием концентрированной азотной кислоты на уротропин в растворе уксусной кислоты, уксусного ангидрида и нитрата аммония в растворе азотной кислоты. Очищение технического октогена от примесей достигается обработкой ДМФА, который образует с октогеном комплексы. Эти комплексы отделяют от реакционной смеси и разрушают действием воды.
Перекристаллизация октогена проводятся из горячих насыщенных растворов в ацетоне, ацетонитриле и нитрометане, при медленной кристаллизации получается его β-модификация, при быстрой — α-форма.
Применение[править | править код]
Применяется при производстве пластичных взрывчатых веществ, взрывных работах в высокотемпературной среде. В составе смесевых ВВ используется для военных целей, как правило, для снаряжения кумулятивных зарядов, что увеличивает их бронепробиваемость приблизительно на 10 % по сравнению со снарядами из гексогена, и для снаряжения снарядов скорострельных малокалиберных пушек (например, ЗУ-23-2, ЗСУ-23-4 и M61 Vulcan), так как высокий темп стрельбы приводит к развитию в таких орудиях высоких температур, к которым октоген стоек. Наиболее часто используемые смесевые ВВ из октогена — октол (77 процентов октогена и 23 процента тротила) и окфол (95 процентов октогена и 5 процентов пластификатора, обычно воска). В составе пластичных ВВ используется диверсионными спецподразделениями. Компонент твёрдых ракетных топлив; в частности, применяется для изготовления детонирующего топлива, что актуально для ПЗРК. Представляет интерес как термостойкое взрывчатое вещество (применяют при температурах до 210 °С) для перфорации высокотемпературных нефтяных и газовых скважин.
Кристаллические модификации[править | править код]
| Показатели модификаций | β- | α- | γ- | δ- |
|---|---|---|---|---|
| Область существования, °С | до 115 | от 115 до 156 | около 156 | от 156 до плавления |
| Стабильность при комнатной температуре |
стабильна | метастабильна | метастабильна | нестабильна |
| Плотность кристаллов, кг/м³ | 1910 | 1870 | 1820 | 1780 |
| Форма кристаллов | моноклинные массивные | орторомбические игольчатые | моноклинные пластинчатые | гексагональные игольчатые |
Литература[править | править код]
- Орлова Е. Ю. Химия и технология бризантных взрывчатых веществ / Е. Ю. Орлова. — Л.: «Химия», 1973.
- Химическая энциклопедия / Редкол.: Кнунянц И.Л. и др.. — М.: Советская энциклопедия, 1992. — Т. 3 (Мед-Пол). — 639 с. — ISBN 5-82270-039-8.