Протеасома

Протеасо́ма (от англ. protease — протеиназа и лат. soma — тело) — многобелковый комплекс, разрушающий ненужные или дефектные белки при помощи протеолиза (химической реакции, при которой происходит разрыв пептидных связей) до коротких пептидов (4—25 аминокислотных остатков). Эти пептиды затем могут быть расщеплены до отдельных аминокислот[1][2]. Протеасомы присутствуют в клетках эукариот, архей и некоторых бактерий. В эукариотических клетках протеасомы содержатся и в ядре, и в цитоплазме[3]. Деградация 80—90 % внутриклеточных белков происходит при участии протеасомы[2]. Для того чтобы белок-мишень расщепился протеасомой, он должен быть помечен путём присоединения к нему маленького белка убиквитина. Реакция присоединения убиквитина катализируется ферментами убиквитинлигазами. Присоединение первой молекулы убиквитина к белку служит для убиквитинлигаз сигналом для дальнейшего присоединения молекул убиквитина. В результате к белку оказывается присоединена полиубиквитиновая цепь, которая связывается с протеасомой и обеспечивает расщепление белка-мишени[1][2]. В целом вся эта система получила название убиквитин-зависимой деградации белка[4].
Протеасомальная деградация белка важна для протекания многих клеточных процессов, включая клеточный цикл, регуляцию экспрессии генов и ответ на окислительный стресс[5]. В 2004 году Аарон Чехановер, Аврам Гершко и Ирвин Роуз были удостоены Нобелевской премии по химии «за открытие убиквитин-зависимой деградации белка»[6].

История открытия[править | править код]
До открытия убиквитин-зависимой системы деградации белков считалось, что деградация белков в клетке происходит, главным образом, за счёт лизосом. Лизосомы — это мембранные органеллы с кислой внутренней средой, содержащей протеазы. Они способны утилизировать экзогенные белки, захваченные клеткой в процессе эндоцитоза, белки, связанные с мембранами, и повреждённые органеллы[1][2]. Однако в 1977 году Альфред Голдберг доказал существование АТФ-зависимой системы деградации белка в ретикулоцитах, которые лишены лизосом[7]. Это позволило предположить, что существует как минимум ещё один механизм внутриклеточного расщепления белков. В 1978 году было показано, что соответствующая протеаза состоит из полипептидных цепей нескольких типов[8]. Кроме того, при исследовании посттрансляционных модификаций гистонов была обнаружена неожиданная ковалентная модификация: присоединение к боковой цепи лизина в гистоне C-концевого остатка глицина убиквитина — небольшого белка с неизвестной функцией[9]. Было установлено, что описанный ранее АТФ-зависимый фактор протеолиза 1 и убиквитин являются одним и тем же белком[10]. В дальнейшем АТФ-зависимый белковый комплекс, ответственный за убиквитин-опосредованную деградацию белка, был выделен из лизата клеток и назван 26S-протеасомой[11][12].
Большая часть ранних работ, которые впоследствии привели к открытию протеасомной системы деградации белков, была выполнена в конце 1970-х — начале 1980-х годов в лаборатории Аврама Хершко в Технионе, где Аарон Чехановер был аспирантом. Ключевые концептуальные идеи Хершко выработал за год работы в лаборатории Ирвина Роуза, хотя Роуз впоследствии и преуменьшал свою роль в открытии[13]. Все трое разделили Нобелевскую премию по химии в 2004 году за открытие этой системы.
Хотя электронно-микроскопические данные, указывающие на то, что структура протеасомы представляет собой несколько колец, уложенных в стопку, были доступны уже в середине 1980-х годов[14], первая структура коровой части протеасомы, составленная на основе данных рентгеноструктурного анализа, была получена только в 1994 году[15].
Структура[править | править код]


Компоненты протеасомы часто называются в соответствии с их коэффициентами седиментации в сведбергах (обозначается буквой S). Протеасома, активная в расщеплении белков, называется 26S-протеасомой и обычно состоит из коровой 20S-протеасомы и одной или двух регуляторных частиц 19S (PA700) и 11S, которые присоединяются к торцам коровой частицы. Хотя присоединение двух регуляторных частиц, строго говоря, приводит к формированию протеасомы с коэффициентом седиментации 30S, термин «30S-протеасома» в литературе практически не используется, а название «26S-протеасома» применяется по отношению к обеим изоформам. Кроме регуляторной частицы 19S, в состав 26S-протеасомы могут входить и другие регуляторные компоненты: PA28α/β (11S REG), PA28γ (REGγ), PA200, PI31[2]. В состав некоторых протеасом входит другая регуляторная частица — 11S. Она взаимодействует с 20S-частицей так же, как 19S, и может принимать участие в деградации чужеродных белков, например, синтезированных во время вирусной инфекции[16].
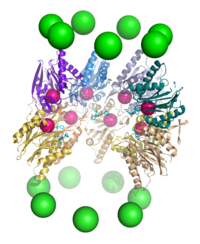
Размеры протеасом относительно эволюционно стабильны и составляют 150 на 115 ангстрем. Внутренняя полость имеет максимальную ширину 53 ангстрема, однако вход в протеасому может иметь ширину всего 13 ангстрем, это указывает на то, что для входа в протеасому белок должен быть специфично[17] денатурирован[18].
20S-частица[править | править код]
20S-частицы протеасом прокариот и эукариот имеют принципиально одинаковую четвертичную структуру и состоят из 28 субъединиц, организованных в четыре семичленных кольца, уложенных друг на друга в виде стопки[2]. Однако разнообразие субчастиц протеасомы зависит от конкретного организма: разнообразие субъединиц выше у многоклеточных организмов по сравнению с одноклеточными и у эукариот по сравнению с прокариотами. Протеасомы прокариот состоят из 14 копий идентичных α-субъединиц, которые формируют внешние кольца, и 14 копий идентичных β-субъединиц, которые формируют внутренние кольца. В эукариотической протеасоме все семь субъединиц одного кольца отличаются по структуре, то есть протеасома состоит из двух копий семи разных α-субъединиц и двух копий семи разных β-субъединиц. Несмотря на небольшие различия, с точки зрения пространственной структуры α- и β-субъединицы, тем не менее, очень похожи. α-субъединицы отвечают за присоединение к 20S-протеасоме регуляторных частиц, а их N-концевые участки прикрывают вход в полость протеасомы, что исключает неконтролируемый протеолиз[19]. β-субъединицы имеют протеазные центры и являются каталитическими компонентами протеасомы. У архей, например, у Thermoplasma acidophilum, все β-субъединицы одинаковы, поэтому протеасома содержит 14 идентичных протеазных центров. В протеасомах млекопитающих каталитически активными являются только β1-, β2- и β5-субъединицы, причём все эти субъединицы обладают разными субстратными специфичностями (пептидил-глутамил-гидролизующей, трипсиноподобной и химотрипсиноподобной соответственно)[20]. В гематопоэтических клетках под действием провоспалительных сигналов, таких как цитокин интерферон γ, могут экспрессироваться альтернативные формы β-субъединиц, которые обозначаются β1i, β2i и β5i. Протеасому, содержащую эти альтернативные β-субъединицы, называют иммунопротеасомой, и её субстратная специфичность несколько отличается от таковой у обычной протеасомы[18]. В середине 2010-х годов в клетках человека были идентифицированы необычные протеасомы, лишённые коровой субъединицы α3[21]. В таких протеасомах (известных также как α4-α4 протеасомы) 20S-коровая часть содержит субъединицу α4 вместо α3. Альтернативные α4-α4 протеасомы были также выявлены у дрожжей[22]. Хотя функции этой изоформы протеасомы неизвестны, клетки, экспрессирующие их, отличаются повышенной устойчивостью к токсичному действию ионов металлов, например, кадмия[21][23].
19S-регуляторная частица[править | править код]
У эукариот 19S-частица состоит из 19 отдельных белковых молекул, которые образуют 9-субъединичное основание, непосредственно взаимодействующее с α-кольцом 20S-коровой частицы, и 10-субъединичную «крышечку». Шесть из девяти белков основания являются АТФазами из семейства ААА, их гомологи имеются у архей и называются PAN (от англ. Proteasome-Activating Nucleotidase — нуклеотидаза, активирующая протеасому)[24]. Для взаимодействия 19S- и 20S-частиц необходимо, чтобы субъединицы 19S-частицы с АТФазной активностью были связаны с АТФ, и для протеасомной деградации уложенных и убиквитинированных белков необходим гидролиз АТФ. Строго говоря, гидролиз АТФ нужен только для денатурации белков, но само связывание с АТФ может способствовать протеканию других этапов разрушения белков (например, сборке комплекса, открыванию ворот, транслокации и протеолизу)[25][26]. Кроме того, связывание АТФ с АТФазами само по себе способствует быстрой деградации неуложенных белков. Хотя абсолютная необходимость в АТФ показана лишь для разрушения пространственной структуры белка, до конца не исключена возможность того, что гидролиз АТФ необходим для сопряжения разных этапов деградации белка[26][27].
В 2012 году две исследовательские группы независимо представили молекулярную структуру 26S-протеасомы, полученную с помощью электронной микроскопии единичных частиц[28][29]. Позднее с помощью криоэлектронной микроскопии была построена атомная модель протеасомы. В центре 19S-частицы, недалеко от 20S-частицы, находятся ААА-АТФазы, которые образуют гетерогексамерное кольцо (Rpt1/Rpt2/Rpt6/Rpt3/Rpt4/Rpt5). Это кольцо представляет собой тример димеров Rpt1/Rpt2, Rpt6/Rpt3 и Rpt4/Rpt5. АТФазы димеризуются при помощи своих N-концевых биспиральных (англ. coiled coil) участков, которые выступают из гексамерного кольца. Два регуляторных белка Rpn1 и Rpn2, лишённые АТФазной активности, связываются с концами димеров Rpt1/2 и Rpt6/3 соответственно. Рецептор убиквитина Rpn13 связывается с Rpn2. Крышечка закрывает половину ААА-АТФазного гексамера (Rpt6/Rpt3/Rpt4) и взаимодействует непосредственно с 20S-частицей при помощи Rpn6 и, в меньшей степени, Rpn5. Субъединицы Rpn9, Rpn5, Rpn6, Rpn7, Rpn3 и Rpn12, структурно родственные друг другу, а также субъединицам комплексов COP9 и eIF3, объединяются в подковообразную структуру, в которой заключён гетеродимер Rpn8/Rpn11. Субъединица Rpn11, которая является деубиквитинирующим ферментом, помещается недалеко от внутренней полости гексамерного кольца из ААА-АТФаз, что идеально подходит для удаления убиквитиновых остатков непосредственно перед транслокацией разрушаемых белков в 20S-частицу. Второй из известных на данный момент убиквитиновых рецепторов, Rpn10, находится на периферии крышечки, рядом с субъединицами Rpn8 и Rpn9[30].
Конформационные изменения в 19S-частице[править | править код]
Для регуляторной частицы 19S известны три чётко различающиеся конформации[31]. Вероятно, все они играют важную роль в распознавании и разрушении субстрата. Первая конформация характеризуется наименьшей энергией, что достигается расположением ААА-доменов АТФаз в виде лестницы или пружины[30][28]. В присутствии АТФ, но в отсутствие субстрата, наблюдается вторая, менее распространённая конформация, которая отличается расположением крышечки относительно ААА-АТФазного модуля. В присутствии АТФ-γS или субстрата реализуется третья конформация с сильно изменённой структурой ААА-АТФазного модуля[32][33].
Регуляция 20S-частицы 19S-частицей[править | править код]
19S — регуляторная частица, она стимулирует разрушение субстрата 20S-субъединицей. Главной функцией 19S-частицы является открывание ворот в 20S, которые препятствуют входу субстратов внутрь протеасомы[34]. Удалось определить механизм, по которому АТФазы открывают ворота 20S-частицы. Для открывания ворот необходим специфический мотив на C-концах АТФаз. За счёт него C-концы АТФаз входят в специальные карманы в верхней части 20S-частицы, закрепляя АТФазный комплекс на 20S-протеолитическом комплексе, благодаря чему часть протеасомы, ответственная за денатурацию субстрата, оказывается сопряжена с деградирующим модулем. Само связывание C-концов АТФаз с 20S вызывает открытие ворот в последней подобно тому, как ключ открывает замок. Структурные изменения, сопровождающие открытие ворот, также были изучены[35].
11S-регуляторная частица[править | править код]
С 20S-протеасомой может взаимодействовать ещё одна регуляторная частица, имеющая массу 11S и представляющая собой гептамер (она также известна как PA28 или REG). Она не содержит АТФаз и способствует разрушению коротких пептидов, но не больших белков. Вероятно, это связано с тем, что 11S-частица не может денатурировать большие белковые молекулы. Механизм взаимодействия 11S-частицы с 20S-протеасомой напоминает взаимодействие 19S-частицы с последней: 11S-частица связывается с 20S своим C-концевым хвостом и вызывает конформационные изменения в α-кольце, которые вызывают открытие ворот 20S-частицы[36]. Экспрессия 11S-частицы запускается интерфероном γ, и эта частица, наряду с β-субъединицами иммунопротеасомы, ответственна за образование пептидов, которые связываются с главным комплексом гистосовместимости[16].
Сборка[править | править код]
Сборка протеасомы — очень сложный процесс, при котором множество отдельных белковых молекул должны объединиться с образованием активного комплекса. β-субъединицы синтезируются с N-концевыми «пропептидами», которые при сборке 20S-частицы подвергаются посттрансляционным модификациям, чтобы потом войти в состав каталитического активного центра. 20S-частица собирается из двух половин, каждая из которых содержит β-кольцо, состоящее из семи субъединиц и связанное с семичленным α-кольцом. Полная 20S-частица формируется при соединении двух половин посредством β-колец, которое сопровождается треонинзависимым автолизом пропептидов, в результате чего образуется активный центр протеасомы. Взаимодействие β-колец опосредовано соляными мостиками и гидрофобными взаимодействиями консервативных α-спиралей, причём мутации в них делают невозможной сборку протеасомы[37]. Сборка каждой половины протеасомы начинается с образования гептамерного кольца из α-субъединиц, которое служит в качестве матрицы для сборки β-кольца. Механизм сборки α-кольца не изучен[38].
Регуляторная частица 19S собирается из двух частей — основания и крышечки. Сборка основания происходит при участии четырёх шаперонов Hsm3/S5b, Nas2/p27, Rpn14/PAAF1 и Nas6/ганкирин (первое название — у дрожжей, второе — у млекопитающих)[39]. Шапероны взаимодействуют с ААА-АТФазными субъединицами и обеспечивают формирование из них правильного гексамерного кольца. Сборке основания также способствует деубиквитинирующий фермент Ubp6/Usp14, однако он не является строго необходимым[40]. Пока что неизвестно, связана ли сборка 19S-частицы со сборкой 20S-частицы. Крышечка собирается отдельно от основания без участия шаперонов[41].
Разрушение белков[править | править код]
Убиквитинирование[править | править код]

Белки, которые необходимо разрушить с помощью протеасом, метятся ковалентным присоединением маленького белка убиквитина к остаткам лизина. Присоединение убиквитина осуществляется тремя ферментами. На первом этапе убиквитин-активирующий фермент, известный как Е1, гидролизует АТФ и аденилилирует молекулу убиквитина. Далее аденилилированный убиквитин переносится на остаток цистеина фермента E1 одновременно с аденилированием второго убиквитина[42]. Аденилилированный убиквитин далее переносится на остаток цистеина второго фермента — убиквитин-конъюгирующего фермента (Е2). На последнем этапе фермент из обширной группы убиквитинлигаз (Е3) распознаёт белок, который нужно разрушить, и переносит на него убиквитин с Е2. Таким образом, субстратную специфичность убиквитин-протеасомной системы обеспечивает именно Е3[43]. Для распознавания крышечкой протеасомы белок должен нести цепочку из как минимум четырёх мономеров убиквитина (то есть быть полиубиквитинированным)[44].
Механизм распознавания полиубиквитинированного белка протеасомой до конца не понятен. Рецепторы убиквитина имеют N-концевой убиквитин-подобный домен (англ. ubiquitin-like domain, UBL), а также один или несколько убиквитин-ассоциированных доменов (англ. ubiquitin-associated domain, UBA). UBL-домены распознаются крышечкой протеасомы, а UBA взаимодействует с убиквитином при помощи трёх α-спиралей. Белки-рецепторы убиквитина могут доставлять полиубиквитинированные белки к протеасоме, однако детали процесса и его регуляция неясны[45].
Сам убиквитин состоит из 76 аминокислотных остатков и получил своё название за повсеместное распространение (от англ. ubiquitous — «повсеместный»). Этот белок очень консервативен и выявляется у всех эукариот[46]. Гены эукариот, кодирующие убиквитин, образуют тандемные повторы, вероятно, из-за того, что они очень активно транскрибируются, чтобы поддерживать необходимый уровень убиквитина в клетке. Высказываются предположения, что убиквитин — самый медленно эволюционирующий белок из известных[47]. Убиквитин содержит семь остатков лизина, к которым могут присоединяться другие молекулы убиквитина, благодаря чему возможно образование полиубиквитиновых цепочек разного вида[48]. Протеасома распознаёт полиубиквитиновые цепочки, в которых каждая следующая молекула убиквитина присоединяется к 48-му остатку предыдущего убиквитина, а все остальные участвуют в других клеточных процессах, то есть представляют собой посттрансляционные модификации[49].
Денатурация и транслокация[править | править код]
Полиубиквитинированный белок распознаётся 19S-субъединицей, и для его денатурации (то есть разрушения пространственной структуры) необходима энергия АТФ[26]. Далее белок должен попасть внутрь 20S-субъединицы, а именно в её активный центр. Поскольку полость 20S-субъединицы очень узкая и закрыта воротами из N-концов субъединиц α-кольца, субстрат должен быть хотя бы отчасти денатурирован. Кроме того, с него должна быть снята убиквитиновая метка[26]. Переход денатурированного белка внутрь активного центра протеасомы называется транслокацией. Однако порядок, в котором происходит денатурация и деубиквитинирование белков-субстратов, неизвестен[50]. То, какой из этих этапов является скоростьлимитирующим, зависит от субстрата[25]. Степень денатурации, которая позволяет субстрату попасть в активный центр, также неизвестна, однако третичная структура и некоторые связи внутри белковой молекулы, например, дисульфидные связи, препятствуют разрушению белка[51]. Наличие неуложенных участков определённой длины внутри белка или на его конце облегчает эффективное разрушение[52][53].
Ворота, сформированные α-субъединицами, препятствуют попаданию внутрь 20S-частицы пептидов, состоящих из более чем четырёх остатков. Перед транслокацией пептида происходит его денатурация, для которой необходима энергия гидролиза АТФ, однако сам процесс транслокации не нуждается в дополнительном источнике энергии[25][26]. Протеасома может разрушать денатурированные белки даже в присутствии негидролизуемого аналога АТФ, но не белки в нативной форме, что свидетельствует о необходимости энергии АТФ только для процесса денатурации[25]. Проход денатурированного субстрата сквозь ворота идёт по типу облегчённой диффузии, если при этом АТФазные субъединицы 19S-частицы связаны с АТФ[54].
Денатурация глобулярных белков в целом протекает по одному и тому же механизму, хотя некоторые его реакции зависят от аминокислотного состава субстрата. Длинные участки, состоящие из повторяющихся остатков глицина и аланина, подавляют денатурацию, что снижает эффективность протеасомного разрушения, вероятно, из-за того, что гидролиз АТФ и денатурация оказываются разобщены[55]. Результатом такого неполного разрушения являются частично разрушенные белки. Повторы глицина и аланина встречаются в природных белках, например, в фиброине шёлка. Кроме того, они имеются у некоторых белков вируса Эпштейна — Барр и нарушают работу протеасом, благодаря чему нарушается презентация антигенов на главном комплексе гистосовместимости и, следовательно, облегчается размножение вируса[56].
Протеолиз[править | править код]
Протеолиз субстрата β-субъединицами 20S-частицы происходит по типу треонинзависимой нуклеофильной атаки. Для депротонирования активной гидроксильной группы треонина может быть необходима вода. Деградация происходит в центральной полости протеасомы, которая образуется при взаимодействии двух β-колец и в норме не выпускает наружу частично разрушенные белки, разрушая субстрат до пептидов из 7—9 остатков (хотя их длина может варьировать от 4 до 25 остатков в зависимости от организма и субстрата). Чем определяется длина пептидов, образующихся при протеолизе в протеасоме, неизвестно[57]. Хотя три β-субъединицы используют один и тот же механизм для деградации белков, они обладают слегка различающейся субстратной специфичностью, из-за чего их подразделяют на трипсин-подобные, химотрипсин-подобные и пептидил-глутамил-подобные. Специфичность обусловлена взаимодействиями атомов соседних аминокислотных остатков вблизи активного центра. Кроме того, каждая каталитическая β-субъединица содержит консервативный остаток лизина, необходимый для протеолиза[20].
Хотя в норме протеасома высвобождает очень короткие пептиды, иногда продукты протеасомного разрушения сами по себе являются биологически активными функциональными молекулами. Некоторые транскрипционные факторы, в числе которых компонент комплекса NF-κB млекопитающих, синтезируются в виде неактивных предшественников, которые становятся активными после убиквитинирования и протеасомной деградации. Для подобной активации разрыв пептидных связей должен происходить не на концах молекулы, а в её средней части. Было высказано предположение, что собственно субстратом для протеасомы являются длинные петли этих белков, при этом большая часть белковой молекулы не попадает внутрь протеасомы[58]. Похожий механизм активации был выявлен и у дрожжей. Он получил название убиквитин-протеасомо-зависимого процессинга[59].
Убиквитин-независимое разрушение[править | править код]
Хотя в большинстве случаев субстраты протеасом должны быть полиубиквитинированы, из этого правила известно несколько исключений, в частности, в тех случаях, когда протеасома участвует в нормальном посттрансляционном процессинге белка. Субъединица комплекса NF-κB млекопитающих p105 должна быть разрушена до p50, который и входит в состав активного комплекса[58]. Некоторые нестабильные белки, содержащие длинные неуложенные участки, также, вероятно, разрушаются протеасомами без убиквитиновых цепочек[60]. Наиболее изученным убиквитин-независимым субстратом протеасомы является орнитиндекарбоксилаза[61]. Убиквитин-независимому разрушению могут подвергаться некоторые регуляторы клеточного цикла[62]. Наконец, белки с ненормальной структурой или сильно окисленные белки в условиях клеточного стресса разрушаются протеасомами независимо от частицы 19S и убиквитина[63].
Эволюция[править | править код]

20S-протеасома есть у всех эукариот и необходима для жизнедеятельности эукариотической клетки. У ряда прокариот, в числе которых многие археи и бактерии порядка Actinomycetales, имеются гомологи 20S-протеасомы. У большинства же бактерий есть гены теплового шока hslV и hslU, белковые продукты которых формируют мультимерную протеазу, состоящую из двух колец[64]. Было высказано предположение, что белок hslV, возможно, похож на предка 20S-протеасомы[65]. Как правило, hslV не является строго необходимым для бактериальной клетки и обнаруживается не у всех бактерий, однако у некоторых протистов есть и 20S-протеасома, и hslV. У многих бактерий выявляются другие гомологи протеасомы и связанной АТФазы, например, ClpP и ClpX. Многообразием гомологов протеасомы можно объяснить то, что система HslUV не является строго необходимой для бактериальных клеток[64].
Анализ последовательностей показал, что каталитические β-субъединицы в ходе эволюции обособились раньше, чем α-субъединицы, играющие преимущественно структурную роль. У бактерий, имеющих 20S-протеасому, последовательности β-субъединиц очень похожи на таковые у архей и эукариот, а последовательности α-субъединиц схожи в гораздо меньшей степени. Бактерии могли получить 20S-протеасому посредством горизонтального переноса генов, а диверсификация субъединиц протеасомы у эукариот есть следствие множественных дупликаций генов[64].
Клеточные функции[править | править код]
Клеточный цикл находится под контролем циклинзависимых киназ (CDK), которые активируются белками циклинами. Митотические циклины существуют всего несколько минут и являются одними из самых короткоживущих клеточных белков. После того как комплекс циклина с CDK выполнит свою функцию, циклин полиубиквитинируется и разрушается протеасомой, из-за чего соответствующая ему CDK становится неактивной, и наступает следующая фаза клеточного цикла. В частности, для выхода из митоза необходимо протеасомное разрушение циклина B[66]. При прохождении через контрольную точку клеточного цикла, известную как точка рестрикции и находящуюся между G1-фазой и S-фазой, происходит протеасомное разрушение циклина А, причём его убиквитинирование осуществляет комплекс стимуляции анафазы (APC), который представляет собой Е3-убиквитинлигазу[67]. APC и комплекс SCF — два ключевых фактора деградации циклинов. Более того, сам комплекс SCF регулируется APC через убиквитинирование адаптерного белка Skp2, который подавляет активность SCF до перехода из G1-фазы в S-фазу[68].
Отдельные компоненты 19S-частицы имеют свои собственные клеточные функции. Так, один из компонентов 19S-частицы, известный как ганкирин, является онкопротеином, который прочно связывается с циклинзависимой киназой 4 (CDK4) и, взаимодействуя с убиквитинлигазой MDM2, играет важнейшую роль в распознавании убиквитинированного p53. Ганкирин подавляет апоптоз и сверхэкспрессируется в некоторых видах раковых опухолей, например, гепатоцеллюлярной карциноме[69].
У растений фитогормоны ауксины стимулируют протеасомное разрушение Aux/IAA — репрессоров транскрипционных факторов. Эти белки убиквитинируются SCFTIR1 — комплексом SCF с рецептором ауксина TIR1. В результате разрушения Aux/IAA происходит дерепрессия транскрипционных факторов семейства факторов ответа на ауксин (ARF), из-за чего активируется экспрессия подконтрольных им генов[70]. Клеточные эффекты активации ARF зависят от стадии развития растения, однако чаще всего они регулируют направление роста корней и жилок листа. Специфичность ответа на дерепрессию ARF, вероятно, обеспечивает чёткое соответствие между определёнными белками семейств Aux/IAA и ARF[71].
Протеасомы играют важную роль в протекании апоптоза, стимулируя убиквитинирование белков, хотя ведущая роль в разрушении белков при апоптозе принадлежит каспазам[72][73][74]. При апоптозе протеасомы, находящиеся в ядре погибающей клетки, перемещаются в состав так называемых блебов, отшнуровывающихся от клеточной мембраны (блеббинг мембраны является характерной чертой апоптоза)[75]. В клетках разных видов ингибирование протеасом оказывает разное воздействие на апоптоз. В большинстве случаев протеасомы не строго необходимы для апоптоза, хотя у большинства клеток ингибирование протеасом запускает апоптоз. Важную роль в запуске апоптоза играет нарушение работы слаженной системы деградации белков, стимулирующих пролиферацию и деление клеток[76]. Однако клетки некоторых типов, например, дифференцированные клетки в G0-фазе, такие как тимоциты и нейроны, под действием ингибиторов протеасом не уходят в апоптоз. Механизм этого эффекта не ясен, но, вероятно, специфичен для покоящихся клеток или обусловлен дифференциальной активностью проапоптотической киназы JNK[77]. Способность ингибиторов протеасом запускать апоптоз в быстро делящихся клетках используется в некоторых недавно разработанных препаратах противораковой химиотерапии, таких как бортезомиб и салиноспорамид А.
В условиях клеточного стресса, таких как инфекция, тепловой шок, окислительные повреждения, экспрессируются белки теплового шока, которые распознают неправильно уложенные или денатурированные белки и направляют их на протеасомное разрушение. Было показано, что шапероны Hsp27 и Hsp90 задействованы в повышении активности убиквитин-протеасомной системы, хотя они не принимают непосредственного участия в этом процессе[78]. Ещё один шаперон, Hsp70, связывается с выставленными наружу гидрофобными участками неуложенных белков (в норме такие участки обращены внутрь молекулы) и привлекает убиквитинлигазы вроде CHIP, которые направляют белки на деградацию в протеасомах[79]. Схожие механизмы направляют на разрушение окисленные белки. Например, ядерные протеасомы регулируются поли(АДФ-рибоза)-полимеразами (PARP) и активно разрушают окисленные гистоны[80]. Окисленные белки часто формируют большие аморфные скопления внутри клетки, и 20S-частица способна разрушать их без 19S-частицы, независимо от гидролиза АТФ и убиквитина[63]. Однако сильные окислительные повреждения повышают риск перекрёстного соединения фрагментов белков, из-за чего они становятся устойчивыми к протеолизу. Большие по размеру и количеству скопления окисленных белков связаны со старением[81].
Роль в иммунной системе[править | править код]
Протеасомы играют важнейшую роль в функционировании адаптивного иммунитета. В протеасомах антигенпрезентирующих клеток белки вторгнувшегося в организм патогена разрушаются до пептидов, которые экспонируются наружу молекулами главного комплекса гистосовместимости I класса (MHCI). В этом процессе могут принимать участие как обычные, постоянно экспрессирующиеся протеасомы, так и специализированные иммунопротеасомы. Их экспрессия запускается интерфероном γ, и образуемые ими пептиды имеют идеальные размер и состав для экспонирования MHC. Во время иммунного ответа повышается экспрессия регуляторной субъединицы 11S, которая регулирует образование лигандов MHC, а также специализированных β-субъединиц β1i, β2i и β5i, имеющих слегка изменённую субстратную специфичность. Иммунопротеасомы — это протеасомы, содержащие такие специализированные β-субъединицы[16]. В тимусе экспрессируется другой вариант субъединицы β5i — β5t, что приводит к образованию специфичных для тимуса тимопротеасом, функции которых неясны[82].
Сила связывания лиганда MHCI зависит от аминокислотного состава C-конца белка-лиганда, так как именно его C-конец посредством водородных связей связывается с особым участком на поверхности MHCI, который называется B-карманом. Многие аллели MHCI наиболее хорошо связываются с гидрофобными C-концами, и пептиды, образуемые иммунопротеасомами, как правило, имеют гидрофобные C-концы[83].
Так как протеасомы задействованы в активации NF-κB — антиапоптотического и провоспалительного регулятора экспрессии цитокинов, они играют роль в развитии воспалительных и аутоиммунных заболеваний. Повышенный уровень экспрессии протеасом связан с выраженностью заболевания и наблюдается при таких аутоиммунных заболеваниях, как системная красная волчанка и ревматоидный артрит[16].
Протеасомы принимают участие во внутриклеточном протеолизе, опосредованном антителами, которому подвергаются связанные с антителами вирусные частицы (вирионы). Белок TRIM21 связывается с иммуноглобулином G и направляет вирион на протеасомное разрушение[84].
Ингибиторы протеасом[править | править код]
Ингибиторы протеасом демонстрируют выраженную противоопухолевую активность в культурах клеток, вызывая апоптоз нарушением деградации белков. Благодаря селективному проапоптотическому действию на раковые клетки ингибиторы протеасом прошли успешные клинические испытания на животных и людях[76].
Первым идентифицированным ингибитором протеасом непептидной природы стал лактацистин, синтезируемый бактериями рода Streptomyces. Лицензией на лактацистин обладает компания Takeda Pharmaceutical. Он нашёл широкое применение в исследовательской работе в области биохимии и клеточной биологии. Лактацистин ковалентно модифицирует N-концевые остатки треонина β-субъединиц, особенно субъединицы β5, которая обладает химотрипсин-подобной активностью. Благодаря лактацистину удалось установить, что протеасома является аминоконцевой треониновой протеазой (первой представительницей нового класса протеаз)[85].
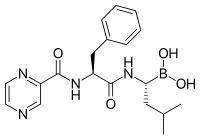
Бортезомиб (торговое название Велкад), разработанный компанией Millennium Pharmaceuticals, стал первым ингибитором протеасом, который начал использоваться в противораковой химиотерапии[86]. Его используют для лечения множественной миеломы[87]. При множественной миеломе в плазме крови выявляется высокий уровень пептидов протеасомного происхождения, который снижается до нормального при лечении бортезомибом[88]. Исследования на животных показали, что бортезомиб может быть эффективен при раке поджелудочной железы[89][90]. С начала XXI века проводятся доклинические и клинические испытания эффективности бортезомиба при лечении других видов рака B-клеточного происхождения[91], в частности, некоторых неходжкинских лимфом[92]. Клинические испытания показали эффективность бортезомиба в сочетании со стандартной химиотерапией в борьбе с B-клеточной острой лимфобластной лейкемией[93]. Ингибиторы протеасом в условиях культуры клеток убивают клетки некоторых лейкемий, которые устойчивы к глюкокортикоидам[94].
Препарат ритонавир (торговое название Норвир) был разработан как ингибитор протеаз для лечения ВИЧ-инфекции. Однако оказалось, что он подавляет не только свободные протеазы, но и протеасомы — точнее, блокирует химотрипсиноподобную активность протеасомы, при этом немного повышая трипсиноподобную активность[95]. Исследования на животных показали, что ритонавир может подавлять рост клеток глиомы[96].
Как показали эксперименты на животных моделях, ингибиторы протеасом могут быть эффективны при лечении аутоиммунных расстройств. Изучение мышей с пересаженной человеческой кожей показало, что под действием ингибиторов протеаз размер язв, вызванных псориазом, уменьшался[97]. Ингибиторы протеаз также оказались эффективны против астмы на животных моделях[98].
Мечение и подавление протеасом имеет важное значение для изучения работы протеасом как in vitro, так и in vivo. Чаще всего в исследовательской практике применяют такие ингибиторы протеасом, как лактацистин и пептидный альдегид MG132. Для мечения активных сайтов протеасом были разработаны специфические флуоресцентные ингибиторы[99].
Клиническое значение[править | править код]
Протеасомы и их субъединицы важны для медицины не только как молекулярная основа многих заболеваний, но и как перспективная мишень для многих лекарственных препаратов. Возможно, протеасомы могут быть использованы в качестве биомаркеров (в частности, биомаркеров некоторых аутоиммунных заболеваний[100]). Нарушения в работе протеасом были выявлены при нейродегенеративных[101][102], сердечно-сосудистых[103][104][105], воспалительных и аутоиммунных заболеваниях[106], а также многих видах рака[107]. Также они могут быть связаны с опухолями мозга, например, астроцитомами[108].
Несколько экспериментальных и клинических исследований указали на связь дисфункции протеасом с многими нейро- и миодегенеративными заболеваниями, в числе которых болезнь Альцгеймера[109], болезнь Паркинсона[110], болезнь Пика[111], боковой амиотрофический склероз и другие заболевания моторных нейронов[111], болезнь Гентингтона[110], болезнь Крейтцфельдта — Якоба[112], несколько редких нейродегенеративных заболеваний, связанных с деменцией[113], полиглутаминовые заболевания, мышечные дистрофии[114] и миопатия телец включения[108]. При дисфункции протеасом в нервной ткани образуются большие нерастворимые скопления неуложенных белков, что часто наблюдается при нейродегенеративных заболеваниях (например, при болезни Паркинсона образуются так называемые тельца Леви[115]). Однако молекулярные основы нейротоксичности белковых скоплений неясны. Исследования на дрожжах показали, что клетки наиболее чувствительны к токсическому действию α-синуклеина (главного белка телец Леви) в условиях ингибирования протеасом[116]. Неправильная работа протеасом может лежать в основе таких когнитивных проблем, как расстройства аутистического спектра[108].
Нарушения, касающиеся функционирования протеасом, связаны с ишемической болезнью сердца[117], гипертрофией желудочков[118] и инфарктом миокарда[119]. Так как протеасомы связаны с ответом клеток на стимулирующие сигналы, их дисфункции могут приводить к раку. Под контролем протеасом находится численность множества белков, связанных с развитием рака: p53, c-Jun, c-Fos, NF-κB, c-Myc, HIF-1α, MATα2, STAT3 и другие[120]. Протеасомы разрушают многие белки, функционирующие как супрессоры опухолей, например, adenomatous polyposis coli и VHL, а также некоторые протоонкогены (Raf, Myc, Myb, Rel, Src, Mos, Abl). Регулируя активацию NF-κB, который активирует экспрессию провоспалительных цитокинов, простагландинов и оксида азота (NO), протеасомы вовлечены в регуляцию воспаления[106]. Влияя на разрушение циклинов и ингибиторов циклин-зависимых киназ, протеасомы выступают как регуляторы пролиферации лейкоцитов при воспалении[121].
Примечания[править | править код]
- ↑ 1 2 3 Lodish H., Berk A., Matsudaira P., Kaiser C. A., Krieger M., Scott M. P., Zipursky S. L., Darnell J. 3 // Molecular cell biology (неопр.). — 5th. — N. Y.: W.H. Freeman and CO, 2004. — С. 66—72. — ISBN 0-7167-4366-3.
- ↑ 1 2 3 4 5 6 Сорокин А. В., Ким Е. Р., Овчинников Л. П. Протеасомная система деградации и процессинга белков // Успехи биологической химии : журнал. — 2009. — Т. 49. — С. 3—76.
- ↑ Peters J. M., Franke W. W., Kleinschmidt J. A. Distinct 19 S and 20 S subcomplexes of the 26 S proteasome and their distribution in the nucleus and the cytoplasm. (англ.) // The Journal Of Biological Chemistry. — 1994. — 11 March (vol. 269, no. 10). — P. 7709—7718. — PMID 8125997.
- ↑ Nassif N. D., Cambray S. E., Kraut D. A. Slipping up: partial substrate degradation by ATP-dependent proteases. (англ.) // IUBMB Life. — 2014. — May (vol. 66, no. 5). — P. 309—317. — doi:10.1002/iub.1271. — PMID 24823973.
- ↑ Kaya H. E. K. & Radhakrishnan S. K. (2020). Trash Talk: Mammalian Proteasome Regulation at the Transcriptional Level. Trends in Genetics. 37 (2), 160—173 PMID 32988635 PMC 7856062 doi:10.1016/j.tig.2020.09.005
- ↑ Nobel Prize Committee. Nobel Prize Awardees in Chemistry, 2004 (2004). Дата обращения: 11 декабря 2006. Архивировано 5 июня 2012 года.
- ↑ Etlinger J. D., Goldberg A. L. A soluble ATP-dependent proteolytic system responsible for the degradation of abnormal proteins in reticulocytes. (англ.) // Proceedings Of The National Academy Of Sciences Of The United States Of America. — 1977. — January (vol. 74, no. 1). — P. 54—58. — PMID 264694.
- ↑ Ciehanover A., Hod Y., Hershko A. A heat-stable polypeptide component of an ATP-dependent proteolytic system from reticulocytes. (англ.) // Biochemical And Biophysical Research Communications. — 1978. — 28 April (vol. 81, no. 4). — P. 1100—1105. — PMID 666810.
- ↑ Goldknopf I. L., Busch H. Isopeptide linkage between nonhistone and histone 2A polypeptides of chromosomal conjugate-protein A24. (англ.) // Proceedings Of The National Academy Of Sciences Of The United States Of America. — 1977. — March (vol. 74, no. 3). — P. 864—868. — PMID 265581.
- ↑ Ciechanover A. Early work on the ubiquitin proteasome system, an interview with Aaron Ciechanover. Interview by CDD. (англ.) // Cell Death And Differentiation. — 2005. — September (vol. 12, no. 9). — P. 1167—1177. — doi:10.1038/sj.cdd.4401691. — PMID 16094393.
- ↑ Tanaka K., Waxman L., Goldberg A. L. ATP serves two distinct roles in protein degradation in reticulocytes, one requiring and one independent of ubiquitin. (англ.) // The Journal Of Cell Biology. — 1983. — June (vol. 96, no. 6). — P. 1580—1585. — PMID 6304111.
- ↑ Hough R., Pratt G., Rechsteiner M. Purification of two high molecular weight proteases from rabbit reticulocyte lysate. (англ.) // The Journal Of Biological Chemistry. — 1987. — 15 June (vol. 262, no. 17). — P. 8303—8313. — PMID 3298229.
- ↑ Hershko A. Early work on the ubiquitin proteasome system, an interview with Avram Hershko. Interview by CDD. (англ.) // Cell Death And Differentiation. — 2005. — September (vol. 12, no. 9). — P. 1158—1161. — doi:10.1038/sj.cdd.4401709. — PMID 16094391.
- ↑ Kopp F., Steiner R., Dahlmann B., Kuehn L., Reinauer H. Size and shape of the multicatalytic proteinase from rat skeletal muscle. (англ.) // Biochimica Et Biophysica Acta. — 1986. — 15 August (vol. 872, no. 3). — P. 253—260. — PMID 3524688.
- ↑ Löwe J., Stock D., Jap B., Zwickl P., Baumeister W., Huber R. Crystal structure of the 20S proteasome from the archaeon T. acidophilum at 3.4 A resolution. (англ.) // Science (New York, N.Y.). — 1995. — 28 April (vol. 268, no. 5210). — P. 533—539. — PMID 7725097.
- ↑ 1 2 3 4 Wang J., Maldonado M. A. The ubiquitin-proteasome system and its role in inflammatory and autoimmune diseases. (англ.) // Cellular & Molecular Immunology. — 2006. — August (vol. 3, no. 4). — P. 255—261. — PMID 16978533.
- ↑ Должно быть произведено разворачивание субстрата.
- ↑ 1 2 Nandi D., Tahiliani P., Kumar A., Chandu D. The ubiquitin-proteasome system. (англ.) // Journal of biosciences. — 2006. — Vol. 31, no. 1. — P. 137—155. — PMID 16595883.
- ↑ Smith D. M., Chang S. C., Park S., Finley D., Cheng Y., Goldberg A. L. Docking of the proteasomal ATPases' carboxyl termini in the 20S proteasome's alpha ring opens the gate for substrate entry. (англ.) // Molecular Cell. — 2007. — 7 September (vol. 27, no. 5). — P. 731—744. — doi:10.1016/j.molcel.2007.06.033. — PMID 17803938.
- ↑ 1 2 Heinemeyer W., Fischer M., Krimmer T., Stachon U., Wolf D. H. The active sites of the eukaryotic 20 S proteasome and their involvement in subunit precursor processing. (англ.) // The Journal Of Biological Chemistry. — 1997. — 3 October (vol. 272, no. 40). — P. 25200—25209. — PMID 9312134.
- ↑ 1 2 Padmanabhan A., Vuong S. A., Hochstrasser M. Assembly of an Evolutionarily Conserved Alternative Proteasome Isoform in Human Cells. (англ.) // Cell Reports. — 2016. — 29 March (vol. 14, no. 12). — P. 2962—2974. — doi:10.1016/j.celrep.2016.02.068. — PMID 26997268.
- ↑ Velichutina I., Connerly P. L., Arendt C. S., Li X., Hochstrasser M. Plasticity in eucaryotic 20S proteasome ring assembly revealed by a subunit deletion in yeast. (англ.) // The EMBO Journal. — 2004. — 11 February (vol. 23, no. 3). — P. 500—510. — doi:10.1038/sj.emboj.7600059. — PMID 14739934.
- ↑ Kusmierczyk A. R., Kunjappu M. J., Funakoshi M., Hochstrasser M. A multimeric assembly factor controls the formation of alternative 20S proteasomes. (англ.) // Nature Structural & Molecular Biology. — 2008. — March (vol. 15, no. 3). — P. 237—244. — doi:10.1038/nsmb.1389. — PMID 18278055.
- ↑ Zwickl P., Ng D., Woo K. M., Klenk H. P., Goldberg A. L. An archaebacterial ATPase, homologous to ATPases in the eukaryotic 26 S proteasome, activates protein breakdown by 20 S proteasomes. (англ.) // The Journal Of Biological Chemistry. — 1999. — 10 September (vol. 274, no. 37). — P. 26008—26014. — PMID 10473546.
- ↑ 1 2 3 4 Smith D. M., Kafri G., Cheng Y., Ng D., Walz T., Goldberg A. L. ATP binding to PAN or the 26S ATPases causes association with the 20S proteasome, gate opening, and translocation of unfolded proteins. (англ.) // Molecular Cell. — 2005. — 9 December (vol. 20, no. 5). — P. 687—698. — doi:10.1016/j.molcel.2005.10.019. — PMID 16337593.
- ↑ 1 2 3 4 5 Liu C. W., Li X., Thompson D., Wooding K., Chang T. L., Tang Z., Yu H., Thomas P. J., DeMartino G. N. ATP binding and ATP hydrolysis play distinct roles in the function of 26S proteasome. (англ.) // Molecular Cell. — 2006. — 6 October (vol. 24, no. 1). — P. 39—50. — doi:10.1016/j.molcel.2006.08.025. — PMID 17018291.
- ↑ Lam Y. A., Lawson T. G., Velayutham M., Zweier J. L., Pickart C. M. A proteasomal ATPase subunit recognizes the polyubiquitin degradation signal. (англ.) // Nature. — 2002. — 18 April (vol. 416, no. 6882). — P. 763—767. — doi:10.1038/416763a. — PMID 11961560.
- ↑ 1 2 Lander G. C., Estrin E., Matyskiela M. E., Bashore C., Nogales E., Martin A. Complete subunit architecture of the proteasome regulatory particle. (англ.) // Nature. — 2012. — 11 January (vol. 482, no. 7384). — P. 186—191. — doi:10.1038/nature10774. — PMID 22237024.
- ↑ Lasker K., Förster F., Bohn S., Walzthoeni T., Villa E., Unverdorben P., Beck F., Aebersold R., Sali A., Baumeister W. Molecular architecture of the 26S proteasome holocomplex determined by an integrative approach. (англ.) // Proceedings Of The National Academy Of Sciences Of The United States Of America. — 2012. — 31 January (vol. 109, no. 5). — P. 1380—1387. — doi:10.1073/pnas.1120559109. — PMID 22307589.
- ↑ 1 2 Beck F., Unverdorben P., Bohn S., Schweitzer A., Pfeifer G., Sakata E., Nickell S., Plitzko J. M., Villa E., Baumeister W., Förster F. Near-atomic resolution structural model of the yeast 26S proteasome. (англ.) // Proceedings Of The National Academy Of Sciences Of The United States Of America. — 2012. — 11 September (vol. 109, no. 37). — P. 14870—14875. — doi:10.1073/pnas.1213333109. — PMID 22927375.
- ↑ Unverdorben P., Beck F., Śledź P., Schweitzer A., Pfeifer G., Plitzko J. M., Baumeister W., Förster F. Deep classification of a large cryo-EM dataset defines the conformational landscape of the 26S proteasome. (англ.) // Proceedings Of The National Academy Of Sciences Of The United States Of America. — 2014. — 15 April (vol. 111, no. 15). — P. 5544—5549. — doi:10.1073/pnas.1403409111. — PMID 24706844.
- ↑ Śledź P., Unverdorben P., Beck F., Pfeifer G., Schweitzer A., Förster F., Baumeister W. Structure of the 26S proteasome with ATP-γS bound provides insights into the mechanism of nucleotide-dependent substrate translocation. (англ.) // Proceedings Of The National Academy Of Sciences Of The United States Of America. — 2013. — 30 April (vol. 110, no. 18). — P. 7264—7269. — doi:10.1073/pnas.1305782110. — PMID 23589842.
- ↑ Matyskiela M. E., Lander G. C., Martin A. Conformational switching of the 26S proteasome enables substrate degradation. (англ.) // Nature Structural & Molecular Biology. — 2013. — July (vol. 20, no. 7). — P. 781—788. — doi:10.1038/nsmb.2616. — PMID 23770819.
- ↑ Köhler A., Cascio P., Leggett D. S., Woo K. M., Goldberg A. L., Finley D. The axial channel of the proteasome core particle is gated by the Rpt2 ATPase and controls both substrate entry and product release. (англ.) // Molecular Cell. — 2001. — June (vol. 7, no. 6). — P. 1143—1152. — PMID 11430818.
- ↑ Rabl J., Smith D. M., Yu Y., Chang S. C., Goldberg A. L., Cheng Y. Mechanism of gate opening in the 20S proteasome by the proteasomal ATPases. (англ.) // Molecular Cell. — 2008. — 9 May (vol. 30, no. 3). — P. 360—368. — doi:10.1016/j.molcel.2008.03.004. — PMID 18471981.
- ↑ Förster A., Masters E. I., Whitby F. G., Robinson H., Hill C. P. The 1.9 A structure of a proteasome-11S activator complex and implications for proteasome-PAN/PA700 interactions. (англ.) // Molecular Cell. — 2005. — 27 May (vol. 18, no. 5). — P. 589—599. — doi:10.1016/j.molcel.2005.04.016. — PMID 15916965.
- ↑ Witt S., Kwon Y. D., Sharon M., Felderer K., Beuttler M., Robinson C. V., Baumeister W., Jap B. K. Proteasome assembly triggers a switch required for active-site maturation. (англ.) // Structure (London, England : 1993). — 2006. — July (vol. 14, no. 7). — P. 1179—1188. — doi:10.1016/j.str.2006.05.019. — PMID 16843899.
- ↑ Krüger E., Kloetzel P. M., Enenkel C. 20S proteasome biogenesis. (англ.) // Biochimie. — 2001. — March (vol. 83, no. 3-4). — P. 289—293. — PMID 11295488.
- ↑ Murata S., Yashiroda H., Tanaka K. Molecular mechanisms of proteasome assembly. (англ.) // Nature Reviews. Molecular Cell Biology. — 2009. — February (vol. 10, no. 2). — P. 104—115. — doi:10.1038/nrm2630. — PMID 19165213.
- ↑ Sakata E., Stengel F., Fukunaga K., Zhou M., Saeki Y., Förster F., Baumeister W., Tanaka K., Robinson C. V. The catalytic activity of Ubp6 enhances maturation of the proteasomal regulatory particle. (англ.) // Molecular Cell. — 2011. — 10 June (vol. 42, no. 5). — P. 637—649. — doi:10.1016/j.molcel.2011.04.021. — PMID 21658604.
- ↑ Fukunaga K., Kudo T., Toh-e A., Tanaka K., Saeki Y. Dissection of the assembly pathway of the proteasome lid in Saccharomyces cerevisiae. (англ.) // Biochemical And Biophysical Research Communications. — 2010. — 11 June (vol. 396, no. 4). — P. 1048—1053. — doi:10.1016/j.bbrc.2010.05.061. — PMID 20471955.
- ↑ Haas A. L., Warms J. V., Hershko A., Rose I. A. Ubiquitin-activating enzyme. Mechanism and role in protein-ubiquitin conjugation. (англ.) // The Journal Of Biological Chemistry. — 1982. — 10 March (vol. 257, no. 5). — P. 2543—2548. — PMID 6277905.
- ↑ Risseeuw E. P., Daskalchuk T. E., Banks T. W., Liu E., Cotelesage J., Hellmann H., Estelle M., Somers D. E., Crosby W. L. Protein interaction analysis of SCF ubiquitin E3 ligase subunits from Arabidopsis. (англ.) // The Plant Journal : For Cell And Molecular Biology. — 2003. — June (vol. 34, no. 6). — P. 753—767. — PMID 12795696.
- ↑ Thrower J. S., Hoffman L., Rechsteiner M., Pickart C. M. Recognition of the polyubiquitin proteolytic signal. (англ.) // The EMBO Journal. — 2000. — 4 January (vol. 19, no. 1). — P. 94—102. — doi:10.1093/emboj/19.1.94. — PMID 10619848.
- ↑ Elsasser S., Finley D. Delivery of ubiquitinated substrates to protein-unfolding machines. (англ.) // Nature Cell Biology. — 2005. — August (vol. 7, no. 8). — P. 742—749. — doi:10.1038/ncb0805-742. — PMID 16056265.
- ↑ Sadanandom A., Bailey M., Ewan R., Lee J., Nelis S. The ubiquitin-proteasome system: central modifier of plant signalling. (англ.) // The New Phytologist. — 2012. — October (vol. 196, no. 1). — P. 13—28. — doi:10.1111/j.1469-8137.2012.04266.x. — PMID 22897362.
- ↑ Sharp P. M., Li W. H. Ubiquitin genes as a paradigm of concerted evolution of tandem repeats. (англ.) // Journal Of Molecular Evolution. — 1987. — Vol. 25, no. 1. — P. 58—64. — PMID 3041010.
- ↑ Pickart C. M., Fushman D. Polyubiquitin chains: polymeric protein signals. (англ.) // Current Opinion In Chemical Biology. — 2004. — December (vol. 8, no. 6). — P. 610—616. — doi:10.1016/j.cbpa.2004.09.009. — PMID 15556404.
- ↑ Pickart C. M. Ubiquitin in chains. (англ.) // Trends In Biochemical Sciences. — 2000. — November (vol. 25, no. 11). — P. 544—548. — PMID 11084366.
- ↑ Zhu Q., Wani G., Wang Q. E., El-mahdy M., Snapka R. M., Wani A. A. Deubiquitination by proteasome is coordinated with substrate translocation for proteolysis in vivo. (англ.) // Experimental Cell Research. — 2005. — 15 July (vol. 307, no. 2). — P. 436—451. — doi:10.1016/j.yexcr.2005.03.031. — PMID 15950624.
- ↑ Wenzel T., Baumeister W. Conformational constraints in protein degradation by the 20S proteasome. (англ.) // Nature Structural Biology. — 1995. — March (vol. 2, no. 3). — P. 199—204. — PMID 7773788.
- ↑ Inobe T., Fishbain S., Prakash S., Matouschek A. Defining the geometry of the two-component proteasome degron. (англ.) // Nature Chemical Biology. — 2011. — March (vol. 7, no. 3). — P. 161—167. — doi:10.1038/nchembio.521. — PMID 21278740.
- ↑ van der Lee R., Lang B., Kruse K., Gsponer J., Sánchez de Groot N., Huynen M. A., Matouschek A., Fuxreiter M., Babu M. M. Intrinsically disordered segments affect protein half-life in the cell and during evolution. (англ.) // Cell Reports. — 2014. — 25 September (vol. 8, no. 6). — P. 1832—1844. — doi:10.1016/j.celrep.2014.07.055. — PMID 25220455.
- ↑ Smith D. M., Benaroudj N., Goldberg A. Proteasomes and their associated ATPases: a destructive combination. (англ.) // Journal Of Structural Biology. — 2006. — October (vol. 156, no. 1). — P. 72—83. — doi:10.1016/j.jsb.2006.04.012. — PMID 16919475.
- ↑ Hoyt M. A., Zich J., Takeuchi J., Zhang M., Govaerts C., Coffino P. Glycine-alanine repeats impair proper substrate unfolding by the proteasome. (англ.) // The EMBO Journal. — 2006. — 19 April (vol. 25, no. 8). — P. 1720—1729. — doi:10.1038/sj.emboj.7601058. — PMID 16601692.
- ↑ Zhang M., Coffino P. Repeat sequence of Epstein-Barr virus-encoded nuclear antigen 1 protein interrupts proteasome substrate processing. (англ.) // The Journal Of Biological Chemistry. — 2004. — 5 March (vol. 279, no. 10). — P. 8635—8641. — doi:10.1074/jbc.M310449200. — PMID 14688254.
- ↑ Voges D., Zwickl P., Baumeister W. The 26S proteasome: a molecular machine designed for controlled proteolysis. (англ.) // Annual Review Of Biochemistry. — 1999. — Vol. 68. — P. 1015—1068. — doi:10.1146/annurev.biochem.68.1.1015. — PMID 10872471.
- ↑ 1 2 Rape M., Jentsch S. Taking a bite: proteasomal protein processing. (англ.) // Nature Cell Biology. — 2002. — May (vol. 4, no. 5). — P. 113—116. — doi:10.1038/ncb0502-e113. — PMID 11988749.
- ↑ Rape M., Jentsch S. Productive RUPture: activation of transcription factors by proteasomal processing. (англ.) // Biochimica Et Biophysica Acta. — 2004. — 29 November (vol. 1695, no. 1-3). — P. 209—213. — doi:10.1016/j.bbamcr.2004.09.022. — PMID 15571816.
- ↑ Asher G., Reuven N., Shaul Y. 20S proteasomes and protein degradation "by default". (англ.) // BioEssays : News And Reviews In Molecular, Cellular And Developmental Biology. — 2006. — August (vol. 28, no. 8). — P. 844—849. — doi:10.1002/bies.20447. — PMID 16927316.
- ↑ Zhang M., Pickart C. M., Coffino P. Determinants of proteasome recognition of ornithine decarboxylase, a ubiquitin-independent substrate. (англ.) // The EMBO Journal. — 2003. — 1 April (vol. 22, no. 7). — P. 1488—1496. — doi:10.1093/emboj/cdg158. — PMID 12660156.
- ↑ Asher G., Shaul Y. p53 proteasomal degradation: poly-ubiquitination is not the whole story. (англ.) // Cell Cycle (Georgetown, Tex.). — 2005. — August (vol. 4, no. 8). — P. 1015—1018. — doi:10.4161/cc.4.8.1900. — PMID 16082197.
- ↑ 1 2 Shringarpure R., Grune T., Mehlhase J., Davies K. J. Ubiquitin conjugation is not required for the degradation of oxidized proteins by proteasome. (англ.) // The Journal Of Biological Chemistry. — 2003. — 3 January (vol. 278, no. 1). — P. 311—318. — doi:10.1074/jbc.M206279200. — PMID 12401807.
- ↑ 1 2 3 Gille C., Goede A., Schlöetelburg C., Preissner R., Kloetzel P. M., Göbel U. B., Frömmel C. A comprehensive view on proteasomal sequences: implications for the evolution of the proteasome. (англ.) // Journal Of Molecular Biology. — 2003. — 7 March (vol. 326, no. 5). — P. 1437—1448. — PMID 12595256.
- ↑ Bochtler M., Ditzel L., Groll M., Hartmann C., Huber R. The proteasome. (англ.) // Annual Review Of Biophysics And Biomolecular Structure. — 1999. — Vol. 28. — P. 295—317. — doi:10.1146/annurev.biophys.28.1.295. — PMID 10410804.
- ↑ Chesnel F., Bazile F., Pascal A., Kubiak J. Z. Cyclin B dissociation from CDK1 precedes its degradation upon MPF inactivation in mitotic extracts of Xenopus laevis embryos. (англ.) // Cell Cycle (Georgetown, Tex.). — 2006. — August (vol. 5, no. 15). — P. 1687—1698. — doi:10.4161/cc.5.15.3123. — PMID 16921258.
- ↑ Havens C. G., Ho A., Yoshioka N., Dowdy S. F. Regulation of late G1/S phase transition and APC Cdh1 by reactive oxygen species. (англ.) // Molecular And Cellular Biology. — 2006. — June (vol. 26, no. 12). — P. 4701—4711. — doi:10.1128/MCB.00303-06. — PMID 16738333.
- ↑ Bashir T., Dorrello N. V., Amador V., Guardavaccaro D., Pagano M. Control of the SCF(Skp2-Cks1) ubiquitin ligase by the APC/C(Cdh1) ubiquitin ligase. (англ.) // Nature. — 2004. — 11 March (vol. 428, no. 6979). — P. 190—193. — doi:10.1038/nature02330. — PMID 15014502.
- ↑ Higashitsuji H., Liu Y., Mayer R. J., Fujita J. The oncoprotein gankyrin negatively regulates both p53 and RB by enhancing proteasomal degradation. (англ.) // Cell Cycle (Georgetown, Tex.). — 2005. — October (vol. 4, no. 10). — P. 1335—1337. — doi:10.4161/cc.4.10.2107. — PMID 16177571.
- ↑ Dharmasiri S., Estelle M. The role of regulated protein degradation in auxin response. (англ.) // Plant Molecular Biology. — 2002. — June (vol. 49, no. 3-4). — P. 401—409. — PMID 12036263.
- ↑ Weijers D., Benkova E., Jäger K. E., Schlereth A., Hamann T., Kientz M., Wilmoth J. C., Reed J. W., Jürgens G. Developmental specificity of auxin response by pairs of ARF and Aux/IAA transcriptional regulators. (англ.) // The EMBO Journal. — 2005. — 18 May (vol. 24, no. 10). — P. 1874—1885. — doi:10.1038/sj.emboj.7600659. — PMID 15889151.
- ↑ Haas A. L., Baboshina O., Williams B., Schwartz L. M. Coordinated induction of the ubiquitin conjugation pathway accompanies the developmentally programmed death of insect skeletal muscle. (англ.) // The Journal Of Biological Chemistry. — 1995. — 21 April (vol. 270, no. 16). — P. 9407—9412. — PMID 7721865.
- ↑ Schwartz L. M., Myer A., Kosz L., Engelstein M., Maier C. Activation of polyubiquitin gene expression during developmentally programmed cell death. (англ.) // Neuron. — 1990. — October (vol. 5, no. 4). — P. 411—419. — PMID 2169771.
- ↑ Löw P., Bussell K., Dawson S. P., Billett M. A., Mayer R. J., Reynolds S. E. Expression of a 26S proteasome ATPase subunit, MS73, in muscles that undergo developmentally programmed cell death, and its control by ecdysteroid hormones in the insect Manduca sexta. (англ.) // FEBS Letters. — 1997. — 6 January (vol. 400, no. 3). — P. 345—349. — PMID 9009228.
- ↑ Pitzer F., Dantes A., Fuchs T., Baumeister W., Amsterdam A. Removal of proteasomes from the nucleus and their accumulation in apoptotic blebs during programmed cell death. (англ.) // FEBS Letters. — 1996. — 23 September (vol. 394, no. 1). — P. 47—50. — PMID 8925925.
- ↑ 1 2 Adams J., Palombella V. J., Sausville E. A., Johnson J., Destree A., Lazarus D. D., Maas J., Pien C. S., Prakash S., Elliott P. J. Proteasome inhibitors: a novel class of potent and effective antitumor agents. (англ.) // Cancer Research. — 1999. — 1 June (vol. 59, no. 11). — P. 2615—2622. — PMID 10363983.
- ↑ Orlowski R. Z. The role of the ubiquitin-proteasome pathway in apoptosis. (англ.) // Cell Death And Differentiation. — 1999. — April (vol. 6, no. 4). — P. 303—313. — doi:10.1038/sj.cdd.4400505. — PMID 10381632.
- ↑ Garrido C., Brunet M., Didelot C., Zermati Y., Schmitt E., Kroemer G. Heat shock proteins 27 and 70: anti-apoptotic proteins with tumorigenic properties. (англ.) // Cell Cycle (Georgetown, Tex.). — 2006. — November (vol. 5, no. 22). — P. 2592—2601. — doi:10.4161/cc.5.22.3448. — PMID 17106261.
- ↑ Park S. H., Bolender N., Eisele F., Kostova Z., Takeuchi J., Coffino P., Wolf D. H. The cytoplasmic Hsp70 chaperone machinery subjects misfolded and endoplasmic reticulum import-incompetent proteins to degradation via the ubiquitin-proteasome system. (англ.) // Molecular Biology Of The Cell. — 2007. — January (vol. 18, no. 1). — P. 153—165. — doi:10.1091/mbc.e06-04-0338. — PMID 17065559.
- ↑ Bader N., Grune T. Protein oxidation and proteolysis. (англ.) // Biological Chemistry. — 2006. — October (vol. 387, no. 10-11). — P. 1351—1355. — doi:10.1515/BC.2006.169. — PMID 17081106.
- ↑ Davies K. J. Degradation of oxidized proteins by the 20S proteasome. (англ.) // Biochimie. — 2001. — March (vol. 83, no. 3-4). — P. 301—310. — PMID 11295490.
- ↑ Murata S., Sasaki K., Kishimoto T., Niwa S., Hayashi H., Takahama Y., Tanaka K. Regulation of CD8+ T cell development by thymus-specific proteasomes. (англ.) // Science (New York, N.Y.). — 2007. — 1 June (vol. 316, no. 5829). — P. 1349—1353. — doi:10.1126/science.1141915. — PMID 17540904.
- ↑ Cascio P., Hilton C., Kisselev A. F., Rock K. L., Goldberg A. L. 26S proteasomes and immunoproteasomes produce mainly N-extended versions of an antigenic peptide. (англ.) // The EMBO Journal. — 2001. — 15 May (vol. 20, no. 10). — P. 2357—2366. — doi:10.1093/emboj/20.10.2357. — PMID 11350924.
- ↑ Mallery D. L., McEwan W. A., Bidgood S. R., Towers G. J., Johnson C. M., James L. C. Antibodies mediate intracellular immunity through tripartite motif-containing 21 (TRIM21). (англ.) // Proceedings Of The National Academy Of Sciences Of The United States Of America. — 2010. — 16 November (vol. 107, no. 46). — P. 19985—19990. — doi:10.1073/pnas.1014074107. — PMID 21045130.
- ↑ Fenteany G., Standaert R. F., Lane W. S., Choi S., Corey E. J., Schreiber S. L. Inhibition of proteasome activities and subunit-specific amino-terminal threonine modification by lactacystin. (англ.) // Science (New York, N.Y.). — 1995. — 5 May (vol. 268, no. 5211). — P. 726—731. — PMID 7732382.
- ↑ FDA Approves Velcade for Multiple Myeloma Treatment. U.S. Food and Drug Administration (13 мая 2003). Дата обращения: 23 ноября 2018. Архивировано 19 февраля 2007 года.
- ↑ Fisher R. I., Bernstein S. H., Kahl B. S., Djulbegovic B., Robertson M. J., de Vos S., Epner E., Krishnan A., Leonard J. P., Lonial S., Stadtmauer E. A., O'Connor O. A., Shi H., Boral A. L., Goy A. Multicenter phase II study of bortezomib in patients with relapsed or refractory mantle cell lymphoma. (англ.) // Journal Of Clinical Oncology : Official Journal Of The American Society Of Clinical Oncology. — 2006. — 20 October (vol. 24, no. 30). — P. 4867—4874. — doi:10.1200/JCO.2006.07.9665. — PMID 17001068.
- ↑ Jakob C., Egerer K., Liebisch P., Türkmen S., Zavrski I., Kuckelkorn U., Heider U., Kaiser M., Fleissner C., Sterz J., Kleeberg L., Feist E., Burmester G. R., Kloetzel P. M., Sezer O. Circulating proteasome levels are an independent prognostic factor for survival in multiple myeloma. (англ.) // Blood. — 2007. — 1 March (vol. 109, no. 5). — P. 2100—2105. — doi:10.1182/blood-2006-04-016360. — PMID 17095627.
- ↑ Shah S. A., Potter M. W., McDade T. P., Ricciardi R., Perugini R. A., Elliott P. J., Adams J., Callery M. P. 26S proteasome inhibition induces apoptosis and limits growth of human pancreatic cancer. (англ.) // Journal Of Cellular Biochemistry. — 2001. — 2 April (vol. 82, no. 1). — P. 110—122. — doi:10.1002/jcb.1150. — PMID 11400168.
- ↑ Nawrocki S. T., Sweeney-Gotsch B., Takamori R., McConkey D. J. The proteasome inhibitor bortezomib enhances the activity of docetaxel in orthotopic human pancreatic tumor xenografts. (англ.) // Molecular Cancer Therapeutics. — 2004. — January (vol. 3, no. 1). — P. 59—70. — PMID 14749476.
- ↑ Schenkein D. Proteasome inhibitors in the treatment of B-cell malignancies. (англ.) // Clinical Lymphoma. — 2002. — June (vol. 3, no. 1). — P. 49—55. — PMID 12141956.
- ↑ O'Connor O. A., Wright J., Moskowitz C., Muzzy J., MacGregor-Cortelli B., Stubblefield M., Straus D., Portlock C., Hamlin P., Choi E., Dumetrescu O., Esseltine D., Trehu E., Adams J., Schenkein D., Zelenetz A. D. Phase II clinical experience with the novel proteasome inhibitor bortezomib in patients with indolent non-Hodgkin's lymphoma and mantle cell lymphoma. (англ.) // Journal Of Clinical Oncology : Official Journal Of The American Society Of Clinical Oncology. — 2005. — 1 February (vol. 23, no. 4). — P. 676—684. — doi:10.1200/JCO.2005.02.050. — PMID 15613699.
- ↑ Messinger Y. H., Gaynon P. S., Sposto R., van der Giessen J., Eckroth E., Malvar J., Bostrom B. C., Therapeutic Advances in Childhood Leukemia & Lymphoma (TACL) Consortium. Bortezomib with chemotherapy is highly active in advanced B-precursor acute lymphoblastic leukemia: Therapeutic Advances in Childhood Leukemia & Lymphoma (TACL) Study. (англ.) // Blood. — 2012. — 12 July (vol. 120, no. 2). — P. 285—290. — doi:10.1182/blood-2012-04-418640. — PMID 22653976.
- ↑ Lambrou G. I., Papadimitriou L., Chrousos G. P., Vlahopoulos S. A. Glucocorticoid and proteasome inhibitor impact on the leukemic lymphoblast: multiple, diverse signals converging on a few key downstream regulators. (англ.) // Molecular And Cellular Endocrinology. — 2012. — 4 April (vol. 351, no. 2). — P. 142—151. — doi:10.1016/j.mce.2012.01.003. — PMID 22273806.
- ↑ Schmidtke G., Holzhütter H. G., Bogyo M., Kairies N., Groll M., de Giuli R., Emch S., Groettrup M. How an inhibitor of the HIV-I protease modulates proteasome activity. (англ.) // The Journal Of Biological Chemistry. — 1999. — 10 December (vol. 274, no. 50). — P. 35734—35740. — PMID 10585454.
- ↑ Laurent N., de Boüard S., Guillamo J. S., Christov C., Zini R., Jouault H., Andre P., Lotteau V., Peschanski M. Effects of the proteasome inhibitor ritonavir on glioma growth in vitro and in vivo. (англ.) // Molecular Cancer Therapeutics. — 2004. — February (vol. 3, no. 2). — P. 129—136. — PMID 14985453.
- ↑ Zollner T. M., Podda M., Pien C., Elliott P. J., Kaufmann R., Boehncke W. H. Proteasome inhibition reduces superantigen-mediated T cell activation and the severity of psoriasis in a SCID-hu model. (англ.) // The Journal Of Clinical Investigation. — 2002. — March (vol. 109, no. 5). — P. 671—679. — doi:10.1172/JCI12736. — PMID 11877475.
- ↑ Elliott P. J., Pien C. S., McCormack T. A., Chapman I. D., Adams J. Proteasome inhibition: A novel mechanism to combat asthma. (англ.) // The Journal Of Allergy And Clinical Immunology. — 1999. — August (vol. 104, no. 2 Pt 1). — P. 294—300. — PMID 10452747.
- ↑ Verdoes M., Florea B. I., Menendez-Benito V., Maynard C. J., Witte M. D., van der Linden W. A., van den Nieuwendijk A. M., Hofmann T., Berkers C. R., van Leeuwen F. W., Groothuis T. A., Leeuwenburgh M. A., Ovaa H., Neefjes J. J., Filippov D. V., van der Marel G. A., Dantuma N. P., Overkleeft H. S. A fluorescent broad-spectrum proteasome inhibitor for labeling proteasomes in vitro and in vivo. (англ.) // Chemistry & Biology. — 2006. — November (vol. 13, no. 11). — P. 1217—1226. — doi:10.1016/j.chembiol.2006.09.013. — PMID 17114003.
- ↑ Egerer K., Kuckelkorn U., Rudolph P. E., Rückert J. C., Dörner T., Burmester G. R., Kloetzel P. M., Feist E. Circulating proteasomes are markers of cell damage and immunologic activity in autoimmune diseases. (англ.) // The Journal Of Rheumatology. — 2002. — October (vol. 29, no. 10). — P. 2045—2052. — PMID 12375310.
- ↑ Sulistio Y. A., Heese K. The Ubiquitin-Proteasome System and Molecular Chaperone Deregulation in Alzheimer's Disease. (англ.) // Molecular Neurobiology. — 2016. — March (vol. 53, no. 2). — P. 905—931. — doi:10.1007/s12035-014-9063-4. — PMID 25561438.
- ↑ Ortega Z., Lucas J. J. Ubiquitin-proteasome system involvement in Huntington's disease. (англ.) // Frontiers In Molecular Neuroscience. — 2014. — Vol. 7. — P. 77—77. — doi:10.3389/fnmol.2014.00077. — PMID 25324717.
- ↑ Sandri M., Robbins J. Proteotoxicity: an underappreciated pathology in cardiac disease. (англ.) // Journal Of Molecular And Cellular Cardiology. — 2014. — June (vol. 71). — P. 3—10. — doi:10.1016/j.yjmcc.2013.12.015. — PMID 24380730.
- ↑ Drews O., Taegtmeyer H. Targeting the ubiquitin-proteasome system in heart disease: the basis for new therapeutic strategies. (англ.) // Antioxidants & Redox Signaling. — 2014. — 10 December (vol. 21, no. 17). — P. 2322—2343. — doi:10.1089/ars.2013.5823. — PMID 25133688.
- ↑ Wang Z. V., Hill J. A. Protein quality control and metabolism: bidirectional control in the heart. (англ.) // Cell Metabolism. — 2015. — 3 February (vol. 21, no. 2). — P. 215—226. — doi:10.1016/j.cmet.2015.01.016. — PMID 25651176.
- ↑ 1 2 Karin M., Delhase M. The I kappa B kinase (IKK) and NF-kappa B: key elements of proinflammatory signalling. (англ.) // Seminars In Immunology. — 2000. — February (vol. 12, no. 1). — P. 85—98. — doi:10.1006/smim.2000.0210. — PMID 10723801.
- ↑ Ermolaeva M. A., Dakhovnik A., Schumacher B. Quality control mechanisms in cellular and systemic DNA damage responses. (англ.) // Ageing Research Reviews. — 2015. — September (vol. 23, no. Pt A). — P. 3—11. — doi:10.1016/j.arr.2014.12.009. — PMID 25560147.
- ↑ 1 2 3 Lehman N. L. The ubiquitin proteasome system in neuropathology. (англ.) // Acta Neuropathologica. — 2009. — September (vol. 118, no. 3). — P. 329—347. — doi:10.1007/s00401-009-0560-x. — PMID 19597829.
- ↑ Checler F., da Costa C. A., Ancolio K., Chevallier N., Lopez-Perez E., Marambaud P. Role of the proteasome in Alzheimer's disease. (англ.) // Biochimica Et Biophysica Acta. — 2000. — 26 July (vol. 1502, no. 1). — P. 133—138. — PMID 10899438.
- ↑ 1 2 Chung K. K., Dawson V. L., Dawson T. M. The role of the ubiquitin-proteasomal pathway in Parkinson's disease and other neurodegenerative disorders. (англ.) // Trends In Neurosciences. — 2001. — November (vol. 24, no. 11 Suppl). — P. 7—14. — PMID 11881748.
- ↑ 1 2 Ikeda K., Akiyama H., Arai T., Ueno H., Tsuchiya K., Kosaka K. Morphometrical reappraisal of motor neuron system of Pick's disease and amyotrophic lateral sclerosis with dementia. (англ.) // Acta Neuropathologica. — 2002. — July (vol. 104, no. 1). — P. 21—28. — doi:10.1007/s00401-001-0513-5. — PMID 12070660.
- ↑ Manaka H., Kato T., Kurita K., Katagiri T., Shikama Y., Kujirai K., Kawanami T., Suzuki Y., Nihei K., Sasaki H. Marked increase in cerebrospinal fluid ubiquitin in Creutzfeldt-Jakob disease. (англ.) // Neuroscience Letters. — 1992. — 11 May (vol. 139, no. 1). — P. 47—49. — PMID 1328965.
- ↑ Mayer R. J. From neurodegeneration to neurohomeostasis: the role of ubiquitin. (англ.) // Drug News & Perspectives. — 2003. — March (vol. 16, no. 2). — P. 103—108. — PMID 12792671.
- ↑ Mathews K. D., Moore S. A. Limb-girdle muscular dystrophy. (англ.) // Current Neurology And Neuroscience Reports. — 2003. — January (vol. 3, no. 1). — P. 78—85. — PMID 12507416.
- ↑ McNaught K. S., Jackson T., JnoBaptiste R., Kapustin A., Olanow C. W. Proteasomal dysfunction in sporadic Parkinson's disease. (англ.) // Neurology. — 2006. — 23 May (vol. 66, no. 10 Suppl 4). — P. 37—49. — PMID 16717251.
- ↑ Sharma N., Brandis K. A., Herrera S. K., Johnson B. E., Vaidya T., Shrestha R., Debburman S. K. alpha-Synuclein budding yeast model: toxicity enhanced by impaired proteasome and oxidative stress. (англ.) // Journal Of Molecular Neuroscience : MN. — 2006. — Vol. 28, no. 2. — P. 161—178. — doi:10.1385/JMN:28:2:161. — PMID 16679556.
- ↑ Calise J., Powell S. R. The ubiquitin proteasome system and myocardial ischemia. (англ.) // American Journal Of Physiology. Heart And Circulatory Physiology. — 2013. — 1 February (vol. 304, no. 3). — P. 337—349. — doi:10.1152/ajpheart.00604.2012. — PMID 23220331.
- ↑ Predmore J. M., Wang P., Davis F., Bartolone S., Westfall M. V., Dyke D. B., Pagani F., Powell S. R., Day S. M. Ubiquitin proteasome dysfunction in human hypertrophic and dilated cardiomyopathies. (англ.) // Circulation. — 2010. — 2 March (vol. 121, no. 8). — P. 997—1004. — doi:10.1161/CIRCULATIONAHA.109.904557. — PMID 20159828.
- ↑ Powell S. R. The ubiquitin-proteasome system in cardiac physiology and pathology. (англ.) // American Journal Of Physiology. Heart And Circulatory Physiology. — 2006. — July (vol. 291, no. 1). — P. 1—19. — doi:10.1152/ajpheart.00062.2006. — PMID 16501026.
- ↑ Adams J. Potential for proteasome inhibition in the treatment of cancer. (англ.) // Drug Discovery Today. — 2003. — 1 April (vol. 8, no. 7). — P. 307—315. — PMID 12654543.
- ↑ Ben-Neriah Y. Regulatory functions of ubiquitination in the immune system. (англ.) // Nature Immunology. — 2002. — January (vol. 3, no. 1). — P. 20—26. — doi:10.1038/ni0102-20. — PMID 11753406.
Ссылки[править | править код]
Эта статья входит в число избранных статей русскоязычного раздела Википедии. |