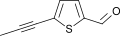
Тиофен
| Тиофен | |||
|---|---|---|---|
| |||
| Общие | |||
| Систематическое наименование |
тиофен | ||
| Традиционные названия | тиофуран | ||
| Хим. формула | C4H4S | ||
| Физические свойства | |||
| Состояние | жидкость | ||
| Молярная масса | 84,14 г/моль | ||
| Плотность | 1,051 г/см³ | ||
| Энергия ионизации | 8,87 эВ[1] | ||
| Термические свойства | |||
| Температура | |||
| • плавления | −38,2 °C | ||
| • кипения | 84 °C | ||
| Структура | |||
| Дипольный момент | 1,8E−30 Кл·м[1] | ||
| Классификация | |||
| Рег. номер CAS | 110-02-1 | ||
| PubChem | 8030 | ||
| Рег. номер EINECS | 203-729-4 | ||
| SMILES | |||
| InChI | |||
| RTECS | XM7350000 | ||
| ChEBI | 30856 | ||
| ChemSpider | 7739 | ||
| Безопасность | |||
| NFPA 704 | |||
| Приведены данные для стандартных условий (25 °C, 100 кПа), если не указано иное. | |||
Тиофе́н — ароматический пятичленный гетероцикл, содержащий один атом серы в цикле.
Физические свойства[править | править код]
Тиофен представляет собой бесцветную жидкость с запахом бензола[2]. Тиофен хорошо растворяется в углеводородах и в других органических растворителях. В воде нерастворим.
Молекула тиофена является плоской.
Химические свойства[править | править код]
Тиофен принадлежит к π-избыточным гетероароматическим системам и проявляет ароматические свойства. Вступает в реакции электрофильного замещения, в частности, реакции галогенирования, нитрования, формилирования, и др., причём его активность в этих реакциях выражена значительно сильнее, чем бензола, — для некоторых реакций на 4 порядка. Данные реакции, как правило, направлены в α-положение цикла, а в β-положение — на 2—3 порядка медленнее. Производные тиофена, которые в положении 2 имеют ориентанты II рода, вступают в реакции замещения с образованием 2,5-дизамещенных. 2,4-Изомеры синтезируют при использовании исходных реагентов в виде комплексов с сильными протонными или апротонными кислотами: это обусловлено значительным возрастанием электроноакцепторной способности заместителя вследствие комплексообразования:

Тиофен и его производные менее стабильны, чем их бензольные аналоги, поэтому многие реакции в ряду тиофена сопровождаются поликонденсацией (смолообразованием) и деструкцией. Тиофен достаточно гладко алкилируется лишь в мягких условиях при использовании более активных третичных и вторичных (но не первичных) алкилгалогенидов. Тиофен и его замещенные, содержащие ориентанты I рода, очень легко ацилируются в присутствии SnCl4 или SnCl2 в бензоле, который в этих условиях не ацилируется. Формилирование тиофена протекает под действием ДМФА или N-метилформанилида в присутствии POCl3; взаимодействие с альдегидами и кетонами в присутствии апротонных или протонных кислот приводит к образованию соединений ряда ди(2-тиенил)метана.
Тиофен и его производные способны к прямому металлированию под действием литийорганических соединений по механизму так называемого протофильного замещения. Реакция протекает быстро и практически количественно при комнатной температуре, в большинстве случаев с высокой региоспецифичностью с образованием α-металлированных производных. В очень мягких условиях (-70 °C) под действием C4H9Li протекает также реакция обмена атома галогена в цикле тиофена на металл, причем обмен галогена в α-положении предпочтительнее, чем в β-положении, а обмен I на Li идет легче, чем Br. В реакции нуклеофильного замещения легко вступают главным образом замещенные тиофена, содержащие в цикле ориентанты II рода.
Тиофен, его гомологи и некоторые производные способны к реакциям радикального замещения, например, арилированию по реакции Гомберга-Бахмана-Хея. Другой важнейший способ арилирования — УФ-облучение иодтиофена в ароматическом растворителе или иодпроизводного ароматического характера в тиофене.
Свойства непредельных соединений выражены в тиофене слабо. Так, в диеновый синтез вступают только конденсированные тиофены, например, замещенные бензо[с]тиофена. Гидрирование в ряду тиофена идет обычно с трудом, что связано с его отравляющим действием на многие катализаторы. Тем не менее, тиофен в присутствии Pd/C, MoS2 и др. превращается в тетрагидротиофен (тиофан, температура плавления −96,2 °C, температура кипения 121,1 °C, 4° d204 0,9987, n20D 1,54048). Гомологи тиофена и многие замещенные легко превращаются в соответствующие производные тиофана в условиях ионного гидрирования, например, при действии трифторуксусной кислоты и триэтилсилана. Дигидротиофен образуется при восстановлении тиофена Na в жидком NH3. При аналогичном восстановлении гомологов тиофена и его производных процесс обычно не останавливается на стадии образования дигидропроизводных, а происходит размыкание цикла с образованием соответствующих соединений алифатического ряда, например:

При действии скелетного Ni с участием адсорбированного Н, идет восстановительная десульфуризация замещенных тиофена с образованием алифатических соединений:

Эта реакция — один из путей получения из производных тиофена, соединений различных классов, например, карбоновых кислот, высших спиртов, простых эфиров, аминоспиртов и аминокислот, а также лактамов макроциклических кетонов, кетокислот и кетолактонов.
Тиофен и его замещенные сравнительно устойчивы к действию окислителей. Однако при действии Н2О2 или надкислот происходит окисление до сульфоксида (в свободном состоянии не выделен) или до сульфона. Оба эти соединения представляют собой типичную диеновую систему, способную, например, к диеновому синтезу, в котором они могут выполнять роль как диена, так и диенофила.
Под действием некоторых алкилирующих агентов или ди-(этоксикарбонил)карбена образуются производные тиофена с положительно заряженным трехвалентным (сульфониевым) атомом серы, например:

Источники и способы получения[править | править код]
Тиофен и его гомологи содержатся в продуктах коксования каменного угля (откуда их и выделяют вместе с каменноугольным бензолом) и продуктах термического разложения сланцев (в некоторых фракциях до 70 % по массе). В сыром бензоле содержание тиофена составляет 1,3—1,4 %, в получаемом из сырого бензола тиофено-бензольном концентрате-30—35 %. Основное сырье для синтеза тиофена и его гомологов — углеводороды нефтяных фракций С4 и С5, из которых они могут быть получены термическим взаимодействием с S или каталитической реакцией с H2S или SO2. Тиофен синтезируют также пропусканием фурана, ацетилена или 1,3-бутадиена и H2S над Al2O3. Гомологи тиофена, а также некоторые производные, получают замыканием соответствующих 1,4-дикарбонильных соединений с помощью P2S5, например:

Применение[править | править код]
Соединения ряда тиофена — реагенты для разделения элементов, оптические отбеливатели (на основе 2,5-тиофендикарбоновой кислоты), физиологически активные соединения. Многие производные тиофена – лекарственные препараты (например, антигельминтный препарат комбантрин, модифицированные антибиотики цефалотин, цефалоридин), мономеры для получения электропроводящих полимеров.
Нахождение в природе[править | править код]
Производные тиофена широко распространены в живой природе: грибах и некоторых высших растениях. Например, бархатцы (Tagetes) грибок Daedelia juniperina и корни Echinops spaerocephalus содержат непредельные соединения тиофена:
Токсичность[править | править код]
Тиофен и его производные умеренно-токсичны.
Примечания[править | править код]
- ↑ 1 2 David R. Lide, Jr. Basic laboratory and industrial chemicals (англ.): A CRC quick reference handbook — CRC Press, 1993. — ISBN 978-0-8493-4498-5
- ↑ Химическая энциклопедия / Редкол.: Кнунянц И.Л. и др.. — М.: Советская энциклопедия, 1995. — Т. 4 (Пол-Три). — 639 с. — ISBN 5-82270-092-4.
Литература[править | править код]
- Блике Ф., в сб.: Гетероциклические соединения, под ред. Р. Эльдерфилда, пер. с англ., т. 1, М., 1953;
- Новые направления химии тиофена, М , 1976;
- Беленький Л. И., Гультяй В. П., «Химия гетероциклических соединений», 1981, № 6, с. 723—43;
- Общая органическая химия, пер. с англ., т. 9, М., 1985, с. 229—93;
- Анисимов А. В., Викторова Е. А., Данилова Т. А., Молекулярные перегруппировки сероорганичсских соединений, М., 1989.