Хлорид бериллия
| Хлорид бериллия | |||
|---|---|---|---|
| |||
| Общие | |||
| Систематическое наименование |
Хлорид бериллия | ||
| Традиционные названия | Хлористый бериллий, дихлорид бериллия | ||
| Хим. формула | BeCl2 | ||
| Рац. формула | BeCl2 | ||
| Физические свойства | |||
| Состояние | твёрдое | ||
| Молярная масса | 79,92 г/моль | ||
| Плотность | 1,90 г/см³ | ||
| Термические свойства | |||
| Температура | |||
| • плавления | 440 °C | ||
| • кипения | 520 °C | ||
| Мол. теплоёмк. | 71,1 Дж/(моль·К) | ||
| Энтальпия | |||
| • образования | -494 кДж/моль | ||
| Удельная теплота испарения | 109 Дж/кг | ||
| Удельная теплота плавления | 16 Дж/кг | ||
| Химические свойства | |||
| Растворимость | |||
| • в воде | 72,8 г/100 мл | ||
| Структура | |||
| Кристаллическая структура | гексагональная | ||
| Классификация | |||
| Рег. номер CAS | 7787-47-5 | ||
| PubChem | 24588 | ||
| Рег. номер EINECS | 232-116-4 | ||
| SMILES | |||
| InChI | |||
| RTECS | DS2625000 | ||
| ChEBI | 62843 | ||
| ChemSpider | 22991 | ||
| Безопасность | |||
| ЛД50 |
86 мг/кг (крысы, перорально) 1,35 мг/кг (мыши, внутрибрюшинно) |
||
| Токсичность | высокотоксичен, канцерогенен, мутагенен, ирритант, опасен для окружающей среды | ||
| Приведены данные для стандартных условий (25 °C, 100 кПа), если не указано иное. | |||
Хлори́д бери́ллия (англ. Beryllium chloride) — химическое соединение с формулой BeCl2. Представляет собой белые или слегка зеленоватые игольчатые кристаллы, расплывающиеся на воздухе из-за сильной гигроскопичности[1]. В основном существует в виде устойчивого кристаллогидрата BeCl2•4H2O и гораздо менее устойчивого BeCl2•2H2O. В парах, при температуре от 500 до 600°С хлорид бериллия существует в виде димера Be2Cl4[1].
Свойства[править | править код]
Безводный хлорид бериллия очень гигроскопичен и хорошо растворим в воде с выделением большого количества тепла. Хорошо растворим в метиловом, этиловом и пропиловом спиртах, диэтиловом эфире и бензоле. Мало растворим в хлороформе и практически нерастворим в ацетоне[2].
Тетрагидрат хлорида бериллия растворяется в воде конгруэнтно, дигидрат — инконгруэнтно[1].
В водном растворе хлорид бериллия склонен к гидролизу, степень которого зависит от рН раствора. Присутствие соляной кислоты подавляет гидролиз. В концентрированных солянокислых растворах образует с НСl катионные комплексы, например [BeCl]+.
Водный раствор ВеСl2 хорошо проводит электрический ток. Расплавленный ВеСl2 практически не электропроводен. Добавление в расплав щелочных хлоридов, в том числе хлорида натрия, повышает электропроводность и понижает температуру расплава, вследствие образования Nа2ВеСl4 (в водных растворах подобных анионных комплексов не обнаружено), что имеет существенное значение для электролитического производства бериллия.
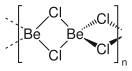
При высоких температурах существует в виде линейных молекул.
Получение[править | править код]
Лабораторным способом получения хлорида бериллия является взаимодействие карбоната, оксида или гидроксида бериллия с соляной кислотой:
Хлорид бериллия может быть получен взаимодействием металлического бериллия с хлором при температурах от 500 °C до 700 °C:
Хлорид бериллия также образуется при взаимодействии оксида бериллия с хлором при температуре выше 1000°С. При этом в присутствии угля данная реакция идет легче и при гораздо меньших температурах (600—800°С)[1]:
Хлорид бериллия образуется при нагревании оксида бериллия со многими хлорсодержащими соединениями:[1]
Химические свойства[править | править код]
Хлорид бериллия реагирует со щелочами и водным раствором аммиака с образованием нерастворимого гидроксида бериллия:
При взаимодействии хлорида бериллия с карбонатами щелочных металлов или аммония образуется осадок основного карбоната бериллия:
Хлорид бериллия вступает в обменные реакции с другими солями, образуя нерастворимые соединения бериллия, например[1]:
Хлорид бериллия не восстанавливается водородом, для его восстановления при высокой температуре применимы лишь натрий, кальций, магний и некоторые другие металлы[1]:
При нагревании кристаллогидратов или упаривании водных растворов хлорида бериллия образуется труднорастворимый в воде основной хлорид:
Хлорид бериллия имеет большую склонность к образованию комплексов с аммиаком. Известны четыре аммиаката хлорида бериллия: [Ве(NH3)12]Сl2, [Ве(NH3)6]Сl2, [Ве(NH3)4]Сl2, [Ве(NH3)2]Сl2, причем низшие аммиакаты достаточно устойчивы. Аналогичные комплексные соединения получены со многими органическими аддендами (с пиридином, ацетоном, эфиром, нитрилами и др.). Наиболее важен из них диэтилэфират [Ве((С2Н5)2О)2]Сl2,получаемый растворением ВеСl2 в диэтиловом эфире.
Применение[править | править код]
Хлорид бериллия используется как сырье для получения бериллия электролизом или путём взаимодействия с металлическим магнием, а также как катализатор реакций Фриделя-Крафтса и полимеризации[1].
Биологическое воздействие[править | править код]
- Хлорид бериллия, как и другие его галогениды, токсичен для человека[3]
- Предельно допустимая концентрация хлористого бериллия в воздухе рабочей зоны составляет 0,001 мг/м3 (в пересчёте на бериллий).[источник не указан 1396 дней]
- На сегодня доказан его токсический (в том числе – и цитотоксический), сенсибилизирующий, эмбриотоксический и канцерогенный эффекты. Последний установлен в эксперименте на животных определенных видов и обсуждается в отношении человека. Бериллий и его соединения имеют способность проникать во все органы, клетки и их ядра, в клеточные органеллы, в частности, в митохондрии. Он повреждает клеточные мембраны, в том числе – и их липидные компоненты, нарушая микровязкость. Бериллий тормозит активность АТФ–азы саркоплазматического ретикулума путем ингибирования транспорта магния и кальция.
Проникая в ядра клеток, бериллий снижает активность ферментов синтеза ДНК, в частности ДНК–полимеразы, имеются указания на значение нарушений синтеза ДНК для появления аномальных белков, играющих роль аутоантигенов. Цитотоксический эффект соединений бериллия изучен на фагоцитах. В частности, введение сульфата и цитрата бериллия вызывает блокаду клеток системы мононуклеарных фагоцитов и снижает индекс фагоцитоза на 65–75%. Введение фосфата бериллия подавляет воспалительную реакцию. При внутритрахеальном введении соединений бериллия происходит повышенный выход макрофагов и полинуклеаров в просвет альвеол. Однако подвижность макрофагов при этом снижается, их органеллы повреждаются и снижается синтез ДНК. Показано, что при ингаляции растворимых солей бериллия разрастается соединительная ткань преимущественно в периваскулярных и перибронхиальных зонах. Фиброз развивается в ответ на проникновение бериллия в легкие, причем этот процесс имеет максимальную скорость в течение первого месяца после внутритрахеального введения гидроокиси бериллия. Склероз легочной ткани, как правило, сочетается с возникновением своеобразных гранулем. Электронно-микроскопические и гистохимические исследования последних лет показали сходство их с гранулемами аллергического характера. Доказано, что в лимфоцитах гранулем число органелл увеличено. Этот факт и наличие большого числа свободных рибосом свидетельствуют об их активном состоянии. Эпителиоидные клетки гранулем возникают из мононуклеаров и лимфоцитов. Уже в первые месяцы после ингаляции растворимых соединений бериллия развиваются гранулемоподобные узелки, состоящие из лимфоидно–гистиоцитарных элементов. В центре таких узелков обнаруживаются распадающиеся макрофаги и клеточный детрит. Это трактуется как результат выхода бериллия при гибели макрофагов, поглотивших его.4
Примечания[править | править код]
Литература[править | править код]
- Кнунянц, И. Л. Бериллия галогениды // Краткая химическая энциклопедия : в 5 т.. — М. : Советская энциклопедия, 1961. — Т. 1 : Статьи от А до Е. — Стб. 425–426. — 1262 стб. — (Энциклопедии, словари и справочники). — ББК 54(03).











![{\displaystyle {\mathsf {BeCl_{2}+2Na_{2}CO_{3}+H_{2}O\longrightarrow [BeOH]_{2}CO_{3}+4NaCl+CO_{2}}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/dbb3ab0d39f5a57ae41a60e32fa50a62c9a05e78)



