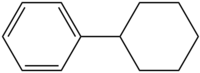
Циклогексилбензол
| Циклогексилбензол[1][2][3] | |
|---|---|
 | |
| Общие | |
| Систематическое наименование |
Циклогексилбензол |
| Традиционные названия | Фенилциклогексан |
| Хим. формула | C12H16 |
| Физические свойства | |
| Молярная масса | 160,25 г/моль |
| Плотность | 0,9428 г/см³ |
| Термические свойства | |
| Температура | |
| • плавления | 5 °C |
| • кипения | 238 °C |
| • вспышки | 99 °C |
| Оптические свойства | |
| Показатель преломления | 1,526 |
| Классификация | |
| Рег. номер CAS | 827-52-1 |
| PubChem | 13229 |
| Рег. номер EINECS | 212-572-0 |
| SMILES | |
| InChI | |
| ChemSpider | 12674 |
| Безопасность | |
| Предельная концентрация | 0,01 мг/м3 |
| Краткие характер. опасности (H) |
H302, H315, H319, H410 |
| Меры предостор. (P) |
P273, P305+P351+P338, P501 |
| Пиктограммы СГС |
|
| Приведены данные для стандартных условий (25 °C, 100 кПа), если не указано иное. | |
Циклогексилбензол (фенилциклогексан) — ароматическое органическое соединение, состоящее из бензольного и циклогексанового колец, соединённых между собой. Является промышленным продуктом нефтехимии, представляет значительный интерес как сырьё для тонкого органического синтеза[4].
Получение[править | править код]
- Основным способом получения является реакция бензола с циклогексеном. Сначала в колбу помещают бензол и концентрированную серную кислоту, являющуюся катализатором процесса. Смесь охлаждают в бане со льдом, после чего в течение 1,5 часа приливают циклогексен в таком количестве, чтобы число моль бензола оказалось в 3 раза больше, чем число моль циклогексена. При этом смесь постоянно перемешивают, а также поддерживают температуру при 5-10 °C. После внесения всего циклогексена перемешивание продолжается ещё в течение 1 часа. Затем углеводородный слой отделяют, охлаждают льдом, 4 раза промывают холодной концентрированной серной кислотой. После этого продукт 2 раза промывают тёплой водой с температурой 50 °C, 3%-ным раствором гидроксида натрия и снова чистой водой. Затем смесь углеводородов сушат над хлоридом кальция и подвергают перегонке. Циклогексилбензол при этом собирают в пределах 238—243 °C. При соблюдении данной методики выход продукта составляет 65-68 %. Протекает следующая реакция[5]:
- Каталитическое взаимодействие бензола и хлорциклогексана в присутствии хлорида алюминия[2]:
- Реакция бензола с циклогексанолом в среде фторида бора(III) при температуре 60 °C. Выход продукта при этих условиях достигает 56 %[6]:
Физические свойства[править | править код]
Растворим в спирте, ацетоне, бензоле, гексане, тетрахлорметане, касторовом масле[2].
Зависимость давления паров жидкого циклогексилбензола (мм рт. ст.) от температуры (°C) выражается уравнением[7]:
Химические свойства[править | править код]
- Нитруется по третичному атому углерода циклогексанового кольца разбавленной азотной кислотой, давая нитросоединение циклогексилбензола[9].
- Окисляется смесью хлорида рения(III) и периодата натрия до циклогексанкарбоновой кислоты при 20 °C. Выход продукта достигает 94 % при протекании реакции в течение 24 часов[10].
- Может быть окислен кислородом, а затем в кислой среде переведён в фенол и циклогексанон. Данный метод получил название «гидроперекисный», однако его использование на практике ограничено ввиду недостаточной доступности циклогексилбензола[11]:
Применение[править | править код]
На основе циклогексилбензола изготавливаются сцинтилляторы, которые в процессе работы или при хранении способны, в отличие от ряда других сцинтилляторов, соприкасаться с различными полимерными материалами за счёт малой растворимости полиметилметакрилата и некоторых других пластмасс в циклогексилбензоле. По световыходу сцинтилляторы на основе данного вещества близки к толуольным[12].
Используется в качестве нейтрального органического растворителя. К примеру, в циклогексилбензоле проводят синтез триалкилфосфитов взаимодействием алифатических спиртов с хлоридом фосфора(III)[13].
Примечания[править | править код]
- ↑ Phenylcyclohexane (англ.). Sigma-Aldrich.
- ↑ 1 2 3 Кнунянц и др., 1998, с. 614.
- ↑ Москвин, 2004, с. 1085.
- ↑ Злотский и др., 2000, с. 7.
- ↑ Платэ, 1949, с. 567—568.
- ↑ Физер, 1970, с. 170.
- ↑ Тиличеев, 1953, с. 243.
- ↑ Варшавский и др., 1967, с. 168—169.
- ↑ Брукс и др., 1959, с. 79.
- ↑ Горелик и др., 1992, с. 510.
- ↑ Лебедев, 1975, с. 482.
- ↑ Красовицкий и др., 1976, с. 251.
- ↑ Горбунов и др., 1981, с. 317.
Литература[править | править код]
- Большой энциклопедический словарь. Химия / Редкол.: Кнунянц И.Л. и др. — 2-е изд. — М.: Советская энциклопедия, 1998. — 791 с. — ISBN 5-85270-253-6.
- Красовицкий Б.М., Болотин Б.М. Органические люминофоры. — Л.: Химия, 1976. — 344 с.
- Установление структуры органических соединений химическими методами. Книга II / ред.: Я.М. Варшавский, И.Ф. Луценко. — М.: Химия, 1967. — 800 с.
- Химия углеводородов нефти / под ред. Б.Т. Брукса, С.С. Куртца, С.Е. Бурда, Л. Шмерлинга. — М., 1959. — Т. 3.
- Горбунов Б.Н., Гурвич Я.А., Маслова И.П. Химия и технология стабилизаторов полимерных материалов. — М.: Химия, 1981. — 368 с.
- Горелик М.В., Эфрос Л.С. Основы химии и технологии ароматических соединений. — М.: Химия, 1992. — 640 с. — ISBN 5-7245-0679-3.
- Физико-химические свойства индивидуальных углеводородов. Выпуск 4 / под ред. М.Д. Тиличеева. — Л.: ГосТопТехИздат, 1953. — 438 с.
- Синтезы органических препаратов. Сборник 2 / пер. с англ. А.Ф. Платэ. — М.: Издательство иностранной литературы, 1949.
- Лебедев Н.Н. Химия и технология основного органического и нефтехимического синтеза. — 2-е изд., пер.. — М.: Химия, 1975. — 736 с.
- Л. Физер, М. Физер. Органическая химия. Углублённый курс. — М.: Химия, 1970. — Т. 2. — 800 с.
- Перспективные процессы и продукты малотоннажой химии. Сб. Вып. 4 / Редкол.: С.С. Злотский, У.Б. Имашев и др.. — Уфа: Реактив, 2000. — 204 с. — ISBN 5-88333-060-6.
- Новый справочник химика и технолога. Радиоактивные вещества. Вредные вещества. Гигиенические нормативы / под ред. А. В. Москвина. — СПб.: Профессионал, 2004. — 1142 с. — ISBN 5-98371-025-7.
![{\displaystyle {\ce {C6H6 + C6H10 ->[kat] C6H5-C6H11}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/344c62e556da30447dc796d4f0994d5a53f4ec37)
![{\displaystyle {\ce {C6H6 + C6H11Cl ->[kat] C6H5-C6H11 + HCl}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/e0834f3377320a7b95f96840d311628e5d4e4c44)
![{\displaystyle {\ce {C6H6 + C6H11OH ->[kat] C6H5-C6H11 + H2O}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/bd837d9ae0859268e306f5bad0e8b15462f2921a)

![{\displaystyle {\ce {C6H5-C6H11 ->[Ph2S2] C6H5-C6H5 + 3H2}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/6b483054fb863aac2844078a63c9647fd2db78d8)
