Виниловый спирт
| Виниловый спирт | |
|---|---|
 | |
| Общие | |
| Систематическое наименование |
Этенол |
| Традиционные названия | Виниловый спирт |
| Хим. формула | С2H4O |
| Физические свойства | |
| Молярная масса | 44,05 г/моль |
| Классификация | |
| Рег. номер CAS | [557-75-5] |
| PubChem | 11199 |
| Рег. номер EINECS | 209-183-3 |
| SMILES | |
| InChI | |
| ChemSpider | 10726 |
| Приведены данные для стандартных условий (25 °C, 100 кПа), если не указано иное. | |
Виниловый спирт (этенол, не путать с этанолом) — ненасыщенный одноатомный спирт с формулой CH2=CH-OH, простейший енол, легко превращается в ацетальдегид. Получены его простые и сложные эфиры.
Синтез[править | править код]
Виниловый спирт можно получить путём дегидратации этиленгликоля при температуре 900 °С и низком давлении. [1]
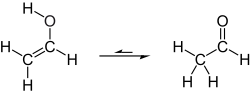
Таутомеризация винилового спирта в ацетальдегид[править | править код]
В нормальных условиях виниловый спирт таутомеризуется в ацетальдегид :
При комнатной температуре ацетальдегид более стабилен, чем виниловый спирт, энтальпия превращения составляет 42,7 кДж/моль. [2]

В отсутствие катализатора кето-енольная таутомерия за счет миграции 1,3-водорода запрещена правилами Вудворда-Хоффмана, имеет высокий активационный барьер и затруднительна при комнатной температуре или около нее. Однако даже следовые количества кислот, оснований или воды могут катализировать реакцию. Даже при строгих мерах предосторожности, направленных на ликвидацию случайной влаги или источников протонов, виниловый спирт можно хранить только от нескольких минут до нескольких часов, прежде чем он изомеризуется в ацетальдегид. (Другим примером вещества, стабильного в строгой чистоте, но быстро разлагающегося из-за катализа следами влаги, является угольная кислота.)
Таутомеризация также может быть катализирована с помощью фотохимического процесса. Эти данные свидетельствуют о том, что кето-енольная таутомеризация легко протекает в атмосфере и стратосфере, и о том, что виниловый спирт играет роль в появлении органических кислот в атмосфере. [4] [5]
Виниловый спирт можно стабилизировать, контролируя концентрацию воды в системе и используя кинетический изотопный эффект, замедляющий реакции с участием дейтерия. Этого эффекта можно добиться путем гидролиза предшественника кетена в присутствии небольшого стехиометрического избытка тяжелой воды (D2O). Исследования показывают, что процесс таутомеризации значительно ингибируется при температуре окружающей среды, а период полураспада енольной формы можно легко увеличить до t 1/2 = 42 мин [6]
Связь с поливиниловым спиртом[править | править код]
Из-за нестабильности винилового спирта термопластичный поливиниловый спирт (ПВС или PVOH) получают косвенно путем полимеризации винилацетата с последующим гидролизом сложноэфирных связей.
Лиганд[править | править код]
Получено несколько комплексов металлов, содержащих виниловый спирт в качестве лиганда, таких как Pt(acac)(η 2 -C 2 H 3 OH)Cl. [7]
См. также[править | править код]
Литература[править | править код]
- Енолы // Большая Советская энциклопедия (в 30 т.) / А. М. Прохоров (гл. ред.). — 3-е изд. — М.: Сов. энциклопедия, 1972. — Т. IX. — С. 87. — 624 с.
Примечания[править | править код]
- ↑ Clayden, Jonathan; Greeves, Nick; Warren, Stuart. Organic Chemistry, 2nd edition, pp. 456-57. Oxford University Press, 2012. ISBN 978-0-19-927029-3.
- ↑ R.D. Johnson III. CCCBDB NIST Standard Reference Database. Дата обращения: 30 августа 2014. Архивировано 19 августа 2014 года.
- ↑ J. A. Keith, P. M. Henry (2009). "The Mechanism of the Wacker Reaction: A Tale of Two Hydroxypalladations". Angew. Chem. Int. Ed. 48 (48): 9038—9049. doi:10.1002/anie.200902194. PMID 19834921.
- ↑ Heazlewood, B. R.; Maccarone, A. T.; Andrews, D. U.; Osborn, D. L.; Harding, L. B.; Klippenstein, S. J.; Jordan, M. J. T.; Kable, S. H. "Near-threshold H/D exchange in CD3CHO photodissociation." Nat. Chem. 2011, 3, 443−448. doi:10.1038/nchem.1052
- ↑ Andrews D. U., Heazlewood B. R., Maccarone A. T., Conroy T., Payne R. J., Jordan M. J. T., Kable S. H. (2012). "Photo-tautomerization of acetaldehyde to vinyl alcohol: A potential route to tropospheric acids". Science. 337 (6099): 1203—1206. Bibcode:2012Sci...337.1203A. doi:10.1126/science.1220712. PMID 22903524.
{{cite journal}}: Википедия:Обслуживание CS1 (множественные имена: authors list) (ссылка) - ↑ Cederstav, Anna K. (1994). "Investigations into the Chemistry of Thermodynamically Unstable Species. The Direct Polymerization of Vinyl Alcohol, the Enolic Tautomer of Acetaldehyde". Journal of the American Chemical Society. 100 (9): 4073—4074. doi:10.1021/ja00088a051.
- ↑ Cotton F. A., Francis J. N., Frenz B. A., Tsutsui M. (1973). "Structure of a dihapto(vinyl alcohol) complex of platinum(II)". Journal of the American Chemical Society. 95 (8): 2483—6. doi:10.1021/ja00789a011.
{{cite journal}}: Википедия:Обслуживание CS1 (множественные имена: authors list) (ссылка)