IRES
IRES (англ. Internal Ribosome Entry Site — участок внутренней посадки рибосомы) — регуляторный участок мРНК эукариот и их вирусов, который обеспечивает кэп-независимую, или внутреннюю инициацию трансляции. При таком механизме инициации рибосома связывается с мРНК непосредственно в районе IRES, которые чаще всего располагаются в 5'-нетранслируемой области (5'-НТО) недалеко от сайта инициации трансляции, минуя стадии узнавания кэпа и сканирования[1].
К 2016 году описано более 80 клеточных (у дрожжей, растений и других высших эукариот) и 56 вирусных IRES. IRES были обнаружены у представителей следующих семейств вирусов: пикорнавирусы, флавивирусы, дицистровирусы[англ.] и лентивирусы[2]. Кроме того, недавно была показана возможность трансляции, зависимой от IRES вируса эукариот, в клетках бактерий[3].
История
[править | править код]Участки внутренней посадки рибосомы были открыты в мРНК полиовируса и вируса энцефаломиокардита[англ.] в 1988 году группами Н. Соненберга[англ.][4] и Э. Виммера[англ.][5] соответственно. Они обнаружили, что в молекуле РНК есть участки, способные связывать рибосомы, тем самым инициируя трансляцию. Оказалось, что если поместить IRES между двумя репортёрными генами в мРНК, то второй (3'-концевой) цистрон также будет экспрессироваться. Однако использование данного метода (т. н. метода бицистронных конструкций) может привести к ряду артефактов, связанных со сплайсингом и потенциальной промоторной активностью участков внутренней посадки рибосомы[6].
Структура
[править | править код]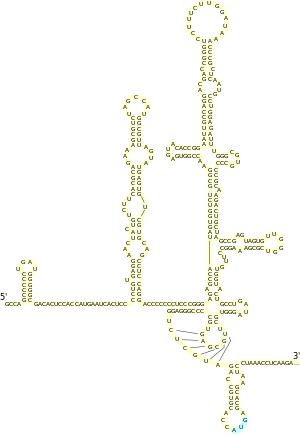
Для всех IRES пикорнавирусов характерно наличие мотива GRNA в центральном домене, который обеспечивает формирование четырёхпетельной конформации, а также небольшого пиримидинобогащённого участка, который расположен на 20—25 нуклеотидов выше кодона AUG. IRES флавивирусов содержит 4 домена, обозначаемых I—IV, причём у IRES вируса гепатита C (HCV), типового представителя IRES данной группы вирусов, последовательности, необходимые для активности IRES, находятся между доменами II, III и IV и захватывают первые 30 нуклеотидов открытой рамки считывания, начинающейся со старт-кодона AUG. Вторичная структура IRES HCV была тщательно изучена. В частности, установлено, что домен II представляет собой шпильку длиной 75 нуклеотидов с тремя внутренними и одной терминальной петлёй и что домен III обладает наиболее сложной вторичной структурой, которая включает несколько спиралей и шпилек. Вторичная и третичная структура IRES дицистровирусов довольно консервативна и включает 3 различных домена, каждый из которых содержит псевдоузел. IRES были выявлены почти у всех членов семейства лентивирусов (в число которых входит и вирус иммунодефицита человека), причём IRES у них располагаются не только в 5'-НТО, но и в кодирующей области, где они участвуют в экспрессии некоторых изоформ основного структурного полипротеина Gag[англ.][2].
Структуры эукариотических IRES очень разнообразны, и в них не выявлено никаких консервативных последовательностей и мотивов. В некоторых случаях для эффективной работы IRES должны быть стабильными структурами в мРНК, а в других, напротив, слишком жёсткая структура IRES ингибирует инициацию трансляции. Было высказано предположение, что IRES не являются жёстко зафиксированными структурами и способны к перестройкам, регулирующим их активность. IRES могут также обусловливать образование различных изоформ белка, тем самым дополнительно расширяя число возможных белковых продуктов, получаемых с одного гена[7].
Механизм
[править | править код]IRES обнаружены в 5'-нетранслируемых областях геномных мРНК вирусов и позволяют им транслироваться независимо от кэпа. Ряд клеточных мРНК также содержат IRES[8].
Клеточные IRES
[править | править код]В клетках IRES отвечают за посадку рибосом как на кэпированные, так и на некэпированные транскрипты в тех случаях, когда кэпзависимая инициация трансляции ингибирована (при стрессе, на определённой стадии клеточного цикла или при апоптозе), и тем самым обеспечивают непрерывный синтез необходимых белков. Ряд генов, мРНК которых содержат IRES — c-Myc, APAF1, Bcl-2 — при нормальных условиях экспрессируются мало, но в определённых ситуациях их экспрессия может существенно возрастать за счёт IRES-зависимой трансляции. Считается, что IRES могут также участвовать в поддержании низкого уровня трансляции ряда мРНК при нормальных условиях, связывая рибосомы и не позволяя им присоединяться к основным сайтам инициации. Такой механизм внутренней инициации в настоящее время плохо понятен, однако совершенно ясно, что эффективность IRES сильно зависит от транс-регуляторных белковых факторов, которые обеспечивают тонкую регуляцию IRES-зависимой трансляции на уровне отдельных клеток[1].
Структуры в 5'-НТО могут влиять на активность IRES, причём это влияние может быть опосредовано взаимодействиями как с различными транс-регуляторными факторами, так и непосредственно с рибосомами. Примерами генов, IRES которых находятся под контролем транс-регуляторных белков, являются протоонкогены Myc, участвующие в регуляции пролиферации клеток[9]. Для IRES-зависимой трансляции этих мРНК необходимы особые факторы трансляции ITAF (англ. IRES trans-acting factors), которые выступают как шапероны РНК, заставляющие её принять правильную конформацию, подходящую для связывания с 40S субъединицей рибосомы[10].
Наличие IRES между AUG и другими старт-кодонами (отличными от AUG) свидетельствует о возможной роли IRES в инициации трансляции со слабых нестандартных старт-кодонов. IRES также могут взаимодействовать с короткими рамками считывания (uORF). Для доказательства существования IRES в структуре РНК недостаточно анализа её последовательности — все предположения должны быть подтверждены экспериментальными данными[7].
Х-связанный ингибитор апоптоза[англ.] (англ. X-linked inhibitor of apoptosis, XIAP) играет важную роль в регуляции апоптоза, поэтому его синтез должен точно контролироваться. 5’-НТО мРНК XIAP составляет 1700 нуклеотидов в длину и содержит IRES, облегчающий синтез XIAP в условиях стресса. Кроме описанной мРНК XIAP, в результате альтернативного сплайсинга образуется мРНК с более короткой 5'-НТО длиной 323 нуклеотида и не содержащая IRES. Количество мРНК XIAP с короткой 5'-НТО в клетках в 10 раз в больше, чем с длинной. Установлено, что мРНК с короткой 5’-НТО ответственна за синтез XIAP в нормальных условиях и транслируется по кэп-зависимому механизму, а мРНК с длинной 5’-НТО обеспечивает синтез XIAP в условиях стресса. Итак, комбинация альтернативных 5’-НТО и механизмов инициации трансляции обеспечивает постоянную экспрессию XIAP в любых условиях[7].
Другим примером контроля экспрессии генов через различные элементы 5’-НТО, является ген человеческого фактора роста фибробластов 2 (англ. fibroblast growth factor 2, FGF-2). FGF-2 экспрессируется в 5 различных изоформах, образующихся при использовании альтернативных инициаторных кодонов в 5’-НТО, и трансляция его мРНК может идти не только кэпзависимо, но и IRES-зависимо. Интересно, что трансляция с четырёх из пяти инициаторных кодонов опосредована IRES. Предполагается, что IRES облегчает трансляцию с каждого из этих четырёх кодонов через модуляцию структуры мРНК при помощи транс-активирующих факторов[7].
Вирусные IRES
[править | править код]
У многих РНК-содержащих вирусов инициация трансляции происходит по кэпнезависимому механизму при участии IRES, локализованных в 5'-НТО[11]. Например, так происходит у ВИЧ, вирусов гепатита A и С[12]. Такой механизм инициации трансляции удобен тем, что в его случае нет необходимости в сборке преинициаторного белкового комплекса, и вирус может быстро размножаться[13].
Некоторые вирусные мРНК имеют на 5'-конце ковалентно связанный белок (VPg[англ.]), поэтому использование кэпзависимой инициации для них исключено. IRES вируса гепатита C образует комплекс с 40S субъединицей рибосомы и привлекает фактор трансляции eIF3 клетки-хозяина[7]. IRES многих пикорнавирусов не связывают 40S напрямую, а делают это через фактор инициации eIF4G, высокоаффинный сайт связывания которого находится в IRES[14]. У многих вирусов (например, пикорнавирусов) для IRES-зависимой инициации одних канонических факторов инициации трансляции недостаточно: им также необходимы особые факторы, называемые ITAF[15]. В зависимости от особенностей вторичной структуры и потребности в тех или иных факторах трансляции IRES делят на различные классы внутри отдельных семейств вирусов[16]. Например, IRES пикорнавирусов делят на 4 класса (I—IV)[17].
Вирусный РНК-геном может содержать больше одного IRES. Например, вирус паралича сверчков[англ.], входящий в семейство дицистровирусов[англ.], имеет РНК-геном с двумя IRES, один из которых локализован в 5'-НТО, а другой в межгенном участке[англ.]. Оказалось, что функционирование этих элементов отличается: IRES, расположенный в 5'-НТО, инициирует трансляцию на всех этапах вирусной инфекции, а IRES, локализованный в межгенном участке, большую часть времени подавлен и активируется только через 2—3 часа после заражения. Временное разобщение двух IRES — эффективная вирусная стратегия для экспрессии определённых белков в строго определённую фазу инфекции[18].
Клиническое значение
[править | править код]Поскольку IRES играют важнейшую роль в регуляции ряда генов, мутации, затрагивающие IRES, приводят к развитию тех или иных заболеваний. В частности, к числу таких заболеваний у человека относят Х-сцепленную болезнь Шарко — Мари — Тута, множественную миелому и синдром ломкой Х-хромосомы[19].
Вирусные IRES могут выступать мишенями многих противовирусных препаратов. В настоящий момент разрабатываются препараты, которые непосредственно разрушают структуру IRES или же мешают взаимодействию IRES с рибосомой или белковыми факторами, например, факторами инициации трансляции. В частности, IRES вируса гепатита C, ввиду своей консервативности среди встречающихся в клинике образцов, может быть мишенью лекарств, блокирующих трансляцию у этого вируса[20]. Среди препаратов, направленных против IRES, есть антисмысловые олигонуклеотиды, пептидо-нуклеиновые кислоты (RNA), замкнутые нуклеиновые кислоты[англ.] (LNA), морфолиновые олигонуклеотиды, короткие шпилечные РНК, аптамеры РНК, рибозимы, дезоксирибозимы[англ.], пептиды и малые молекулы[21]. Показано, что ингибитор янускиназы 2[англ.] AZD1480 способен подавлять размножение вируса гепатита A, блокируя его IRES-зависимую трансляцию[22]. Апигенин — препарат, применяющийся при лечении ящура — подавляет развитие вирусной инфекции, нарушая IRES-зависимую трансляцию у вируса ящура[23]. Жизненный цикл энтеровирусов эффективно подавляет противоопухолевый препарат идарубицин, связывающийся с IRES[24].
Особый интерес представляют онколитические вирусы[англ.], жизненный цикл которых зависит от IRES, в связи с их возможным использованием в противораковой терапии[25].
IRES нашли широкое применение в создании векторов для генной терапии. Если локализовать IRES в 5'-НТО мРНК необходимых генов, то можно добиться их скоординированной экспрессии. В таких случаях чаще всего используется IRES вируса энцефаломиокардита[англ.][26].
Методы
[править | править код]Для проверки того, обладает ли данная последовательность РНК свойствами IRES, можно использовать следующий метод. Создаётся бицистронная эукариотическая мРНК, в которой исследуемая последовательность находится между двумя репортёрными открытыми рамками считывания. Открытая рамка, находящаяся до исследуемой последовательности, будет транслироваться в белок по кэпзависимому механизму. Если изучаемая последовательность обладает свойствами IRES, то в клетке будет накапливаться и белок, соответствующий второй открытой рамке[6].
Разработаны web-серверы, позволяющие предсказывать наличие IRES в вирусных РНК (VIPS) или в вирусных и клеточных РНК (IRESPred)[27].
В 2016 году был предложен алгоритм RNAiFold2T для разработки особых РНК-термометров, содержащих IRES. Кэпнезависимая трансляция таких термо-IRES-элементов примерно на 50 % интенсивнее при 42 °С, чем при 30 °С. Впрочем, эффективность их трансляции всё равно меньше, чем у IRES дикого типа, которая не зависит от температуры[28].
Примечания
[править | править код]- ↑ 1 2 Barrett et. al., 2013, p. 14.
- ↑ 1 2 Balvay L., Soto Rifo R., Ricci E. P., Decimo D., Ohlmann T. Structural and functional diversity of viral IRESes. (англ.) // Biochimica et biophysica acta. — 2009. — Vol. 1789, no. 9-10. — P. 542—557. — doi:10.1016/j.bbagrm.2009.07.005. — PMID 19632368.
- ↑ Colussi T. M., Costantino D. A., Zhu J., Donohue J. P., Korostelev A. A., Jaafar Z. A., Plank T. D., Noller H. F., Kieft J. S. Initiation of translation in bacteria by a structured eukaryotic IRES RNA. (англ.) // Nature. — 2015. — Vol. 519, no. 7541. — P. 110—113. — doi:10.1038/nature14219. — PMID 25652826.
- ↑ Pelletier J., Sonenberg N. Internal initiation of translation of eukaryotic mRNA directed by a sequence derived from poliovirus RNA. (англ.) // Nature. — 1988. — Vol. 334, no. 6180. — P. 320—325. — doi:10.1038/334320a0. — PMID 2839775.
- ↑ Jang S. K., Kräusslich H. G., Nicklin M. J., Duke G. M., Palmenberg A. C., Wimmer E. A segment of the 5' nontranslated region of encephalomyocarditis virus RNA directs internal entry of ribosomes during in vitro translation. (англ.) // Journal of virology. — 1988. — Vol. 62, no. 8. — P. 2636—2643. — PMID 2839690.
- ↑ 1 2 Kozak M. A second look at cellular mRNA sequences said to function as internal ribosome entry sites. (англ.) // Nucleic acids research. — 2005. — Vol. 33, no. 20. — P. 6593—6602. — doi:10.1093/nar/gki958. — PMID 16314320.
- ↑ 1 2 3 4 5 Barrett et. al., 2013, p. 15.
- ↑ Fitzgerald K. D., Semler B. L. Bridging IRES elements in mRNAs to the eukaryotic translation apparatus. (англ.) // Biochimica et biophysica acta. — 2009. — Vol. 1789, no. 9-10. — P. 518—528. — doi:10.1016/j.bbagrm.2009.07.004. — PMID 19631772.
- ↑ Barrett et. al., 2013, p. 14—15.
- ↑ Cobbold L. C., Spriggs K. A., Haines S. J., Dobbyn H. C., Hayes C., de Moor C. H., Lilley K. S., Bushell M., Willis A. E. Identification of internal ribosome entry segment (IRES)-trans-acting factors for the Myc family of IRESs. (англ.) // Molecular and cellular biology. — 2008. — Vol. 28, no. 1. — P. 40—49. — doi:10.1128/MCB.01298-07. — PMID 17967896.
- ↑ Thompson S. R. Tricks an IRES uses to enslave ribosomes. (англ.) // Trends in microbiology. — 2012. — Vol. 20, no. 11. — P. 558—566. — doi:10.1016/j.tim.2012.08.002. — PMID 22944245.
- ↑ Kieft J. S. Viral IRES RNA structures and ribosome interactions. (англ.) // Trends in biochemical sciences. — 2008. — Vol. 33, no. 6. — P. 274—283. — doi:10.1016/j.tibs.2008.04.007. — PMID 18468443.
- ↑ Brown, T.A. Genomes 3 (неопр.). — New York, New York: Garland Science Publishing, 2007. — С. 397. — ISBN 0 8153 4138 5.
- ↑ Hellen C. U., Sarnow P. Internal ribosome entry sites in eukaryotic mRNA molecules. (англ.) // Genes & development. — 2001. — Vol. 15, no. 13. — P. 1593—1612. — doi:10.1101/gad.891101. — PMID 11445534.
- ↑ Asnani M., Pestova T. V., Hellen C. U. Initiation on the divergent Type I cadicivirus IRES: factor requirements and interactions with the translation apparatus. (англ.) // Nucleic acids research. — 2016. — Vol. 44, no. 7. — P. 3390—3407. — doi:10.1093/nar/gkw074. — PMID 26873921.
- ↑ Filbin M. E., Kieft J. S. Toward a structural understanding of IRES RNA function. (англ.) // Current opinion in structural biology. — 2009. — Vol. 19, no. 3. — P. 267—276. — doi:10.1016/j.sbi.2009.03.005. — PMID 19362464.
- ↑ Niepmann M. Internal translation initiation of picornaviruses and hepatitis C virus. (англ.) // Biochimica et biophysica acta. — 2009. — Vol. 1789, no. 9-10. — P. 529—541. — doi:10.1016/j.bbagrm.2009.05.002. — PMID 19439208.
- ↑ Khong A., Bonderoff J. M., Spriggs R. V., Tammpere E., Kerr C. H., Jackson T. J., Willis A. E., Jan E. Temporal Regulation of Distinct Internal Ribosome Entry Sites of the Dicistroviridae Cricket Paralysis Virus. (англ.) // Viruses. — 2016. — Vol. 8, no. 1. — doi:10.3390/v8010025. — PMID 26797630.
- ↑ Chatterjee S., Pal J. K. Role of 5'- and 3'-untranslated regions of mRNAs in human diseases. (англ.) // Biology of the cell / under the auspices of the European Cell Biology Organization. — 2009. — Vol. 101, no. 5. — P. 251—262. — doi:10.1042/BC20080104. — PMID 19275763.
- ↑ Dibrov S. M., Parsons J., Carnevali M., Zhou S., Rynearson K. D., Ding K., Garcia Sega E., Brunn N. D., Boerneke M. A., Castaldi M. P., Hermann T. Hepatitis C virus translation inhibitors targeting the internal ribosomal entry site. (англ.) // Journal of medicinal chemistry. — 2014. — Vol. 57, no. 5. — P. 1694—1707. — doi:10.1021/jm401312n. — PMID 24138284.
- ↑ Komar A. A., Hatzoglou M. Exploring Internal Ribosome Entry Sites as Therapeutic Targets. (англ.) // Frontiers in oncology. — 2015. — Vol. 5. — P. 233. — doi:10.3389/fonc.2015.00233. — PMID 26539410.
- ↑ Jiang X., Kanda T., Nakamoto S., Saito K., Nakamura M., Wu S., Haga Y., Sasaki R., Sakamoto N., Shirasawa H., Okamoto H., Yokosuka O. The JAK2 inhibitor AZD1480 inhibits hepatitis A virus replication in Huh7 cells. (англ.) // Biochemical and biophysical research communications. — 2015. — Vol. 458, no. 4. — P. 908—912. — doi:10.1016/j.bbrc.2015.02.058. — PMID 25704089.
- ↑ Qian S., Fan W., Qian P., Zhang D., Wei Y., Chen H., Li X. Apigenin restricts FMDV infection and inhibits viral IRES driven translational activity. (англ.) // Viruses. — 2015. — Vol. 7, no. 4. — P. 1613—1626. — doi:10.3390/v7041613. — PMID 25835532.
- ↑ Hou H. Y., Lu W. W., Wu K. Y., Lin C. W., Kung S. H. Idarubicin is a broad-spectrum enterovirus replication inhibitor that selectively targets the virus internal ribosomal entry site. (англ.) // The Journal of general virology. — 2016. — Vol. 97, no. 5. — P. 1122—1133. — doi:10.1099/jgv.0.000431. — PMID 26879094.
- ↑ Buijs P. R., Verhagen J. H., van Eijck C. H., van den Hoogen B. G. Oncolytic viruses: From bench to bedside with a focus on safety. (англ.) // Human vaccines & immunotherapeutics. — 2015. — P. 0. — doi:10.1080/21645515.2015.1037058. — PMID 25996182.
- ↑ Ngoi S. M., Chien A. C., Lee C. G. Exploiting internal ribosome entry sites in gene therapy vector design. (англ.) // Current gene therapy. — 2004. — Vol. 4, no. 1. — P. 15—31. — PMID 15032611.
- ↑ Kolekar P., Pataskar A., Kulkarni-Kale U., Pal J., Kulkarni A. IRESPred: Web Server for Prediction of Cellular and Viral Internal Ribosome Entry Site (IRES). (англ.) // Scientific reports. — 2016. — Vol. 6. — P. 27436. — doi:10.1038/srep27436. — PMID 27264539.
- ↑ Garcia-Martin J. A., Dotu I., Fernandez-Chamorro J., Lozano G., Ramajo J., Martinez-Salas E., Clote P. RNAiFold2T: Constraint Programming design of thermo-IRES switches. (англ.) // Bioinformatics. — 2016. — Vol. 32, no. 12. — P. 360—368. — doi:10.1093/bioinformatics/btw265. — PMID 27307638.
Литература
[править | править код]- Lucy W. Barrett, Sue Fletcher, Steve D. Wilton. Untranslated Gene Regions and Other Non-coding Elements. — SpringerBriefs in Biochemistry and Molecular Biology, 2013. — 57 p. — ISBN 978-3-0348-0679-4.
Ссылки
[править | править код]Эта статья входит в число хороших статей русскоязычного раздела Википедии. |