Нитросоединения
Нитросоединения — органические соединения, содержащие одну или несколько нитрогрупп —NO2. Под нитросоединениями обычно подразумевают C-нитросоединения, в которых нитрогруппа связана с атомом углерода (нитроалканы, нитроалкены, нитроарены). O-нитросоединения и N-нитросоединения выделяют в отдельные классы — сложные эфиры (органические нитраты) и нитрамины[1].
Номенклатура
[править | править код]В зависимости от строения радикала R, различают алифатические (предельные и непредельные), ациклические, ароматические и гетероциклические нитросоединения. По характеру углеродного атома, с которым связана нитрогруппа, нитросоединения подразделяются на первичные, вторичные и третичные.
Нитросоединения изомерны эфирам азотистой кислоты HNO2 (R-ONO)
Строение нитрогруппы
[править | править код]
Нитрогруппа имеет плоскую конфигурацию. Атомы азота и кислорода находятся в состоянии sp2-гибридизации, а связи N-O равноценны (промежуточные между одинарной и двойной) и имеют длину 0,122 нм, угол O-N-O равен 127°, длина связи C-N составляет 0,147 нм. Атомы C, N, O лежат в одной плоскости.
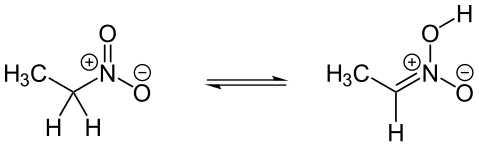
При наличии α-атомов водорода (в случае первичных и вторичных алифатических нитросоединений) возможна таутомерия между нитросоединениями и нитроновыми кислотами (аци-формами нитросоединений):
Получение
[править | править код]- Из галогенпроизводных (реакция Мейера):
- Нитрование
- Реакция Коновалова -- для алифатических углеводородов. Бывает неудобной по причине образования смеси нитросоединений:
- Нитрование ароматических углеводородов.
- Реакция Коновалова -- для алифатических углеводородов. Бывает неудобной по причине образования смеси нитросоединений:
- Окисление аминов
Физические свойства
[править | править код]Низшие нитроалканы являются бесцветными жидкостями, ароматические нитроалканы — бесцветными или желтоватыми легкоплавкими твёрдыми веществами со специфическим запахом, в воде практически нерастворимыми.
В УФ-спектрах алифатических нитросоединений обнаруживается интенсивная полоса с λmax=200-210 нм и слабая полоса при 270—280 нм. Для ароматических нитросоединений характерна полоса в районе 250—300 нм.
В ЯМР 1H-спектрах химические сдвиги для атома водорода в α-положении находятся в районе 4-6 м.д.
Химические свойства
[править | править код]- Реакции замещения
Нитрогруппа является одной из самых сильных электроноакцепторных групп. Поэтому в реакциях электрофильного замещения в ароматических соединениях направляет заместитель в мета-положение. Для алифатических соединений нитрогруппа также затрудняет реакции электрофильного замещения и облегчает реакции нуклеофильного замещения, что с успехом используется в органическом синтезе
По химическому поведению нитросоединения обнаруживают определенное сходство с азотной кислотой. Это сходство проявляется при окислительно-восстановительных реакциях.
- Восстановление нитросоединений (реакция Зинина)
- Реакции конденсации (реакция Анри)
- Таутомерия нитросоединений.
- Реакции с разрывом C-N связей
Первичные и вторичные нитросоединения способны отщеплять нитрогруппу, образуя соответствующие карбонильные соединения (реакция Нефа):
Важнейшие представители
[править | править код]- Тетранитрометан
- Нитроциклогексан
- Нитробензол
- Тринитротолуол(тротил)
- Нитронафталины
Применяют в производстве красителей, лекарственных препаратов, взрывчатых веществ.
Примечания
[править | править код]- ↑ nitro compounds // IUPAC Gold Book. Дата обращения: 24 мая 2011. Архивировано 11 февраля 2017 года.
Литература
[править | править код]- Кнунянц И. Л. и др. т.3 Мед-Пол // Химическая энциклопедия. — М.: Большая Российская Энциклопедия, 1992. — 639 с. — 50 000 экз. — ISBN 5-85270-039-8.


![{\displaystyle {\mathsf {RNO_{2}{\xrightarrow[{}]{[H]}}RNH_{2}+2H_{2}O}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/bcf2254a7da3dc072b4871cfa3fc17e2c4122cf2)
