Иодид бериллия
| Иодид бериллия | |
|---|---|
 | |
| Общие | |
| Систематическое наименование |
Иодид бериллия |
| Традиционные названия | Иодистый бериллий |
| Хим. формула | BeI2 |
| Рац. формула | BeI2 |
| Физические свойства | |
| Молярная масса | 262,821 г/моль |
| Плотность | 4,325 г/см³ |
| Термические свойства | |
| Температура | |
| • плавления | 480 °C |
| • кипения | 590 °C |
| Мол. теплоёмк. | 0,2705 Дж/(моль·К) |
| Энтальпия | |
| • образования | -0,7324 кДж/моль |
| Классификация | |
| Рег. номер CAS | 7787-53-3 |
| PubChem | 5463524 и 82231 |
| Рег. номер EINECS | 232-119-0 |
| SMILES | |
| InChI | |
| ChemSpider | 74209 |
| Приведены данные для стандартных условий (25 °C, 100 кПа), если не указано иное. | |
Иоди́д бери́ллия — неорганическое химическое соединение бериллия и иода с формулой BeI2. Относится к галогенидам. Иодид бериллия представляет собой бесцветные игольчатые кристаллы. В присутствии влаги или при растворении в воде соединение быстро гидролизирует, с выделением газообразного йодоводорода. Относится к иодидам, (см. также: галогениды) то есть солям йодоводородной кислоты HI.
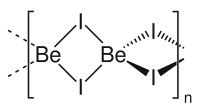
Связь Be-I в соединении практически ковалентная. В парах, вблизи температуры плавления, молекулы иодида бериллия преимущественно димерны (Be2I4).[1]
Как и все соединения бериллия, токсичен и канцерогенен.
Получение и свойства
[править | править код]Иодид бериллия может быть получен при взаимодействии металлического бериллия с элементарным йодом при температуре от 500 до 700°С[2]:
Также иодид бериллия образуется при термическом взаимодействии карбида бериллия с йодоводородом[1][3]:
Плавится BeI2 при ~480°С. Давление пара иодида бериллия очень велико, поэтому его кристаллы легко сублимируются при более низкой температуре.
Легко растворим в сероуглероде, хорошо растворим в безводном этиловом спирте.
Способность давать комплексы с нейтральными аддендами падает от хлорида бериллия к иодиду, поэтому для иодида бериллия известно лишь для небольшое количество комплексных соединений. Так иодид бериллия образует аммиакаты трех типов (для хлорида бериллия известно четыре).
Химические свойства
[править | править код]Иодид бериллия, вследствие гидролиза, бурно взаимодействует с водой:
Йод в иодиде бериллия может быть замещен другим галогеном. Поэтому иодид бериллия легко вступает в реакцию с фтором, образуя фторид бериллия и фториды йода, с хлором и бромом — образуя соответственно хлорида и бромид бериллия, а также иод:
Иодид бериллия легко реагирует с окислителями, такими как хлорат и перманганат калия, с образованием молекулярного йода.
При высоких температурах (порядка 750—900°С) иодид бериллия диссоциирует:
Применение
[править | править код]Иодид бериллия может быть использован при получении высокочистого бериллия путём разложением BeI2 на раскаленной вольфрамовой нити.[1]
Примечания
[править | править код]- ↑ 1 2 3 Химия и технология редких и рассеянных элементов: Учеб. пособие для вузов: Ч. I / Под ред. К. А. Большакова. — 2-е изд., перераб. и доп.- М.: Высшая школа, 1976. — С.184-185.
- ↑ Perry D.L., Phillips S. L. Handbook of Inorganic Compounds. — CRC Press, 1995. — Р. 63. — ISBN 0-8493-8671-3
- ↑ Parsons Ch. L. The Chemistry and Literature of Beryllium. — Chemical Publishing, 1909. — Р. 22.
В статье не хватает ссылок на источники (см. рекомендации по поиску). |
Это заготовка статьи о неорганическом веществе. Помогите Википедии, дополнив её. |






