Реакции радикального присоединения
Реакции радикального присоединения — реакции присоединения, в которых атаку осуществляют свободные радикалы — частицы, содержащие один или несколько неспаренных электронов. При этом радикалы могут атаковать как другие радикалы, так и нейтральные частицы.
Реакции радикального присоединения обозначают AdR.
Реакции свободно-радикального присоединения характерны для алкенов, которые всегда вступают в них вместо реакций электрофильного присоединения в присутствии источника свободных радикалов[1].
Механизм реакции[править | править код]
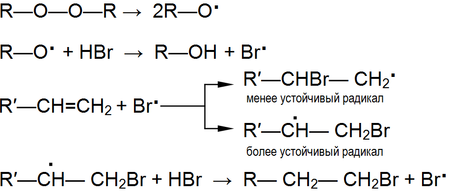
Механизм реакции радикального присоединения включает в себя следующие стадии:
- Первая стадия — инициирование цепи. Она может начаться спонтанно, фотохимически, электрохимически, посредством нагревания или путём химического инициирования[2].
- Вторая стадия — развитие цепи. На этой стадии радикалы реагируют с молекулами, образуя продукты реакции и новые радикалы.
- Третья стадия — обрыв цепи или рекомбинация свободных радикалов.
Реакции радикального замещения ускоряются в условиях генерирования свободных радикалов и замедляются в присутствии веществ, улавливающих свободные радикалы.
Радикальное присоединение идёт против правила Марковникова (эффект Караша). Вызвано это повышенной стабильностью третичных, аллильных и некоторых других радикалов, образующихся при присоединении атакующего радикала в определённую позицию в молекуле.
Этот раздел не завершён. |
Типовые реакции радикального присоединения[править | править код]
Возможность проведения присоединения по свободнорадикальному механизму реализуется только для HBr и в редких случаях для HCl[1].
2. Карбохлорирование.
3. Присоединение CCl4.
4. Присоединение карбоновых кислот.
Реакция идёт в присутствии ацилпероксидов и катализируется медью.
5. Присоединение гидросульфита натрия.
6. Термическое присоединение алканов.
7. Присоединение карбенов.
8. Реакция Симмонса-Смита.