Иммунохроматографический анализ
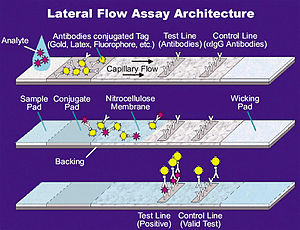
Иммунохроматографический анализ (ИХА) (англ. Lateral flow test) — иммунохимический метод анализа, основанный на принципе тонкослойной хроматографии и включающий реакцию между антигеном и соответствующем ему антителом в биологических материалах. Проводится с помощью специальных тест-полосок, панелей или тест-кассет.
Сущность метода[править | править код]
Принцип действия состоит в том, что при погружении тест-полоски в биологическую жидкость (или другой жидкий образец), она начинает мигрировать вдоль полоски по принципу тонкослойной хроматографии. Вместе с ней движутся нанесенные на нижнюю часть тест-полоски меченые специфические антитела, которые аффинно связываются с анализируемым веществом.
Различают 2 формы ИХА: прямой и конкурентный метод.
- В схеме прямого (сэндвичного) ИХА используется конъюгат антитела-метка, нанесенный на мембрану для конъюгата. На тестовой линии иммобилизованы антитела, специфические к данному аналиту, а на контрольной линии — антивидовые антитела, специфические к первичным антителам. При нанесении образца, содержащего анализируемое вещество, при попадании образца на мембрану с конъюгатом, происходит связывание аналита с конъюгатом Ат-метка. Затем иммунный комплекс попадает в тестовую зону, где он связывается со специфическими антителами, образуя «сэндвич» Ат-Аг-Ат-метка. Избыток несвязавшегося конъюгата связывается с антивидовыми антителами на контрольной линии. Таким образом, выявление 2 линий на тест-полоске является положительным результатом теста. При отсутствии аналита в образце конъюгат связывается с антивидовыми антителами только на контрольной линии, образуя одну линию на тест-полоске.
- Метод прямого ИХА используется для выявления высокомолекулярных соединений — вирусов, в том числе ВИЧ; различных гормонов (например, в тестах на беременность), возбудителей инфекционных заболеваний.
- Метод конкурентого ИХА, используемый для определения низкомолекулярных соединений, основан на конкуренции аналита и иммобилизованного конъюгата аналит: белок-носитель за ограниченное количество центров связывания специфических антител, содержащихся в конъюгате Ат-метка. При нанесении образца, содержащего аналит, он связывается с конъюгатом Ат-метка на мембране с конъюгатом. Далее иммунокомплекс проходит через тестовую зону, где иммобилизован конъюгат аналит: белок-носитель. Иммунокомплекс не может связаться с этим конъюгатом из-за стерических затруднений: низкомолекулярные соединения обычно имеют одну антигенную детерминанту и, соответственно, антитела имеют один центр связывания с антигеном, который уже является занятым аналитом. Далее иммунный комплекс связывают антивидовые антитела, находящиеся на контрольной линии. В результате, отсутствие окрашенной полосы в тестовой зоне и наличие окраски в контрольной зоне свидетельствует о том, что концентрация определяемого вещества в исследуемом образце превышает его пороговое значение для данного теста.
При отсутствии анализируемого вещества в образце, конъюгат Ат-метка связывается с конъюгатом Аг: белок-носитель, иммобилизованным в зоне тестовой линии. Несвязавшийся конъюгат Ат-метка попадает в зону контрольной линии и связывается там с антивидовыми антителами. Таким образом, наличие двух окрашенных линий (тестовой и контрольной) является отрицательным результатом анализа.
Форма конкурентного ИХА используется для выявления низкомолекулярных соединений, в том числе метаболитов наркотических соединений в моче, жидкости ротовой полости, экстрактах тканей.
Преимуществом метода является быстрота его и легкость его применения, возможность использования неприборных форм ИХА с визуальной оценкой результата анализа. В этом случае не требуется использование никакого оборудования и анализ может быть проведен неспециалистом в любых условиях, в том числе «полевых».
Существуют также приборные полуколичественные и количественные формы ИХА, в которых используются специальные ридеры для регистрации интенсивности метки в тестовой зоне тест-полоски.
Метки, используемые в ИХА[править | править код]
В качестве меток в ИХА используются различные частицы, обладающие следующими свойствами:
- Красящие вещества (нано-частицы коллоидного золота или углерода, или частицы окрашенного латекса). В этом случае используется визуальная детекция результата, либо приборное колориметрическое определение (или сканирование). Использование различных красящих меток, присоединенных к частицам латекса, позволяет проводить мильтианализ, в котором линии разного цвета соответствуют различным аналитам. Наиболее часто используемой меткой является нано-частицы коллоидного золота.
- Флуоресцентные, фосфоресцентные и биолюминисцентные метки, ковалентно связанные с частицами латекса. Эти метки используются только в приборных вариантах ИХА, когда результат регистрируется специальным считывателем (датчиком). Среди вышеуказанных наиболее распространены флуоресцентные метки.
- Парамагнитные метки (также закрепленные на частицах латекса). Данный вид меток используется в ИХА с применением приборов, регистрирующих силу магнитного поля.
- Ферментные метки используются по тому же принципу, что и в ИФА. Ферментативная реакция регистрируется с помощью окрашивания субстратов, и результат анализа является визуальным, или считывается с помощью датчика.
- Новым направлением в разработке различных разновидностях ИХА является использование липосом в качестве носителей различного рода меток (красящих, флуоресцентных, ферментативных, электроактивных и пр.).
Литература[править | править код]
- Raphael C. Wong l Harley Y. Tse (Editors) Lateral Flow Immunoassay. Springer, USA, 2009.
Ссылки[править | править код]
- Иммунохроматографический анализ (doc). Дата обращения: 1 января 2010. Архивировано 14 апреля 2012 года.