Пептидная связь: различия между версиями
| [непроверенная версия] | [непроверенная версия] |
Arevis95 (обсуждение | вклад) мНет описания правки |
Arevis95 (обсуждение | вклад) Нет описания правки Метка: редактор вики-текста 2017 |
||
| Строка 1: | Строка 1: | ||
[[Файл:Peptidformationball rus.svg|300px|thumb|Схема образования пептидной связи.]] |
[[Файл:Peptidformationball rus.svg|300px|thumb|Схема образования пептидной связи.]] |
||
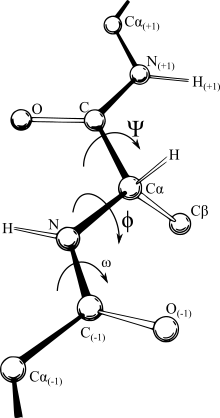
[[Файл:Protein backbone PhiPsiOmega drawing.svg|мини|Основные двугранные углы φ и ψ (и ω). ]] |
[[Файл:Protein backbone PhiPsiOmega drawing.svg|мини|Основные двугранные углы φ и ψ (и ω). Все три угла находятся под углом 180° в показанной конфигурации. ]] |
||
'''Пептидная связь''' — вид амидной связи, возникающей при образовании [[белок|белков]] и [[пептиды|пептидов]] в результате взаимодействия α-аминогруппы (—NH<SUB>2</SUB>) одной [[аминокислота|аминокислоты]] с α-карбоксильной группой (—СООН) другой аминокислоты. |
'''Пептидная связь''' — вид амидной связи, возникающей при образовании [[белок|белков]] и [[пептиды|пептидов]] в результате взаимодействия α-аминогруппы (—NH<SUB>2</SUB>) одной [[аминокислота|аминокислоты]] с α-карбоксильной группой (—СООН) другой аминокислоты. |
||
| Строка 6: | Строка 6: | ||
== Свойства пептидной связи == |
== Свойства пептидной связи == |
||
Как и в случае любых амидов, в пептидной связи за счет резонанса канонических структур связь C-N между углеродом карбонильной группы и атомом азота частично имеет характер двойной: |
Как и в случае любых амидов, в пептидной связи за счет резонанса канонических структур связь C-N между углеродом карбонильной группы и атомом азота частично имеет характер двойной: |
||
:[[Файл:Mesomeric peptide bond.svg|426x426px]] |
: [[Файл:Mesomeric peptide bond.svg|426x426px]] |
||
Это проявляется, в частности, в уменьшении её длины до 1,33 [[ангстрем]]а: |
Это проявляется, в частности, в уменьшении её длины до 1,33 [[ангстрем]]а: |
||
:[[Файл:Trans-Peptide Bond.png|400 px]] |
: [[Файл:Trans-Peptide Bond.png|400 px]] |
||
Это обусловливает следующие свойства: |
Это обусловливает следующие свойства: |
||
| Строка 17: | Строка 17: | ||
== Конформация полипептидов == |
== Конформация полипептидов == |
||
Углы φ и ψ могут принимать различные значения, и число возможных пространственных конфигураций для полипептидной цепи может быть бесконечно большим. Однако в реальных условиях ряд конфигураций не реализуется из-за пространственных затруднений. |
Углы φ и ψ могут принимать различные значения, и число возможных пространственных конфигураций для полипептидной цепи может быть бесконечно большим. Однако в реальных условиях ряд конфигураций не реализуется из-за пространственных затруднений. |
||
В пределах стерически дозволенных углов φ и ψ наиболее вероятна такая конфигурация пептидной цепи, при которой потенциальная энергия системы минимальна. Выигрыш потенциальной энергии происходит в результате целого ряда взаимодействий между атомами и атомными группами внутри полипептидной цепи (нековалентные взаимодействия, дипольные взаимодействия, торсионный потенциал). |
В пределах стерически дозволенных углов φ и ψ наиболее вероятна такая конфигурация пептидной цепи, при которой потенциальная энергия системы минимальна. Выигрыш потенциальной энергии происходит в результате целого ряда взаимодействий между атомами и атомными группами внутри полипептидной цепи (нековалентные взаимодействия, дипольные взаимодействия, торсионный потенциал). |
||
Версия от 10:57, 13 августа 2021

Пептидная связь — вид амидной связи, возникающей при образовании белков и пептидов в результате взаимодействия α-аминогруппы (—NH2) одной аминокислоты с α-карбоксильной группой (—СООН) другой аминокислоты.
Из двух аминокислот (1) и (2) образуется дипептид (цепочка из двух аминокислот) и молекула воды. По этой же схеме рибосома генерирует и более длинные цепочки из аминокислот: полипептиды и белки. Разные аминокислоты, которые являются «строительными блоками» для белка, отличаются радикалом R.
Свойства пептидной связи
Как и в случае любых амидов, в пептидной связи за счет резонанса канонических структур связь C-N между углеродом карбонильной группы и атомом азота частично имеет характер двойной:
Это проявляется, в частности, в уменьшении её длины до 1,33 ангстрема:
Это обусловливает следующие свойства:
- 4 атома связи (C, N, O и H) и 2 α-углерода находятся в одной плоскости. R-группы аминокислот и водороды при α-углеродах находятся вне этой плоскости.
- H и O в пептидной связи, а также α-углероды двух аминокислот транс-ориентированы (транс-изомер более устойчив). В случае L-аминокислот, что имеет место во всех природных белках и пептидах, R-группы также транс-ориентированы.
- В случае полипептида вращение возможно вокруг связи около азота (N-C, угол вращения обозначен как ψ) или между углеродами каждого пептидного звена (C-C, угол вращения обозначен как φ), но невозможно в месте соединения звеньев из-за их частично двойного характера связи.
Конформация полипептидов
Углы φ и ψ могут принимать различные значения, и число возможных пространственных конфигураций для полипептидной цепи может быть бесконечно большим. Однако в реальных условиях ряд конфигураций не реализуется из-за пространственных затруднений.
В пределах стерически дозволенных углов φ и ψ наиболее вероятна такая конфигурация пептидной цепи, при которой потенциальная энергия системы минимальна. Выигрыш потенциальной энергии происходит в результате целого ряда взаимодействий между атомами и атомными группами внутри полипептидной цепи (нековалентные взаимодействия, дипольные взаимодействия, торсионный потенциал).
Существует некоторое минимальное расстояние между центрами атомов, при котором их дальнейшее сближение невозможно. Эти расстояния, оценены в основном по данным кристаллографии[1].
Для обнаружения белков и пептидов, а также их количественного определения в растворе используют биуретовую реакцию.
Примечания
- ↑ Stereochemistry of polypeptide chain configurations (англ.) // Journal of Molecular Biology. — 1963-07-01. — Vol. 7, iss. 1. — P. 95–99. — ISSN 0022-2836. — doi:10.1016/S0022-2836(63)80023-6.
В статье не хватает ссылок на источники (см. рекомендации по поиску). |
Это заготовка статьи по органической химии. Помогите Википедии, дополнив её. |

