Mad2
Необходимо проверить качество перевода, исправить содержательные и стилистические ошибки. |

Mad2 (митотический дефицитный блокатор 2) является важным белком контрольной точки веретена деления. Система контрольной точки веретена деления является системой регулирования, сдерживающей прогрессирование перехода от метафазы к анафазе. Ген Mad2 был впервые выявлен в дрожжах S. cerevisiae в скрининге для генов, мутированных для придания им чувствительности к ядам микротрубочек[1]. Человеческие ортологи Mad2 (MAD2L1 и MAD2L2) были впервые выделены в поисках человеческих кДНК, которые спасают микротрубочки ядочувствительного штамма дрожжей, в котором отсутствовал белок, связывающий кинетохор[2]. Было показано, что белок был представлен в одиноких кинетохорах, и исследование ингибирования антител показало, что он имеет важное значение для выполнения блока перехода от метафазы к анафазе в ответ на отравление микротрубочек нокодазолом[2]. После выделения ортолога Xenopus Laevis , подобного человеческим последовательностям, появилась возможность охарактеризовать митотическую контрольную точку в экстрактах яиц[3].
Переход от метафазы к анафазе
[править | править код]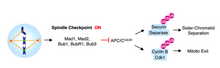
Прогрессирование от метафазы к анафазе отмечается разделением сестринских хроматид. Механизм слежения клеточного цикла, который предотвращает разделение сестринских хроматид и переход в анафазу называется контрольной точкой веретена деления. В качестве меры против ошибок хромосом, контрольная точка сборки веретена деления (SАС) задерживает анафазу, пока все пары сестринских хроматид не будут биполярно приложены.
После того, как микротрубочки присоединены к кинетохорам, хромосомы выравниваются на метафазной пластине и достигается биориентации, механизм остановки SAC удаляется. Вход в анафазу опосредуется активацией APCCdc20. APCCdc20 является убиквитинпротеинлигазой, которая метит белок, секурин для уничтожения. Уничтожение секурина освобождает и активирует сепаразу. Сепараза, связанная с секурином остается блокированной; однако, когда ингибирование освобождено, активированная сепараза расщепляет комплекс кохезина, который связывает сестринские хроматиды вместе[5].
Без Cdc20, комплекс стимуляции анафазы (APC) не может активироваться и анафаза не наступает. Mad2, как было показано, ингибируют активность APC путём прямого физического взаимодействия[6] в тройном комплексе с Cdc20[7]. Кинетохоры, к которым остаются привязаны микротрубочки, катализируют секвестр Cdc20 с помощью Mad2. В самом деле, когда в метафазе клетки млекопитающих обрабатывают агент, деполимеризующий веретено деления, нокодазол, белки MAD2 становятся локализованными на кинетохорах всеми парами сестринских хроматид[5].
Конформеры Mad2
[править | править код]![[4]](http://upload.wikimedia.org/wikipedia/commons/0/0b/Mad2conformers.png)
Mad2 способен образовывать мультимеры и принимает по меньшей мере две структурных конформации. Открытый Mad2 отличается от закрытого Mad2 в позиционировании 50 остатков С-концевого[англ.] сегмента. Этот «ремень безопасности» плотно прижимался к правой стороне белка в открытой конформации. После ослабления, сегмент может быть повторно установлен партнером связывания. В закрытой конформации, "ремень безопасности" обтекает связанный лиганд и взаимодействует с другой областью Mad2. Связывающими партнерами Mad2 могут быть либо Cdc20 либо Mad1. Mad1 и Cdc20 связывают Mad2 идентичным образом. Mad2 использует один и тот же сайт для связывания либо Mad1 либо Cdc20 и, таким образом, может связывать только один из двух белков одновременно[5].
Активация Mad2 в контрольной точке сборки веретена деления
[править | править код]
Так как одинокие кинетохоры устанавливют и поддерживают SAC, Mad2 рекрутируется для предотвращения от разделения этих неупорядоченных сестринских хроматид. Когда процесс торможения контрольных точек активирован, Mad2 связывает Mad1, формируя замкнутый Mad2-Mad1 комплекс. Учитывая, что Mad1:Mad2 — устойчивый комплекс и CDC20 и MAD1 связывает Mad2 в том же самом сайте связывания, то крайне маловероятно, что закрытый Mad2 освободит Mad1 для связывания с Cdc20.
Модель, объясняющая конформацию Mad2, способную связываться с Cdc20, опирается на первичность формирование основного комплекса Mad1-Mad2. В этой модели, внешний открытый Mad2 рекрутируется в матрицу Mad1: Mad2. Это Mad2: Mad2 взаимодействие необходимо, чтобы разрешить конформационные изменения, которые позволяют периферии, связанной с открытым Mad2, взаимодействовать с Cdc20. Cdc20: Mad2 тогда распадается и Mad1:Mad2 может снова связывать свободный цитозольный Mad2[8].
Предполагается, что когда-то образованные Cdc20:Mad2 комплексы могут усиливать сигнал ожидания анафазы, стимулируя дальнейшее преобразование цитозольного открытого Mad2 и свободного Cdc20 в Cdc20: закрытый Mad2 комплекс. Эта диффузии распространения сигнала от кинетохорных комплексов может объяснить, как вакансия только одного крошечного сайта кинетохора может полностью закрыть переход от метафазы к анафазе[9].
Будущие цели исследований
[править | править код]Многое ещё предстоит объяснить о сигнализации контрольной точки веретена деления и вклад других сборочных белков контрольной точки веретена деления, таких как Bub1, BubR1 и Bub3. BubR1 и Bub3 также могут образовывать комплексы с Cdc20, но это ещё предстоит увидеть, если этим белкам облегчить связывания Cdc20 с открытым Mad2[9].
Также весьма неясно, как p31comet противодействует контрольной точке и способствует диссоциации Mad2-Cdc20. Де Антони и др. предполагают, что в сочетании с «матрицей Mad2», p31comet конкурирует с открытым Mad2 за связывание с закрытым Mad2: Mad1. Тестирование ведется для того, чтобы осветить, как p31comet может заставить замолчать контрольные точки веретена деления[10].
Примечания
[править | править код]- ↑ Li R., Murray A. W. Feedback control of mitosis in budding yeast (англ.) // Cell. — Cell Press, 1991. — Vol. 66, no. 3. — P. 519—531. — doi:10.1016/0092-8674(81)90015-5. — PMID 1651172.
- ↑ 1 2 Li Y., Benezra R. Identification of a human mitotic checkpoint gene: hsMAD2 (англ.) // Science : journal. — 1996. — Vol. 274, no. 5285. — P. 246—248. — doi:10.1126/science.274.5285.246. — PMID 8824189.
- ↑ Chen R. H., Waters J. C., Salmon E. D., Murray A. W. Association of spindle assembly checkpoint component XMAD2 with unattached kinetochores (англ.) // Science : journal. — 1996. — October (vol. 274, no. 5285). — P. 242—246. — doi:10.1126/science.274.5285.242. — PMID 8824188.
- ↑ 1 2 Yu H. Structural activation of Mad2 in the mitotic spindle checkpoint: the two-state Mad2 model versus the Mad2 template model (англ.) // J. Cell Biol.[англ.] : journal. — 2006. — April (vol. 173, no. 2). — P. 153—157. — doi:10.1083/jcb.200601172. — PMID 16636141. — PMC 2063805.
- ↑ 1 2 3 Morgan D. L. The cell cycle: principles of control (англ.). — London: Published by New Science Press in association with Oxford University Press, 2007. — ISBN 0-87893-508-8.
- ↑ Li Y., Gorbea C., Mahaffey D., Rechsteiner M., Benezra R. MAD2 associates with the cyclosome/anaphase-promoting complex and inhibits its activity (англ.) // Proceedings of the National Academy of Sciences of the United States of America : journal. — 1997. — November (vol. 94, no. 23). — P. 12431—12436. — doi:10.1073/pnas.94.23.12431. — PMID 9356466. — PMC 24983.
- ↑ Wassmann K., Benezra R. Mad2 transiently associates with an APC/p55Cdc complex during mitosis (англ.) // Proceedings of the National Academy of Sciences of the United States of America : journal. — 1998. — September (vol. 95, no. 19). — P. 11193—11198. — doi:10.1073/pnas.95.19.11193. — PMID 9736712. — PMC 21618.
- ↑ Hardwick K. G. Checkpoint signalling: Mad2 conformers and signal propagation (англ.) // Curr. Biol. : journal. — 2005. — February (vol. 15, no. 4). — P. R122—4. — doi:10.1016/j.cub.2005.02.008. — PMID 15723780.
- ↑ 1 2 Nasmyth K. How do so few control so many? (англ.) // Cell. — Cell Press, 2005. — March (vol. 120, no. 6). — P. 739—746. — doi:10.1016/j.cell.2005.03.006. — PMID 15797376.
- ↑ De Antoni A., Pearson C. G., Cimini D., Canman J. C., Sala V., Nezi L., Mapelli M., Sironi L., Faretta M., Salmon E. D., Musacchio A. The Mad1/Mad2 complex as a template for Mad2 activation in the spindle assembly checkpoint (англ.) // Curr. Biol. : journal. — 2005. — February (vol. 15, no. 3). — P. 214—225. — doi:10.1016/j.cub.2005.01.038. — PMID 15694304.