Главный комплекс гистосовместимости: различия между версиями
| [отпатрулированная версия] | [непроверенная версия] |
BsivkoBot (обсуждение | вклад) |
Tatsan (обсуждение | вклад) Описала главные гены МНС, добавила библиографию |
||
| Строка 1: | Строка 1: | ||
'''Главный комплекс [[Гистосовместимость|гистосовместимости]]''' (ГКГС, {{lang-en|MHC, major histocompatibility complex}}) — большая область [[геном]]а или большое семейство [[ген]]ов, обнаруженное у позвоночных и играющее важную роль в иммунной системе и развитии [[иммунитет (биология)|иммунитета]]. |
'''Главный комплекс [[Гистосовместимость|гистосовместимости]]''' (ГКГС, {{lang-en|MHC, major histocompatibility complex}}) — большая область [[геном]]а или большое семейство [[ген]]ов, обнаруженное у позвоночных и играющее важную роль в иммунной системе и развитии [[иммунитет (биология)|иммунитета]]. Название «комплекс гистосовместимости» эта область получила потому, что обнаружена она была при исследовании отторжения чужеродных тканей. Сразу же возник вопрос, зачем организму нужна система распознавания чужих тканей? Вряд ли эволюция предусмотрела пересадку кожи, почек или сердца. Изучение свойств и функций продуктов генов МНС показало, что отторжение трансплантанта организмом при несовпадении их МНС является экспериментальным артефактом, маскирующим истинную функцию МНС - презентацию антигена лимфоцитам для распознавания и удаления собственных измененных клеток. |
||
Эволюционно МНС возник 450 миллионов лет назад вместе с появлением челюстноротых рыб ([[Латинский язык|лат.]] ''Gnathostomata''). Если у бесчелюстных рыб приобретенный иммунитет основан на вариабельных лимфоцитарных рецепторах ([[:en:Variable_lymphocyte_receptor|VLR]]), Т-подобных и В-подобных рецепторах, то у челюстноротых появились иммуноглобулины [[Тяжёлые цепи иммуноглобулинов|(Ig]]), Т клеточные рецепторы ([[Т-клеточный рецептор|TCR]]) и МНС. <ref>{{Статья|ссылка=https://www.frontiersin.org/article/10.3389/fimmu.2019.02292/full|автор=Nicole C. Smith, Matthew L. Rise, Sherri L. Christian|заглавие=A Comparison of the Innate and Adaptive Immune Systems in Cartilaginous Fish, Ray-Finned Fish, and Lobe-Finned Fish|год=2019-10-10|издание=Frontiers in Immunology|том=10|страницы=2292|issn=1664-3224|doi=10.3389/fimmu.2019.02292}}</ref> |
|||
=== Гены === |
|||
Главный комплекс [[гистосовместимость|гистосовместимости]] является регионом с одной из самых высоких плотностей локализации генов. У человека 1 ген приходится на 18000 пар нуклеотидов.<ref name=":0">{{Статья|ссылка=https://www.ncbi.nlm.nih.gov/pubmed/10553908|заглавие=Complete sequence and gene map of a human major histocompatibility complex. The MHC sequencing consortium|год=1999-10-28|издание=Nature|том=401|выпуск=6756|страницы=921–923|issn=0028-0836|doi=10.1038/44853}}</ref> Но еще плотнее расположены МНС гены у птиц. У курицы средний размер интронов в МНС-локусе составляет 200 оснований, а расстояние между генами, включая промоторы, может быть всего 30 оснований, что приводит к среднему размеру гена кур в три раза меньше, чем размер аналогичных генов млекопитающих.<ref name=":1">{{Статья|ссылка=https://www.ncbi.nlm.nih.gov/pubmed/10553909|автор=J. Kaufman, S. Milne, T. W. Göbel, B. A. Walker, J. P. Jacob|заглавие=The chicken B locus is a minimal essential major histocompatibility complex|год=1999-10-28|издание=Nature|том=401|выпуск=6756|страницы=923–925|issn=0028-0836|doi=10.1038/44856}}</ref> |
|||
У человека область МНС исторически называется [[Человеческий лейкоцитарный антиген]] ([[Английский язык|англ.]] ''HLA, Human Leucocyte Antigen)'', поскольку открыта она была при изучении различий клеток белой крови у разных людей, у свиней она носит название SLA (Swine Leucocyte Antigen), у собак DLA, у коров BoLA, у мышей – область H-2, у крыс - RT1, у кур – В и т.д.. У разных организмов они находятся на разных хромосомах, имеют разную длину и включают разное число генов, но общее устройство у всех похоже. Самая изученная МНС область – человеческая HLA находится на коротком плече хромосомы 6 между генетическими маркерами ''MOG'' и ''COL11A2'' и составляет около 4 млн пар нуклеотидов (6р21.1-21.3). HLA содержит более 200 генов, многие из которых чрезвычайно полиморфны. Не все эти гены связаны с иммунитетом, у человека лишь 40% генов HLA кодируют белки, вовлеченные в иммунный ответ<ref name=":0" />. И наоборот, есть много белков иммунной системы, чьи гены расположены на других хромосомах, например, гены Т-клеточного рецептора находятся на хромосоме 14, гены интерферонов на хромосомах 9 и 12 и т.д. |
|||
В HLA выделяют три подобласти; если считать от теломеры, то сначала идет область, называемая класс I, затем класс III и класс II. У других организмов последовательность классов может быть другой. У рыб класс II вообще находится на другой хромосоме.<ref>{{Статья|ссылка=https://www.ncbi.nlm.nih.gov/pubmed/12493009|автор=Jerzy K. Kulski, Takashi Shiina, Tatsuya Anzai, Sakae Kohara, Hidetoshi Inoko|заглавие=Comparative genomic analysis of the MHC: the evolution of class I duplication blocks, diversity and complexity from shark to man|год=2002-12|издание=Immunological Reviews|том=190|страницы=95–122|issn=0105-2896|doi=10.1034/j.1600-065x.2002.19008.x}}</ref> |
|||
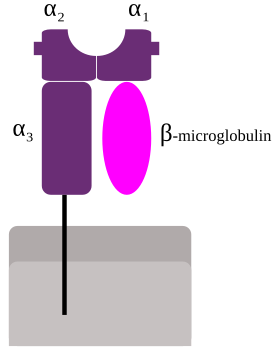
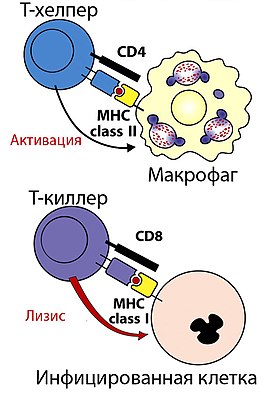
Два набора генов, класса I и II, кодирующие так называемые MHC класс I и MHC класс II молекулы, являются центральными игроками клеточного иммунитета. Основная функция МНС-I и МНС-II молекул - связывание пептидных фрагментов, полученных при внутриклеточном расщеплении белковых молекул, и презентация этих пептидов на поверхности клеток для распознавания Т- и NK- клеточными рецепторами. В большинстве своем это пептиды собственных белков, если же в организм попал патоген, то на поверхности клеток будут присутствовать и пептиды из чужих белков. Несмотря на то, что доля чужих пептидов на клеточной поверхности очень мала (одна молекула на десятки и сотни тысяч своих пептидов), такие зараженные клетки быстро распознаются Т-лимфоцитами и разрушаются иммунной системой. Презентация собственных белков на поверхности клеток чрезвычайно важна, иммунная система постоянно отслеживает и уничтожает не только инфицированные, но и поврежденные или измененные клетки <ref>{{Статья|ссылка=https://www.ncbi.nlm.nih.gov/pubmed/18425103|автор=Klas Kärre|заглавие=Natural killer cell recognition of missing self|год=2008-05|издание=Nature Immunology|том=9|выпуск=5|страницы=477–480|issn=1529-2916|doi=10.1038/ni0508-477}}</ref><ref>{{Статья|ссылка=https://www.ncbi.nlm.nih.gov/pubmed/27614798|автор=Kenneth L. Rock, Eric Reits, Jacques Neefjes|заглавие=Present Yourself! By MHC Class I and MHC Class II Molecules|год=11 2016|издание=Trends in Immunology|том=37|выпуск=11|страницы=724–737|issn=1471-4981|doi=10.1016/j.it.2016.08.010}}</ref>. |
|||
Два свойства белков МНС являются очень важными при использования их в приобретенном иммунитете. Во-первых, полигенность: каждый организм имеет несколько генов МНС. Так например, у каждого человека есть три гена комплекса МНС-I, [[HLA|HLA-А]], [[HLA|HLA-В]] и [[Человеческий лейкоцитарный антиген|HLA-С]]. Во-вторых, полиморфность – в популяции существует множество вариантов каждого гена, так для HLA-А на 2020 год извесно 5907 аллелей, кодирующих 3702 разных белковых молекул. Просмотреть все описанные варианты молекул HLA можно в базе данных [http://www.imgt.org IMGT] (www.imgt.org). |
|||
Наряду с классическими молекулами МНС-I, HLA-А, HLA-В и HLA-С в области класс I есть гены так называемых неклассических комплексов HLA: [[:en:MHC_class_I_polypeptide-related_sequence_A|MICA]], [[:en:MHC_class_I_polypeptide-related_sequence_B|MICB]], [[:en:HLA-E|HLA-Е]], [[:en:HLA-F|HLA-F]] и [[:en:HLA-G|HLA-G]], отличающихся от классических меньшей полиморфностью и меньшим уровнем экспрессии. MICA (MHC class I polypeptide-related sequence A) кодирует мембранно-связанный гликопротеин, чья экспрессия вызывается стрессом - температурой, вирусной или бактериальной инфекцией, онкогенной трансформацией и пр.<ref>{{Статья|ссылка=https://www.ncbi.nlm.nih.gov/pubmed/25330802|автор=Dan Chen, Ulf Gyllensten|заглавие=MICA polymorphism: biology and importance in cancer|год=2014-12|издание=Carcinogenesis|том=35|выпуск=12|страницы=2633–2642|issn=1460-2180|doi=10.1093/carcin/bgu215}}</ref> MICA является самым полиморфным из неклассических HLA, у человека описано более 150 вариантов ([http://www.imgt.org IMGT]). MICA является лигандом рецептора [[:en:NKG2D|CD94/NKG2D]], который экспрессируется на NK-клетках и некоторых Т-лимфоцитах. При связывании с MICA CD94/NKG2D активирует цитолитическую активность этих клеток. Таким образом, MICA является сигналом иммунной системе на раннюю реакцию в ответ на инфекцию иди спонтанное возникновение модифицированных раковых клеток. HLA-Е связывает обычно сигнальные пептиды классических HLA-А, В и С и служит лигандом NK-клеточных рецепторов CD94/NKG2A или CD94/NKG2B, ингибируя их цитотоксическую активность <ref>{{Статья|ссылка=https://www.ncbi.nlm.nih.gov/pubmed/30386347|автор=Alexander Rölle, Dirk Jäger, Frank Momburg|заглавие=HLA-E Peptide Repertoire and Dimorphism-Centerpieces in the Adaptive NK Cell Puzzle?|год=2018|издание=Frontiers in Immunology|том=9|страницы=2410|issn=1664-3224|doi=10.3389/fimmu.2018.02410}}</ref>. HLA-G экспрессируется только на зародышевых клетках плаценты, играя важную роль в иммунотолерантности при беременности<ref>{{Статья|ссылка=https://www.ncbi.nlm.nih.gov/pubmed/31558330|автор=Gry Persson, Nanna Jørgensen, Line Lynge Nilsson, Lærke Heidam J. Andersen, Thomas Vauvert F. Hviid|заглавие=A role for both HLA-F and HLA-G in reproduction and during pregnancy?|год=2019-09-24|издание=Human Immunology|issn=1879-1166|doi=10.1016/j.humimm.2019.09.006}}</ref> |
|||
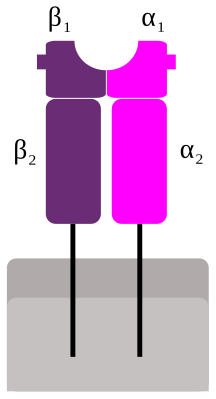
В отличие от комплексов МНС-I, белки МНС-II экспрессируются исключительно в так называемых профессиональных антиген-презентирующих клетках (АРС). К ним относятся дендритные клетки, В-клетки и макрофаги. МНС-II – гетеродимеры, гены обоих цепей принадлежат МНС локусу. Шесть генов человеческих МНС-II носят названия HLA-DRA(B), HLA-DQA(B) и HLA-DPA(B). |
|||
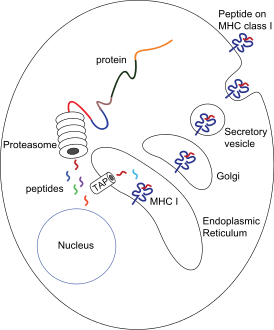
Кроме МНС-I и МНС-II в этом же локусе расположены гены других белков, участвующих в презентации антигена. Два гена каталитической β-субъединицы протеосомы, PSMB8 и PSMB9 начинают экспрессироваться только в том случае, если клетка получила сигнал о наличии в среде гамма-интерферона. Замена каталитических субъединиц превращает протеосому в иммунопротеосому с измененной протеолитической специфичностью. Иммунопротеосома выпускает пептиды с гидрофобной или основной аминокислотой на С-конце, имеющие большее сродство к МНС- I <ref>{{Статья|ссылка=https://www.ncbi.nlm.nih.gov/pubmed/8066462|автор=K. Akiyama, K. Yokota, S. Kagawa, N. Shimbara, T. Tamura|заглавие=cDNA cloning and interferon gamma down-regulation of proteasomal subunits X and Y|год=1994-08-26|издание=Science (New York, N.Y.)|том=265|выпуск=5176|страницы=1231–1234|issn=0036-8075|doi=10.1126/science.8066462}}</ref>. |
|||
Рядом с PSMB8 и PSMB9 находятся гены ТАР1 и ТАР2, кодирующие два субъединицы транспортера пептидов через мембрану эндоплазматического о. ТАР1 и ТАР2 не только переносят пептиды в ЭР, но и помогают им свзаться с МНС-I. В этом им помогает тапазин, чей ген ТАРВР тоже находится в области класс II геномного локуса HLA. |
|||
Пептиды комплекса МНС-II получаются из лизосомального, а не протеосомного расщепления. Ген HLA-DM кодирует белок DM, который катализирует связывание пептидов с МНС-II. Рядом находится HLA-DО, ген отрицательного регулятора HLA-DM. |
|||
Локус HLA содержит также гены трех цитокинов семейства [[Фактор некроза опухоли|фактора некроза опухоли]], TNF, гены белков [[Система комплемента|системы комплемента]] (С2, С4а, С4b, CFВ) и много других генов, чьи продукты не связаны напрямую с иммунной системой, например, CYP21P - один из цитохромов Р450, POU5F1 и TCF19 - факторы транскрипции, AGER – регулятор многих клеточных процессов, Hsp70 и т.д. |
|||
Описание МНС человека с полным секвенированием и аннотацией генов было опубликовано в 1999 году в журнале Nature центрами секвенирования Великобритании, США и Японии<ref name=":0" />. Представленная последовательность называлась виртуальной МНС, поскольку это была мозаика, составленная из кусков генома людей с разными гаплотипами. |
|||
В том же номере журнала Nature было опубликовано описание куриной МНС, которая в 20 раз короче человеческой и включает только 19 генов<ref name=":1" />. В-локус кур имеет все признаки МНС: там расположены гены классических МНС- I и МНС-II молекул, он определяет тканевую специфичность и иммунный ответ. МНС-локус кур гораздо компактнее человеческого, центральная его область от гена класс II до гена класс I молекул имеет всего 44 000 оснований, хотя содержит 11 генов. Порядок генов другой, класс I и класс II области не разделены длинной класс III областью (Рис-?). Почти все гены В-локуса кур имеют ортологов у млекопитающих, но много генов, имеющихся в МНС областях млекопитающих, отсутствуют у кур. В В-области кур есть всего два гена молекул МНС-I и МНС-II, отсутствуют DN и DOB, нет генов каталитических субъединиц протеасом, ген неполиморфной субъединицы МНС- II, ''class IIa'' находится вне В-локуса. Зато присутствуют гены лектина и NK-рецептора, которые у млекопитающих находятся на другой хромосоме. |
|||
Секвенирование МНС локуса перепелов<ref>{{Статья|ссылка=https://www.ncbi.nlm.nih.gov/pubmed/12493009|автор=Jerzy K. Kulski, Takashi Shiina, Tatsuya Anzai, Sakae Kohara, Hidetoshi Inoko|заглавие=Comparative genomic analysis of the MHC: the evolution of class I duplication blocks, diversity and complexity from shark to man|год=2002-12|издание=Immunological Reviews|том=190|страницы=95–122|issn=0105-2896|doi=10.1034/j.1600-065x.2002.19008.x}}</ref> показало похожую, но более сложную организацию из-за нескольких дупликаций. Так у перепелов есть семь генов молекул МНС класс I, семь генов b-цепи МНС класс II и 8 BG-подобных генов. |
|||
Секвенированы МНС-локусы нескольких рыб<ref>{{Статья|ссылка=https://www.ncbi.nlm.nih.gov/pubmed/12493009|автор=Jerzy K. Kulski, Takashi Shiina, Tatsuya Anzai, Sakae Kohara, Hidetoshi Inoko|заглавие=Comparative genomic analysis of the MHC: the evolution of class I duplication blocks, diversity and complexity from shark to man|год=2002-12|издание=Immunological Reviews|том=190|страницы=95–122|issn=0105-2896|doi=10.1034/j.1600-065x.2002.19008.x}}</ref>. У всех у них класс II и класс I области не связаны между собой и находятся на разных хромосомах. В отличие от птиц, рыбы, как и млекопитающие, имеют в МНС области гены каталитических субъединиц протеасом, но они расположены в области класс I, вместе с генами транспортера ТАР, ТАРВР. Количество генов классических МНС у разных рыб разное, например, у [[фугу]] девять генов молекул МНС класс I, а у [[данио]] их только три. |
|||
База данных IMGT (International Immunogenetics information system) содержит информацию о нуклеотидных последовательностях MHC локусов 77 разных видов (2019-12-19) |
|||
{{Анатомическая карточка |
{{Анатомическая карточка |
||
Версия от 11:38, 12 марта 2020
Главный комплекс гистосовместимости (ГКГС, англ. MHC, major histocompatibility complex) — большая область генома или большое семейство генов, обнаруженное у позвоночных и играющее важную роль в иммунной системе и развитии иммунитета. Название «комплекс гистосовместимости» эта область получила потому, что обнаружена она была при исследовании отторжения чужеродных тканей. Сразу же возник вопрос, зачем организму нужна система распознавания чужих тканей? Вряд ли эволюция предусмотрела пересадку кожи, почек или сердца. Изучение свойств и функций продуктов генов МНС показало, что отторжение трансплантанта организмом при несовпадении их МНС является экспериментальным артефактом, маскирующим истинную функцию МНС - презентацию антигена лимфоцитам для распознавания и удаления собственных измененных клеток.
Эволюционно МНС возник 450 миллионов лет назад вместе с появлением челюстноротых рыб (лат. Gnathostomata). Если у бесчелюстных рыб приобретенный иммунитет основан на вариабельных лимфоцитарных рецепторах (VLR), Т-подобных и В-подобных рецепторах, то у челюстноротых появились иммуноглобулины (Ig), Т клеточные рецепторы (TCR) и МНС. [1]
Гены
Главный комплекс гистосовместимости является регионом с одной из самых высоких плотностей локализации генов. У человека 1 ген приходится на 18000 пар нуклеотидов.[2] Но еще плотнее расположены МНС гены у птиц. У курицы средний размер интронов в МНС-локусе составляет 200 оснований, а расстояние между генами, включая промоторы, может быть всего 30 оснований, что приводит к среднему размеру гена кур в три раза меньше, чем размер аналогичных генов млекопитающих.[3]
У человека область МНС исторически называется Человеческий лейкоцитарный антиген (англ. HLA, Human Leucocyte Antigen), поскольку открыта она была при изучении различий клеток белой крови у разных людей, у свиней она носит название SLA (Swine Leucocyte Antigen), у собак DLA, у коров BoLA, у мышей – область H-2, у крыс - RT1, у кур – В и т.д.. У разных организмов они находятся на разных хромосомах, имеют разную длину и включают разное число генов, но общее устройство у всех похоже. Самая изученная МНС область – человеческая HLA находится на коротком плече хромосомы 6 между генетическими маркерами MOG и COL11A2 и составляет около 4 млн пар нуклеотидов (6р21.1-21.3). HLA содержит более 200 генов, многие из которых чрезвычайно полиморфны. Не все эти гены связаны с иммунитетом, у человека лишь 40% генов HLA кодируют белки, вовлеченные в иммунный ответ[2]. И наоборот, есть много белков иммунной системы, чьи гены расположены на других хромосомах, например, гены Т-клеточного рецептора находятся на хромосоме 14, гены интерферонов на хромосомах 9 и 12 и т.д.
В HLA выделяют три подобласти; если считать от теломеры, то сначала идет область, называемая класс I, затем класс III и класс II. У других организмов последовательность классов может быть другой. У рыб класс II вообще находится на другой хромосоме.[4]
Два набора генов, класса I и II, кодирующие так называемые MHC класс I и MHC класс II молекулы, являются центральными игроками клеточного иммунитета. Основная функция МНС-I и МНС-II молекул - связывание пептидных фрагментов, полученных при внутриклеточном расщеплении белковых молекул, и презентация этих пептидов на поверхности клеток для распознавания Т- и NK- клеточными рецепторами. В большинстве своем это пептиды собственных белков, если же в организм попал патоген, то на поверхности клеток будут присутствовать и пептиды из чужих белков. Несмотря на то, что доля чужих пептидов на клеточной поверхности очень мала (одна молекула на десятки и сотни тысяч своих пептидов), такие зараженные клетки быстро распознаются Т-лимфоцитами и разрушаются иммунной системой. Презентация собственных белков на поверхности клеток чрезвычайно важна, иммунная система постоянно отслеживает и уничтожает не только инфицированные, но и поврежденные или измененные клетки [5][6].
Два свойства белков МНС являются очень важными при использования их в приобретенном иммунитете. Во-первых, полигенность: каждый организм имеет несколько генов МНС. Так например, у каждого человека есть три гена комплекса МНС-I, HLA-А, HLA-В и HLA-С. Во-вторых, полиморфность – в популяции существует множество вариантов каждого гена, так для HLA-А на 2020 год извесно 5907 аллелей, кодирующих 3702 разных белковых молекул. Просмотреть все описанные варианты молекул HLA можно в базе данных IMGT (www.imgt.org).
Наряду с классическими молекулами МНС-I, HLA-А, HLA-В и HLA-С в области класс I есть гены так называемых неклассических комплексов HLA: MICA, MICB, HLA-Е, HLA-F и HLA-G, отличающихся от классических меньшей полиморфностью и меньшим уровнем экспрессии. MICA (MHC class I polypeptide-related sequence A) кодирует мембранно-связанный гликопротеин, чья экспрессия вызывается стрессом - температурой, вирусной или бактериальной инфекцией, онкогенной трансформацией и пр.[7] MICA является самым полиморфным из неклассических HLA, у человека описано более 150 вариантов (IMGT). MICA является лигандом рецептора CD94/NKG2D, который экспрессируется на NK-клетках и некоторых Т-лимфоцитах. При связывании с MICA CD94/NKG2D активирует цитолитическую активность этих клеток. Таким образом, MICA является сигналом иммунной системе на раннюю реакцию в ответ на инфекцию иди спонтанное возникновение модифицированных раковых клеток. HLA-Е связывает обычно сигнальные пептиды классических HLA-А, В и С и служит лигандом NK-клеточных рецепторов CD94/NKG2A или CD94/NKG2B, ингибируя их цитотоксическую активность [8]. HLA-G экспрессируется только на зародышевых клетках плаценты, играя важную роль в иммунотолерантности при беременности[9]
В отличие от комплексов МНС-I, белки МНС-II экспрессируются исключительно в так называемых профессиональных антиген-презентирующих клетках (АРС). К ним относятся дендритные клетки, В-клетки и макрофаги. МНС-II – гетеродимеры, гены обоих цепей принадлежат МНС локусу. Шесть генов человеческих МНС-II носят названия HLA-DRA(B), HLA-DQA(B) и HLA-DPA(B).
Кроме МНС-I и МНС-II в этом же локусе расположены гены других белков, участвующих в презентации антигена. Два гена каталитической β-субъединицы протеосомы, PSMB8 и PSMB9 начинают экспрессироваться только в том случае, если клетка получила сигнал о наличии в среде гамма-интерферона. Замена каталитических субъединиц превращает протеосому в иммунопротеосому с измененной протеолитической специфичностью. Иммунопротеосома выпускает пептиды с гидрофобной или основной аминокислотой на С-конце, имеющие большее сродство к МНС- I [10].
Рядом с PSMB8 и PSMB9 находятся гены ТАР1 и ТАР2, кодирующие два субъединицы транспортера пептидов через мембрану эндоплазматического о. ТАР1 и ТАР2 не только переносят пептиды в ЭР, но и помогают им свзаться с МНС-I. В этом им помогает тапазин, чей ген ТАРВР тоже находится в области класс II геномного локуса HLA.
Пептиды комплекса МНС-II получаются из лизосомального, а не протеосомного расщепления. Ген HLA-DM кодирует белок DM, который катализирует связывание пептидов с МНС-II. Рядом находится HLA-DО, ген отрицательного регулятора HLA-DM.
Локус HLA содержит также гены трех цитокинов семейства фактора некроза опухоли, TNF, гены белков системы комплемента (С2, С4а, С4b, CFВ) и много других генов, чьи продукты не связаны напрямую с иммунной системой, например, CYP21P - один из цитохромов Р450, POU5F1 и TCF19 - факторы транскрипции, AGER – регулятор многих клеточных процессов, Hsp70 и т.д.
Описание МНС человека с полным секвенированием и аннотацией генов было опубликовано в 1999 году в журнале Nature центрами секвенирования Великобритании, США и Японии[2]. Представленная последовательность называлась виртуальной МНС, поскольку это была мозаика, составленная из кусков генома людей с разными гаплотипами.
В том же номере журнала Nature было опубликовано описание куриной МНС, которая в 20 раз короче человеческой и включает только 19 генов[3]. В-локус кур имеет все признаки МНС: там расположены гены классических МНС- I и МНС-II молекул, он определяет тканевую специфичность и иммунный ответ. МНС-локус кур гораздо компактнее человеческого, центральная его область от гена класс II до гена класс I молекул имеет всего 44 000 оснований, хотя содержит 11 генов. Порядок генов другой, класс I и класс II области не разделены длинной класс III областью (Рис-?). Почти все гены В-локуса кур имеют ортологов у млекопитающих, но много генов, имеющихся в МНС областях млекопитающих, отсутствуют у кур. В В-области кур есть всего два гена молекул МНС-I и МНС-II, отсутствуют DN и DOB, нет генов каталитических субъединиц протеасом, ген неполиморфной субъединицы МНС- II, class IIa находится вне В-локуса. Зато присутствуют гены лектина и NK-рецептора, которые у млекопитающих находятся на другой хромосоме.
Секвенирование МНС локуса перепелов[11] показало похожую, но более сложную организацию из-за нескольких дупликаций. Так у перепелов есть семь генов молекул МНС класс I, семь генов b-цепи МНС класс II и 8 BG-подобных генов.
Секвенированы МНС-локусы нескольких рыб[12]. У всех у них класс II и класс I области не связаны между собой и находятся на разных хромосомах. В отличие от птиц, рыбы, как и млекопитающие, имеют в МНС области гены каталитических субъединиц протеасом, но они расположены в области класс I, вместе с генами транспортера ТАР, ТАРВР. Количество генов классических МНС у разных рыб разное, например, у фугу девять генов молекул МНС класс I, а у данио их только три.
База данных IMGT (International Immunogenetics information system) содержит информацию о нуклеотидных последовательностях MHC локусов 77 разных видов (2019-12-19)
| Структура комплекса MHC-I | |
|---|---|
 | |
| Каталоги | |
| Структура комплекса MHC-II | |
|---|---|
 | |
| Каталоги | |
| Взаимодействие Т-хелперов и Т-киллеров с MHC-комплексами | |
|---|---|
 | |
| Каталоги | |
| Презентация антигена MHC-I комплексом | |
|---|---|
 | |
| Каталоги | |
ГКГ и выбор сексуального партнёра
Ряд независимых исследований 1970—1990-х гг. показали, что на выбор полового партнёра влияет главный комплекс гистосовместимости. Эксперименты, проведенные первоначально на мышах и рыбах[13], затем на добровольных участниках-людях, показали, что женщины имели склонность выбирать партнёров с ГКГ, отличным от собственного, однако их выбор менялся на противоположный в случае использования гормональных оральных контрацептивов — в этом случае женщины скорее выбирали партнёра с подобным ГКГ[14][15][16]
См. также
Примечания
- ↑ Nicole C. Smith, Matthew L. Rise, Sherri L. Christian. A Comparison of the Innate and Adaptive Immune Systems in Cartilaginous Fish, Ray-Finned Fish, and Lobe-Finned Fish // Frontiers in Immunology. — 2019-10-10. — Т. 10. — С. 2292. — ISSN 1664-3224. — doi:10.3389/fimmu.2019.02292.
- ↑ 1 2 3 Complete sequence and gene map of a human major histocompatibility complex. The MHC sequencing consortium // Nature. — 1999-10-28. — Т. 401, вып. 6756. — С. 921–923. — ISSN 0028-0836. — doi:10.1038/44853.
- ↑ 1 2 J. Kaufman, S. Milne, T. W. Göbel, B. A. Walker, J. P. Jacob. The chicken B locus is a minimal essential major histocompatibility complex // Nature. — 1999-10-28. — Т. 401, вып. 6756. — С. 923–925. — ISSN 0028-0836. — doi:10.1038/44856.
- ↑ Jerzy K. Kulski, Takashi Shiina, Tatsuya Anzai, Sakae Kohara, Hidetoshi Inoko. Comparative genomic analysis of the MHC: the evolution of class I duplication blocks, diversity and complexity from shark to man // Immunological Reviews. — 2002-12. — Т. 190. — С. 95–122. — ISSN 0105-2896. — doi:10.1034/j.1600-065x.2002.19008.x.
- ↑ Klas Kärre. Natural killer cell recognition of missing self // Nature Immunology. — 2008-05. — Т. 9, вып. 5. — С. 477–480. — ISSN 1529-2916. — doi:10.1038/ni0508-477.
- ↑ Kenneth L. Rock, Eric Reits, Jacques Neefjes. Present Yourself! By MHC Class I and MHC Class II Molecules // Trends in Immunology. — 11 2016. — Т. 37, вып. 11. — С. 724–737. — ISSN 1471-4981. — doi:10.1016/j.it.2016.08.010.
- ↑ Dan Chen, Ulf Gyllensten. MICA polymorphism: biology and importance in cancer // Carcinogenesis. — 2014-12. — Т. 35, вып. 12. — С. 2633–2642. — ISSN 1460-2180. — doi:10.1093/carcin/bgu215.
- ↑ Alexander Rölle, Dirk Jäger, Frank Momburg. HLA-E Peptide Repertoire and Dimorphism-Centerpieces in the Adaptive NK Cell Puzzle? // Frontiers in Immunology. — 2018. — Т. 9. — С. 2410. — ISSN 1664-3224. — doi:10.3389/fimmu.2018.02410.
- ↑ Gry Persson, Nanna Jørgensen, Line Lynge Nilsson, Lærke Heidam J. Andersen, Thomas Vauvert F. Hviid. A role for both HLA-F and HLA-G in reproduction and during pregnancy? // Human Immunology. — 2019-09-24. — ISSN 1879-1166. — doi:10.1016/j.humimm.2019.09.006.
- ↑ K. Akiyama, K. Yokota, S. Kagawa, N. Shimbara, T. Tamura. cDNA cloning and interferon gamma down-regulation of proteasomal subunits X and Y // Science (New York, N.Y.). — 1994-08-26. — Т. 265, вып. 5176. — С. 1231–1234. — ISSN 0036-8075. — doi:10.1126/science.8066462.
- ↑ Jerzy K. Kulski, Takashi Shiina, Tatsuya Anzai, Sakae Kohara, Hidetoshi Inoko. Comparative genomic analysis of the MHC: the evolution of class I duplication blocks, diversity and complexity from shark to man // Immunological Reviews. — 2002-12. — Т. 190. — С. 95–122. — ISSN 0105-2896. — doi:10.1034/j.1600-065x.2002.19008.x.
- ↑ Jerzy K. Kulski, Takashi Shiina, Tatsuya Anzai, Sakae Kohara, Hidetoshi Inoko. Comparative genomic analysis of the MHC: the evolution of class I duplication blocks, diversity and complexity from shark to man // Immunological Reviews. — 2002-12. — Т. 190. — С. 95–122. — ISSN 0105-2896. — doi:10.1034/j.1600-065x.2002.19008.x.
- ↑ Boehm, T; Zufall, F. MHC peptides and the sensory evaluation of genotype (англ.) // Trends Neurosci[англ.] : journal. — 2006. — Vol. 29, no. 2. — P. 100—107. — doi:10.1016/j.tins.2005.11.006. — PMID 16337283.
- ↑ Wedekind, C; Seebeck, T; Bettens, F; Paepke, A J. MHC-dependent mate preferences in humans (англ.) // Proc Biol Sci : journal. — 1995. — June (vol. 1359, no. 260). — P. 245—249. — doi:10.1098/rspb.1995.0087. — PMID 7630893.
- ↑ Santos, P S; Schinemann, J A; Gabardo, J; Bicalho, Mda G. New evidence that the MHC influences odor perception in humans: a study with 58 Southern Brazilian students (англ.) // Horm Behav. : journal. — 2005. — April (vol. 47, no. 4). — P. 384—388. — doi:10.1016/j.yhbeh.2004.11.005. — PMID 15777804.
- ↑ Jacob S., McClintock M.K., Zelano B., Ober C. Paternally inherited HLA alleles are associated with women's choice of male odor (англ.) // Nat. Genet. : journal. — 2002. — February (vol. 30, no. 2). — P. 175—179. — doi:10.1038/ng830. — PMID 11799397.
Ссылки
Литература
- Мейл, Д. Иммунология / Д. Мейл, Дж. Бростофф, Д. Б. Рот, А. Ройтт / Пер. с англ. — М.: Логосфера, 2007. — 568 с.
- Койко, Р. Иммунология / Р. Койко, Д. Саншайн, Э. Бенджамини; пер. с англ. А. В. Камаева, А. Ю. Кузнецовой под ред. Н. Б. Серебряной. -М: Издательский центр «Академия», 2008. — 368 с.
В другом языковом разделе есть более полная статья Major histocompatibility complex (англ.). |
Это заготовка статьи по медицине. Помогите Википедии, дополнив её. |
Это заготовка статьи по генетике. Помогите Википедии, дополнив её. |
В статье не хватает ссылок на источники (см. рекомендации по поиску). |