Дигидролипоилтрансацетилаза
| Дигидролипоилтрансацетилаза | |||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Идентификаторы | |||||||||||||||||||||||||||||||||||||||||||||||||||
| Псевдонимы | DLATpyruvate dehydrogenase complex component E2dihydrolipoamide acetyltransferase component of pyruvate dehydrogenase complexdihydrolipoyllysine-residue acetyltransferase component of pyruvate dehydrogenase complexmitochondrialPDCE2PDC-E2M2 antigen complex 70 kDa subunit70 kDa mitochondrial autoantigen of primary biliary cirrhosisPBCE2 component of pyruvate dehydrogenase complex | ||||||||||||||||||||||||||||||||||||||||||||||||||
| Внешние ID | GeneCards: [1] | ||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||
Дигидролипоилтрансацетилаза или дигидролипоамид S-ацетилтрансфераза (англ. Dihydrolipoyl transacetylase или dihydrolipoamide acetyltransferase, сокр. DLAT) — фермент (шифр КФ 2.3.1.12), из семейства ацилтрансфераз (класс трансферазы), катализирующий реакцию переноса атома водорода и ацетильной группы (CH3-CO) кофермента А от тиаминдифосфата на окисленную форму липоиллизиновых групп с образованием ацетилтиоэфира липоевой кислоты. Входит в состав пируватдегидрогеназного комплекса (ПДК) как компонент E2 (сокр. PDCE2)[1], располагается в ядре комплекса. К дигидролипоилтрансацетилазе присоединены молекулы: пируватдекарбоксилазы (Е1) и дигидролипоилдегидрогеназы (Е3)[2].
У человека ген, кодирующий данный фермент — DLAT, локализован на 11-ой хромосоме. Дигидролипоилтрансацетилаза состоит из последовательности 647 аминокислотных остатков и имеет молекулярную массу 68997 Да[3].
Структура[править | править код]
Все дигидролипоилтрансацетилазы имеют уникальную мультидоменную структуру, состоящую из (от N до C): 3 липоильных доменов, домена взаимодействия и каталитического домена (см. архитектуру доменов в Pfam). Все домены соединены неупорядоченными линкерными областями низкой сложности.
В зависимости от вида, несколько субъединиц фермента дигидролипоилтрансацетилазы могут располагаться вместе в кубической или додекаэдрической форме. Эти структуры затем образуют каталитическое ядро пируватдегидрогеназного комплекса, который не только катализирует реакцию переноса ацетильной группы на КоА, но и выполняет важнейшую структурную роль в создании архитектуры всего комплекса[4].
Куб[править | править код]
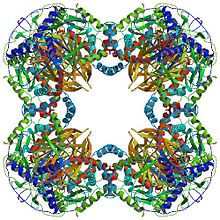
Кубическая структура ядра, встречающаяся у таких видов, как Azotobacter vinelandii, состоит из 24 субъединиц[6][7]. Каталитические домены собраны в тримеры с активным сайтом, расположенным на границе субъединиц. Топология активного сайта этого тримера идентична топологии активного сайта хлорамфеникол-ацетилтрансферазы. Восемь таких тримеров складываются в полый усечённый куб. Два основных субстрата, КоА и липоамид (Lip(SH)2), находятся у двух противоположных входов в канал длиной 30 Å (3 нм), который проходит между субъединицами и образует каталитический центр. КоА поступает изнутри куба, а липоамид — снаружи[8].
Додекаэдр[править | править код]
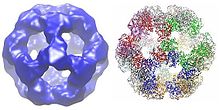
У многих видов организмов, включая бактерии, такие как Geobacillus stearothermophilus и Enterococcus faecalis[4], а также млекопитающих, таких как человек[9] и корова[10], додекаэдрическая структура ядра состоит всего из 60 субъединиц. Субъединицы расположены наборами по три, подобно тримерам в кубической форме ядра, причём каждый набор составляет одну из 20 додекаэдрических вершин.
Функции[править | править код]
Медицинское значение[править | править код]
Первичный билиарный цирроз[править | править код]
Первичный билиарный цирроз (ПБЦ) — это аутоиммунное заболевание, характеризующееся появлением аутоантител к митохондриальным и ядерным антигенам. Они называются антимитохондриальными (AMA) и антиядерными (ANA) антителами соответственно. Эти антитела обнаруживаются в сыворотке крови пациентов с ПБЦ и значительно отличаются по эпитопной специфичности от пациента к пациенту. Из митохондриальных антигенов, способных вызывать реактивность аутоантител у пациентов с ПБЦ, наиболее распространённым эпитопом является субъединица E2 пируватдегидрогеназного комплекса — дигидролипоилтрансацетилаза (другие антигены включают ферменты 2-оксокислотного дегидрогеназного комплекса, а также другие ферменты пируватдегидрогеназного комплекса)[11]. Последние данные свидетельствуют о том, что пептиды в каталитическом сайте могут представлять собой иммунодоминантные эпитопы, распознаваемые анти-PDC-E2 антителами у пациентов с ПБК[12]. Есть также данные о наличии анти-PDC-E2 антител у пациентов с аутоиммунным гепатитом (АИГ)[13].
Дефицит пируватдегидрогеназы[править | править код]
Дефицит пируватдегидрогеназы (ПДГ) — это генетическое заболевание, приводящее к лактатацидоза и неврологической дисфункции в младенчестве и раннем детстве. Как правило, дефицит ПДГ является результатом мутации Х-сцепленного гена субъединицы E1 пируватдегидрогеназного комплекса. Однако известны редкие случаи, когда у пациентов с ПДГ вместо этого происходила мутация в аутосомном гене субъединицы E2. Сообщалось, что у таких пациентов симптомы были гораздо менее тяжёлыми, а наиболее ярким проявлением болезни была эпизодическая дистония, хотя также наблюдались гипотония и атаксия[14].
Примечания[править | править код]
- ↑ Leung P. S., Watanabe Y., Munoz S., Teuber S. S., Patel M. S., Korenberg J. R., Hara P., Coppel R., Gershwin M. E. Chromosome localization and RFLP analysis of PDC-E2: the major autoantigen of primary biliary cirrhosis (англ.) // Autoimmunity : journal. — 1993. — Vol. 14, no. 4. — P. 335—340. — doi:10.3109/08916939309079237. — PMID 8102256.
- ↑ Северин Е.С. Биохимия. — М.: ГЭОТАР-Медиа, 2003. — С. 282-284. — 779 с. — ISBN 5-9231-0254-4.
- ↑ UniProt, P10515 (англ.). Дата обращения: 10 марта 2018. Архивировано 31 августа 2017 года.
- ↑ 1 2 3 PDB 1B5S; Izard T, Aevarsson A, Allen MD, Westphal AH, Perham RN, de Kok A, Hol WG (February 1999). "Principles of quasi-equivalence and Euclidean geometry govern the assembly of cubic and dodecahedral cores of pyruvate dehydrogenase complexes". Proc. Natl. Acad. Sci. U.S.A. 96 (4): 1240—5. Bibcode:1999PNAS...96.1240I. doi:10.1073/pnas.96.4.1240. PMC 15447. PMID 9990008.
- ↑ Mattevi A, Obmolova G, Kalk KH, Teplyakov A, Hol WG (Apr 1993). "Crystallographic analysis of substrate binding and catalysis in dihydrolipoyl transacetylase (E2p)". Biochemistry. 32 (15): 3887—901. doi:10.1021/bi00066a007. PMID 8471601.
- ↑ de Kok A, Hengeveld AF, Martin A, Westphal AH (Jun 1998). "The pyruvate dehydrogenase multi-enzyme complex from Gram-negative bacteria". Biochimica et Biophysica Acta (BBA) - Protein Structure and Molecular Enzymology. 1385 (2): 353—66. doi:10.1016/S0167-4838(98)00079-X. PMID 9655933.
- ↑ Hanemaaijer R, Westphal AH, Van Der Heiden T, De Kok A, Veeger C (Feb 1989). "The quaternary structure of the dihydrolipoyl transacetylase component of the pyruvate dehydrogenase complex from Azotobacter vinelandii. A reconsideration". European Journal of Biochemistry. 179 (2): 287—92. doi:10.1111/j.1432-1033.1989.tb14553.x. PMID 2917567.
- ↑ Mattevi A, Obmolova G, Schulze E, Kalk KH, Westphal AH, de Kok A, Hol WG (Mar 1992). "Atomic structure of the cubic core of the pyruvate dehydrogenase multienzyme complex". Science. 255 (5051): 1544—50. Bibcode:1992Sci...255.1544M. doi:10.1126/science.1549782. PMID 1549782.
- ↑ Brautigam CA, Wynn RM, Chuang JL, Chuang DT (May 2009). "Subunit and catalytic component stoichiometries of an in vitro reconstituted human pyruvate dehydrogenase complex". The Journal of Biological Chemistry. 284 (19): 13086—98. doi:10.1074/jbc.M806563200. PMC 2676041. PMID 19240034.
- ↑ Zhou ZH, McCarthy DB, O'Connor CM, Reed LJ, Stoops JK (Dec 2001). "The remarkable structural and functional organization of the eukaryotic pyruvate dehydrogenase complexes". Proceedings of the National Academy of Sciences of the United States of America. 98 (26): 14802—7. Bibcode:2001PNAS...9814802Z. doi:10.1073/pnas.011597698. PMC 64939. PMID 11752427.
- ↑ Mackay IR, Whittingham S, Fida S, Myers M, Ikuno N, Gershwin ME, Rowley MJ (Apr 2000). "The peculiar autoimmunity of primary biliary cirrhosis". Immunological Reviews. 174: 226—37. doi:10.1034/j.1600-0528.2002.017410.x. PMID 10807519. S2CID 596338. Архивировано из оригинала 5 января 2013.
- ↑ Braun S, Berg C, Buck S, Gregor M, Klein R (Feb 2010). "Catalytic domain of PDC-E2 contains epitopes recognized by antimitochondrial antibodies in primary biliary cirrhosis". World Journal of Gastroenterology. 16 (8): 973—81. doi:10.3748/wjg.v16.i8.973. PMC 2828602. PMID 20180236.
- ↑ O'Brien C, Joshi S, Feld JJ, Guindi M, Dienes HP, Heathcote EJ (Aug 2008). "Long-term follow-up of antimitochondrial antibody-positive autoimmune hepatitis". Hepatology. 48 (2): 550—6. doi:10.1002/hep.22380. PMID 18666262. S2CID 5400712.
- ↑ Head RA, Brown RM, Zolkipli Z, Shahdadpuri R, King MD, Clayton PT, Brown GK (Aug 2005). "Clinical and genetic spectrum of pyruvate dehydrogenase deficiency: dihydrolipoamide acetyltransferase (E2) deficiency". Annals of Neurology. 58 (2): 234—41. doi:10.1002/ana.20550. PMID 16049940. S2CID 38264402.
В другом языковом разделе есть более полная статья Dihydrolipoyl transacetylase (англ.). |