Тетрахлорид селена
Текущая версия страницы пока не проверялась опытными участниками и может значительно отличаться от версии, проверенной 19 октября 2018 года; проверки требуют 7 правок.
| Тетрахлорид селена | |
|---|---|
 | |
| Общие | |
| Систематическое наименование |
Хлорид селена(IV) |
| Традиционные названия | Четырёххлористый селен, тетрахлорид селена |
| Хим. формула | SeCl4 |
| Рац. формула | SeCl4 |
| Физические свойства | |
| Состояние | светло-жёлтые кристаллы |
| Молярная масса | 220,77 г/моль |
| Плотность | 2,6; 2,7; 3,80 г/см³ |
| Термические свойства | |
| Температура | |
| • плавления | под давл. 305 °C |
| • кипения | субл. 196 °C |
| Оптические свойства | |
| Показатель преломления | 1,807 |
| Классификация | |
| Рег. номер CAS | 10026-03-6 |
| PubChem | 66205 |
| Рег. номер EINECS | 233-053-5 |
| SMILES | |
| InChI | |
| RTECS | VS7875000 |
| ChemSpider | 59590 |
| Безопасность | |
| Предельная концентрация | 0,1 мг/м³ |
| ЛД50 | 23-100 мг/кг |
| Токсичность | сильный ирритант |
| NFPA 704 | |
| Приведены данные для стандартных условий (25 °C, 100 кПа), если не указано иное. | |
Тетрахлорид селена — неорганическое соединение селена и хлора с формулой SeCl4, светло-жёлтые кристаллы, реагируют с водой. Ядовит.
Получение[править | править код]
- Действие тионилхлорида на диоксид селена:
Физические свойства[править | править код]
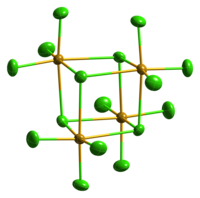
Тетрахлорид селена образует светло-жёлтые кристаллы ромбической сингонии, пространственная группа B mam, параметры ячейки a = 2,934 нм, b = 0,973 нм, c = 1,493 нм, Z = 32.
Легко возгоняется, что используется для его очистки, плавится только под избыточным давлением, превращаясь в тёмно-красную жидкость.
Химические свойства[править | править код]
- Разлагается при нагревании:
- Реагирует с влагой из воздуха:
- Реагирует с водой:
- Реагирует с щелочами:
- Реагирует с диоксидом селена, растворённым в серной кислоте:
- При растворении в холодной концентрированной соляной кислоте образует гексахлороселенистую кислоту:
Применение[править | править код]
- Очистка селена.
- Хлорирующий агент.
Требования безопасности[править | править код]
Вещество токсично. ПДК 0,01 мг/л. При попадании в организм в чистом виде может вызвать сильную интоксикацию. Также хлорид селена(IV) может раздражать слизистые оболочки.
ЛД50 на крысах - 100 мг/кг.
См. также[править | править код]
Литература[править | править код]
- Справочник химика / Редкол.: Никольский Б.П. и др.. — 3-е изд., испр. — Л.: Химия, 1971. — Т. 2. — 1168 с.
- Химическая энциклопедия / Редкол.: Кнунянц И.Л. и др.. — М.: Советская энциклопедия, 1995. — Т. 4. — 639 с. — ISBN 5-82270-092-4.
- Лидин Р.А. и др. Химические свойства неорганических веществ: Учеб. пособие для вузов. — 3-е изд., испр. — М.: Химия, 2000. — 480 с. — ISBN 5-7245-1163-0.









![{\displaystyle {\mathsf {SeCl_{4}+2HCl\ {\xrightarrow {0^{o}C}}\ H_{2}[SeCl_{6}]}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/a592b55b13db36852588c9625f775fc0fab30015)