Нитрит аммония
| Нитрит аммония | |
|---|---|
 | |
| Общие | |
| Систематическое наименование |
аммоний азотистокислый |
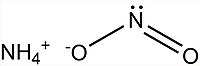
| Хим. формула | NH4NO2 |
| Физические свойства | |
| Состояние | белые (или желтоватые) кристаллы |
| Молярная масса | 64,04 г/моль |
| Плотность | 1,69 г/см³ |
| Термические свойства | |
| Температура | |
| • плавления | разлагается при ~70 °C |
| Химические свойства | |
| Растворимость | |
| • в воде | 180,1 г/100 мл |
| Классификация | |
| Рег. номер CAS | 13446-48-5 |
| PubChem | 102601896 |
| Рег. номер EINECS | 236-598-7 |
| SMILES | |
| InChI | |
| ChemSpider | 24223 |
| Приведены данные для стандартных условий (25 °C, 100 кПа), если не указано иное. | |
Аммония нитрит, NH4NO2 — соль, белый, мелкокристаллический порошок, при хранении желтеет.
Получение[править | править код]
Восстановлением водородом в момент выделения нитрата аммония из слабокислых растворов:
Поглощение смеси газообразных оксидов NO и NO2 (или неустойчивого N2O3) водным раствором аммиака:
Обменными реакциями:
Физические свойства[править | править код]
Белый кристаллический порошок, хорошо растворяется в холодной воде (в горячей — разлагается).
Химические свойства[править | править код]
Аммония нитрит — неустойчивое вещество, и при нагревании разлагается:
при резком нагревании возможен взрывной характер разложения.
Как соль слабого основания и слабой кислоты разлагается кислотами и щелочами:
Окисляется кислородом воздуха (процесс ускоряется при повышенной температуре в присутствии влаги):
Применение[править | править код]
Нитрит аммония используется в качестве родентицида, дезинфектора и сельскохозяйственного пестицида. Токсин для человека и водных организмов.
Литература[править | править код]
- Лидин Р. А., Андреева Л. Л., Молочко В. А. Химические свойства неорганических веществ: Учеб. пособие для вузов — 3-е изд., испр — М.: Химия, 2000. — С. 296. — 480 с. — ISBN 5-7245-1163-0
Это заготовка статьи о неорганическом веществе. Помогите Википедии, дополнив её. |






