Оксид вольфрама(VI): различия между версиями
| [непроверенная версия] | [отпатрулированная версия] |
Нет описания правки |
Д.Ильин (обсуждение | вклад) дополнение, уточнение, викификация, оформление, стилевые правки |
||
| Строка 10: | Строка 10: | ||
| сокращения = <!-- принятые сокращения названия --> |
| сокращения = <!-- принятые сокращения названия --> |
||
| хим. формула = WO<sub>3</sub> |
| хим. формула = WO<sub>3</sub> |
||
| молярная масса = 231 |
| молярная масса = 231,8393 |
||
| плотность = <!-- число, в г/см³ --> |
| плотность = <!-- число, в г/см³ --> |
||
| Строка 70: | Строка 70: | ||
| токсичность = <!-- краткое описание --> |
| токсичность = <!-- краткое описание --> |
||
}} |
}} |
||
'''Окси́д вольфра́ма(VI)''' (другие используемые названия — '''триоксид вольфрама''', '''трёхокись вольфрама''' |
'''Окси́д вольфра́ма(VI)''' (другие используемые названия — '''триоксид вольфрама''', '''трёхокись вольфрама''', '''вольфрамовый ангидрид''', '''ангидрид вольфрамовой кислоты́''') <chem>WO3</chem> — бинарное [[химическое соединение]] [[кислород]]а и [[Переходный металл|переходного металла]] [[вольфрам]]. |
||
Обладает кислотными свойствами. |
|||
== Свойства == |
== Свойства == |
||
| ⚫ | |||
== |
=== Физические === |
||
Мелкокристаллический порошок лимонно-жёлтого цвета. Плотность {{nobr|7,2—7,4 г/см³.}} Температура плавления {{nobr|1470 °C,}} температура кипения {{nobr|1700 °С.}} |
|||
| ⚫ | Кристаллическая структура зависит от температуры. |
||
| ⚫ | Кристаллическая структура соединения зависит от температуры. Устойчивая [[Моноклинная сингония|моноклинная]] до {{nobr|−27 °C,}} [[Триклинная сингония|триклинная]] в диапазоне температур от {{nobr|−27 до 20 °C,}} [[Моноклинная сингония|моноклинная]] от {{nobr|20 до 339 °C,}} [[Ромбическая сингония|ромбическая]] от {{nobr|339 до 740 °C,}} [[Тетрагональная сингония|тетрагональная]] при температуре от {{nobr|740 до 1470 °C}}<ref name="ХЭ" />. |
||
| ⚫ | |||
| ⚫ | |||
=== Химические === |
|||
| ⚫ | |||
: <chem>2 WO3 + 3 C -> 2 W + 3 CO2</chem>; |
|||
: <chem>WO3 + 3 H2 -> W + 3 H2O</chem>; |
|||
: <chem>WO3 + 2 Fe -> W + Fe2O3</chem>; |
|||
: <chem>2WO3 + Pt -> 2WO2 + PtO2</chem>. |
|||
== Получение == |
== Получение == |
||
Триоксид вольфрама получают термическим разложением гидрата |
Триоксид вольфрама получают термическим разложением гидрата <chem>WO3.H2O</chem> ([[Вольфрамовая кислота|вольфрамовой кислоты]]) или [[Паравольфрамат аммония|паравольфрамата аммония]] <chem>(NH4)10[H2W12O42].4H2O</chem> при температуре 500—800 °C<ref name="ХЭ">Вольфрама оксиды // Химическая энциклопедия, под. ред. Кнунянца И. Л., т. 1. — М.: «Советская энциклопедия», 1988, стр 421.</ref>. |
||
: <chem>WO3.H2O -> WO3 + H2O1</chem>; |
|||
:: <math>\mathsf{WO_3\cdot H_2O \rightarrow WO_3 + H_2O}</math> |
|||
: <chem>(NH4)10[H2W12O42].4H2O -> 12WO3 + 10NH3 + 11H2O</chem>. |
|||
Или из [[Вольфрамат кальция|вольфрамата кальция]] (минерал [[шеелит]]) действием [[Соляная кислота|соляной кислоты]] с последующим разложением образующейся [[Вольфрамовая кислота|вольфрамовой кислоты]]: |
|||
:: <math>\mathsf{(NH_4)_{10}[H_2W_{12}O_{42}]\cdot 4H_2O \rightarrow 12WO_3 + 10NH_3 + 11H_2O}</math> |
|||
: <chem>CaWO4 + 2HCl -> CaCl2 + H2WO4</chem>, |
|||
Другой способ получения: окисление металлического вольфрама в атмосфере кислорода при температуре выше 500 °C<ref name="ХЭ" />. |
|||
: <chem>H2WO4 -> H2O + WO3</chem>. |
|||
Другой способ получения — окисление металлического вольфрама в атмосфере кислорода или на воздухе при температуре выше 500 °C<ref name="ХЭ" />. Эта реакция происходит при включении потерявшей герметичность лампы накаливания, триоксид вольфрама при этом оседает на внутренних стенках колбы лампы в виде светло-жёлтого налёта: |
|||
:: <math>\mathsf{2W + 3O_2 \rightarrow 2WO_3}</math> |
|||
: <chem>2W + 3O2 ->2WO3</chem>. |
|||
== Применение == |
== Применение == |
||
Триоксид вольфрама применяется для получения [[Карбиды|карбидов]] и [[ |
Триоксид вольфрама применяется для получения [[Карбиды|карбидов]] и [[галогениды|галогенидов]] вольфрама, металлического вольфрама. |
||
Из-за насыщенного жёлтого цвета применяется в качестве жёлтого [[пигмент]]а для придания цвета стеклу и [[керамика|керамике]]<ref name="handbook">{{cite book|last =Patnaik|first =Pradyot|year = 2003|title =Handbook of Inorganic Chemical Compounds|publisher = McGraw-Hill|isbn =978-0-07-049439-8|url= https://books.google.com/books?id=Xqj-TTzkvTEC|accessdate = 2009-06-06}}</ref>. |
|||
Для придания огнестойкости тканям<ref name="merck">«Tungsten trioxide.» ''The Merck Index'' Vol 14, 2006.</ref>. |
|||
Используется в датчиках [[газоанализатор]]ов на озон<ref>David E Williams et al, «Modelling the response of a tungsten oxide semiconductor as a gas sensor for the measurement of ozone», Meas. Sci. Technol. 13 923, {{doi|10.1088/0957-0233/13/6/314}}.</ref>. |
|||
Используется в производстве [[Сцинтилляторы|сцинтилляторов]] и [[люминофор]]ов содержащих вольфраматы [[Вольфрамат бария|бария]] или [[Вольфрамат стронция|стронция]]. |
|||
В последние время триоксид вольфрама нашёл применение в производстве [[Умное стекло|электрохромного]] оконного стекла. [[Прозрачность (оптика)|Светопропускание]] застеклённых таким стеклом окон можно варьировать изменяя управляющее электрическое напряжение, прикладываемое к плёнку электрофотохромного материала<ref name="journal">{{cite journal|doi=10.1007/s11664-000-0139-8|title=Effects of surface porosity on tungsten trioxide(WO3) films' electrochromic performance|year=2000|last1=Lee|first1=W. J.|last2=Fang|first2=Y. K.|last3=Ho|first3=Jyh-Jier|last4=Hsieh|first4=W. T.|last5=Ting|first5=S. F.|last6=Huang|first6=Daoyang|last7=Ho|first7=Fang C.|journal=Journal of Electronic Materials|volume=29|issue=2|pages=183–187}}</ref><ref>K. J. Patel et al., All-Solid-Thin Film Electrochromic Devices Consisting of Layers ITO / NiO / ZrO2 / WO3 / ITO, J. Nano-Electron. Phys. 5 No 2, 02023 (2013)</ref>. |
|||
Также применяется в качестве [[катализаторы|катализатора]] гидрогенизации при [[крекинг]]а [[углеводороды|углеводородов]]<ref name="ХЭ" />. |
|||
== Примечания == |
== Примечания == |
||
Версия от 12:41, 1 июля 2020
| Оксид вольфрама(VI) | |
|---|---|
 | |
 | |
| Общие | |
| Систематическое наименование |
Окись вольфрама(VI) |
| Традиционные названия | триоксид вольфрама, трёхокись вольфрама, вольфрамовый ангидрид |
| Хим. формула | WO3 |
| Физические свойства | |
| Молярная масса | 231,8393 г/моль |
| Классификация | |
| Рег. номер CAS | 1314-35-8 |
| PubChem | 14811 |
| Рег. номер EINECS | 215-231-4 |
| SMILES | |
| InChI | |
| RTECS | YO7760000 |
| ChemSpider | 14127 |
| Приведены данные для стандартных условий (25 °C, 100 кПа), если не указано иное. | |
Окси́д вольфра́ма(VI) (другие используемые названия — триоксид вольфрама, трёхокись вольфрама, вольфрамовый ангидрид, ангидрид вольфрамовой кислоты́) — бинарное химическое соединение кислорода и переходного металла вольфрам.
Обладает кислотными свойствами.
Свойства
Физические
Мелкокристаллический порошок лимонно-жёлтого цвета. Плотность 7,2—7,4 г/см³. Температура плавления 1470 °C, температура кипения 1700 °С.
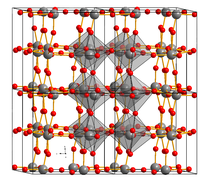
Кристаллическая структура соединения зависит от температуры. Устойчивая моноклинная до −27 °C, триклинная в диапазоне температур от −27 до 20 °C, моноклинная от 20 до 339 °C, ромбическая от 339 до 740 °C, тетрагональная при температуре от 740 до 1470 °C[1].
При температуре выше 800 °C заметно возгоняется, в газовой фазе существует в виде ди-, три- и тетрамеров[1].
Химические
В воде и минеральных кислотах (за исключением фтороводородной кислоты) практически не растворяется. До металла может быть восстановлен водородом при температуре 700—900 °C, углеродом при температуре 1000 °C[1] или другими металлами:
- ;
- ;
- ;
- .
Получение
Триоксид вольфрама получают термическим разложением гидрата (вольфрамовой кислоты) или паравольфрамата аммония при температуре 500—800 °C[1].
- ;
- .
Или из вольфрамата кальция (минерал шеелит) действием соляной кислоты с последующим разложением образующейся вольфрамовой кислоты:
- ,
- .
Другой способ получения — окисление металлического вольфрама в атмосфере кислорода или на воздухе при температуре выше 500 °C[1]. Эта реакция происходит при включении потерявшей герметичность лампы накаливания, триоксид вольфрама при этом оседает на внутренних стенках колбы лампы в виде светло-жёлтого налёта:
- .
Применение
Триоксид вольфрама применяется для получения карбидов и галогенидов вольфрама, металлического вольфрама.
Из-за насыщенного жёлтого цвета применяется в качестве жёлтого пигмента для придания цвета стеклу и керамике[2].
Для придания огнестойкости тканям[3].
Используется в датчиках газоанализаторов на озон[4].
Используется в производстве сцинтилляторов и люминофоров содержащих вольфраматы бария или стронция.
В последние время триоксид вольфрама нашёл применение в производстве электрохромного оконного стекла. Светопропускание застеклённых таким стеклом окон можно варьировать изменяя управляющее электрическое напряжение, прикладываемое к плёнку электрофотохромного материала[5][6].
Также применяется в качестве катализатора гидрогенизации при крекинга углеводородов[1].
Примечания
- ↑ 1 2 3 4 5 6 Вольфрама оксиды // Химическая энциклопедия, под. ред. Кнунянца И. Л., т. 1. — М.: «Советская энциклопедия», 1988, стр 421.
- ↑ Patnaik, Pradyot. Handbook of Inorganic Chemical Compounds. — McGraw-Hill, 2003. — ISBN 978-0-07-049439-8.
- ↑ «Tungsten trioxide.» The Merck Index Vol 14, 2006.
- ↑ David E Williams et al, «Modelling the response of a tungsten oxide semiconductor as a gas sensor for the measurement of ozone», Meas. Sci. Technol. 13 923, doi:10.1088/0957-0233/13/6/314.
- ↑ Lee, W. J.; Fang, Y. K.; Ho, Jyh-Jier; Hsieh, W. T.; Ting, S. F.; Huang, Daoyang; Ho, Fang C. (2000). "Effects of surface porosity on tungsten trioxide(WO3) films' electrochromic performance". Journal of Electronic Materials. 29 (2): 183—187. doi:10.1007/s11664-000-0139-8.
- ↑ K. J. Patel et al., All-Solid-Thin Film Electrochromic Devices Consisting of Layers ITO / NiO / ZrO2 / WO3 / ITO, J. Nano-Electron. Phys. 5 No 2, 02023 (2013)
Ссылки
- (англ.) Lassner, Erik and Wolf-Dieter Schubert (1999). Tungsten: Properties, Chemistry, Technology of the Element, Alloys, and Chemical Compounds. New York: Kluwer Academic. ISBN 0-306-45053-4
- (англ.) «Tungsten trioxide.» The Merck Index Vol 14, 2006
- International Tungsten Industry Association
- Preparation of tungsten trioxide electrochromic films
- Sigma Aldrich (supplier)






![{\displaystyle {\ce {(NH4)10[H2W12O42].4H2O}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/f9449282af97f2f259a175ead9ad501c44bff8ca)

![{\displaystyle {\ce {(NH4)10[H2W12O42].4H2O -> 12WO3 + 10NH3 + 11H2O}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/5c79dcd86b6e6126c260d68c8fef0e9bbf2ac113)


