Оксид вольфрама(VI)
| Оксид вольфрама(VI) | |
|---|---|
 | |
 | |
| Общие | |
| Систематическое наименование |
Окись вольфрама(VI) |
| Традиционные названия | триоксид вольфрама, трёхокись вольфрама, вольфрамовый ангидрид |
| Хим. формула | WO3 |
| Физические свойства | |
| Молярная масса | 231,8393 г/моль |
| Классификация | |
| Рег. номер CAS | 1314-35-8 |
| PubChem | 14811 |
| Рег. номер EINECS | 215-231-4 |
| SMILES | |
| InChI | |
| RTECS | YO7760000 |
| ChemSpider | 14127 |
| Приведены данные для стандартных условий (25 °C, 100 кПа), если не указано иное. | |
Окси́д вольфра́ма(VI) (другие используемые названия — триоксид вольфрама, трёхокись вольфрама, вольфрамовый ангидрид, ангидрид вольфрамовой кислоты́) — бинарное химическое соединение кислорода и переходного металла вольфрама.
Обладает кислотными свойствами.
Свойства[править | править код]
Физические[править | править код]
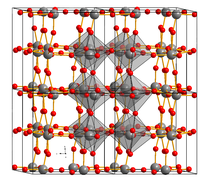
Мелкокристаллический порошок лимонно-жёлтого цвета. Плотность 7,2—7,4 г/см³. Температура плавления 1470 °C, температура кипения 1700 °С.
Кристаллическая структура соединения зависит от температуры. Устойчивая моноклинная до −27 °C, триклинная в диапазоне температур от −27 до 20 °C, моноклинная от 20 до 339 °C, ромбическая от 339 до 740 °C, тетрагональная при температуре от 740 до 1470 °C[1].
При температуре выше 800 °C заметно возгоняется, в газовой фазе существует в виде ди-, три- и тетрамеров[1].
Химические[править | править код]
В воде и минеральных кислотах (за исключением фтороводородной кислоты) практически не растворяется. До металла может быть восстановлен водородом при температуре 700—900 °C, углеродом при температуре 1000 °C[1] или другими металлами:
- ;
- ;
- ;
- .
Получение[править | править код]
Триоксид вольфрама получают термическим разложением гидрата (вольфрамовой кислоты) или паравольфрамата аммония при температуре 500—800 °C[1].
- ;
- .
Или из вольфрамата кальция (минерал шеелит) действием соляной кислоты с последующим разложением образующейся вольфрамовой кислоты:
- ,
- .
Другой способ получения — окисление металлического вольфрама в атмосфере кислорода или на воздухе при температуре выше 500 °C[1]. Эта реакция происходит при включении потерявшей герметичность лампы накаливания, триоксид вольфрама при этом оседает на внутренних стенках колбы лампы в виде светло-жёлтого налёта:
- .
Применение[править | править код]
Триоксид вольфрама применяется для получения карбидов и галогенидов вольфрама, металлического вольфрама.
Из-за насыщенного жёлтого цвета применяется в качестве жёлтого пигмента для придания цвета стеклу и керамике[2].
Для придания огнестойкости тканям[3].
Используется в датчиках газоанализаторов на озон[4].
Используется в производстве сцинтилляторов и люминофоров содержащих вольфраматы бария или стронция.
В последние время триоксид вольфрама нашёл применение в производстве электрохромного оконного стекла. Светопропускание застеклённых таким стеклом окон можно варьировать изменяя управляющее электрическое напряжение, прикладываемое к плёнке электрофотохромного материала[5][6].
Также применяется в качестве катализатора гидрогенизации при крекинга углеводородов[1].
Примечания[править | править код]
- ↑ 1 2 3 4 5 6 Вольфрама оксиды // Химическая энциклопедия, под. ред. Кнунянца И. Л., т. 1. — М.: «Советская энциклопедия», 1988, стр 421.
- ↑ Patnaik, Pradyot. Handbook of Inorganic Chemical Compounds. — McGraw-Hill, 2003. — ISBN 978-0-07-049439-8. Архивная копия от 8 июля 2020 на Wayback Machine
- ↑ «Tungsten trioxide.» The Merck Index Vol 14, 2006.
- ↑ David E Williams et al, «Modelling the response of a tungsten oxide semiconductor as a gas sensor for the measurement of ozone», Meas. Sci. Technol. 13 923, doi:10.1088/0957-0233/13/6/314.
- ↑ Lee, W. J.; Fang, Y. K.; Ho, Jyh-Jier; Hsieh, W. T.; Ting, S. F.; Huang, Daoyang; Ho, Fang C. (2000). "Effects of surface porosity on tungsten trioxide(WO3) films' electrochromic performance". Journal of Electronic Materials. 29 (2): 183—187. doi:10.1007/s11664-000-0139-8.
- ↑ K. J. Patel et al., All-Solid-Thin Film Electrochromic Devices Consisting of Layers ITO / NiO / ZrO2 / WO3 / ITO, J. Nano-Electron. Phys. 5 No 2, 02023 (2013)
Ссылки[править | править код]
- (англ.) Lassner, Erik and Wolf-Dieter Schubert (1999). Tungsten: Properties, Chemistry, Technology of the Element, Alloys, and Chemical Compounds. New York: Kluwer Academic. ISBN 0-306-45053-4
- (англ.) «Tungsten trioxide.» The Merck Index Vol 14, 2006
- International Tungsten Industry Association Архивная копия от 21 июля 2011 на Wayback Machine
- Preparation of tungsten trioxide electrochromic films Архивная копия от 30 сентября 2007 на Wayback Machine
- Sigma Aldrich (supplier) Архивная копия от 11 октября 2007 на Wayback Machine






![{\displaystyle {\ce {(NH4)10[H2W12O42].4H2O}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/f9449282af97f2f259a175ead9ad501c44bff8ca)

![{\displaystyle {\ce {(NH4)10[H2W12O42].4H2O -> 12WO3 + 10NH3 + 11H2O}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/5c79dcd86b6e6126c260d68c8fef0e9bbf2ac113)


