Миколовые кислоты: различия между версиями
| [отпатрулированная версия] | [отпатрулированная версия] |
Эрг (обсуждение | вклад) |
Эрг (обсуждение | вклад) |
||
| Строка 12: | Строка 12: | ||
== Синтез == |
== Синтез == |
||
Наличие миколовых кислот у ''M. tuberculosis'' делает её устойчивой ко многим видам медикаментозного лечения, и их синтез абсолютно необходим для выживания этого патогена. Именно по этой причине синтез миколовых кислот был наиболее детально изучен у этого организма<ref name="Pathway"/><ref>{{Cite journal |
|||
| last1 = Raman | first1 = K. |
|||
| last2 = Rajagopalan | first2 = P. |
|||
| last3 = Chandra | first3 = N. |
|||
| doi = 10.1371/journal.pcbi.0010046 |
|||
| title = Flux Balance Analysis of Mycolic Acid Pathway: Targets for Anti-Tubercular Drugs |
|||
| journal = PLoS Computational Biology |
|||
| volume = 1 |
|||
| issue = 5 |
|||
| pages = e46 |
|||
| year = 2005 |
|||
| pmid = 16261191 |
|||
| pmc =1246807 |
|||
}}</ref>. Процесс включает пять стадий, идущих в следующем порядке<ref>{{Cite journal |
|||
| author= Bhatt A., Molle V., Besra G. S., Jacobs W. R., Kremer L. |
|||
| title = The Mycobacterium tuberculosis FAS-II condensing enzymes: Their role in mycolic acid biosynthesis, acid-fastness, pathogenesis and in future drug development |
|||
| doi = 10.1111/j.1365-2958.2007.05761.x |
|||
| journal = Molecular Microbiology |
|||
| volume = 64 |
|||
| issue = 6 |
|||
| pages = 1442–1454 |
|||
| year = 2007 |
|||
| pmid = 17555433 |
|||
| pmc = |
|||
}}</ref>: |
|||
* Синтез C26 насыщенной жирной кислоты ферментом [[синтаза жирных кислот]] I типа, которая становится α-алкиловой ветвью миколовой кислоты; |
|||
* Синтез C56 жирной кислоты [[синтаза жирных кислот|синтазой жирных кислот]] II типа из которой получается меромиколовая основа; |
|||
* Введение в меромиколовую цепь функциональных групп при помощи множества циклопропансинтаз; |
|||
* Реакция конденсации α-ветви и меромиколовой цепи ферментом [[поликетидсинтаза]] Pks13, после чего происходит финальная реакция синтеза миколовых кислот - восстановление ферментом коринебактериальной миколатредуктазой A (CmrA)<ref>{{cite journal|author=David J, Lea-Smith J James S. Pyke, Dedreia Tull, Malcolm J. McConville, Ross L. Coppel, Paul K. Crellin|title=The Reductase That Catalyzes Mycolic Motif Synthesis Is Required for Efficient Attachment of Mycolic Acids to Arabinogalactan|journal=Journal of Biological Chemistry|year=2007|volume=282|issue=15|pages=11000–11008|doi=10.1074/jbc.M608686200|pmid=17308303}}</ref>; |
|||
* Соединение остатка миколовой кислоты с арабиногалактаном или другим сахаром, например [[тригалоза|тригалозой]], при помощи комплекса антигена 85; |
|||
== Функции == |
== Функции == |
||
Миколовые кислоты выполняют следующие функции: |
Миколовые кислоты выполняют следующие функции: |
||
Версия от 18:12, 13 февраля 2016
Микóловые кислóты (от лат. Myco — гриб) — обобщённое название группы длинноцепочечных разветвлённых жирных кислот, имеющие общую формулу R1-CHOH-CHR2-COOH[1], с перекрестными сшивками, содержащие по 60-90 атомов углерода в молекуле (С60-С90). Являются исключительным компонентом клеточной стенки микобактерий, включая патогенную Mycobacterium tuberculosis. Выполняют защитную функцию, благодаря низким реакционным способностям этих кислот, которые делают поверхность микобактерий воскообразной и сильно гидрофобной[1], очень устойчивы к негативному внешнему воздействию. Это способствует их выживанию в экстремальных условиях (кипячение, растворение в серной кислоте итд.). Миколовые кислоты M.tuberculosis являются самыми длинными и имеют наибольшие боковые цепи (С20-С24)[2]. Большинство миколовых кислот также содержат различные функциональные группы.
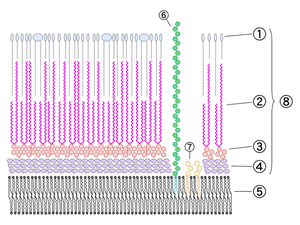
Строение на примере M. tuberculosis

M. tuberculosis синтезирует три основных типа миколовых кислот: альфа-, метокси- и кетомиколовые кислоты. Они представляют собой β-гидроксижирные гидрофобные кислоты с длинной α-алкилированной боковой цепью из котрых α-миколовая кислота является самой распространенной формой (>70 %) и представляет собой цис-дициклопропил жирную кислоту. Метокси-миколовые кислоты, содержат несколько метоксигрупп, и составляют около 10-15 % от общего количества миколовых кислот. Кето-миколовые кислоты, в молекулах которых содержатся несколько кетоновых групп, составляют 10-15 % от общего количества миколовых кислот.
Циклопропановое кольцо, входящее в состав миколовых кислот способствует структурной целостности и защищает клеточную стенку микобактерии от окислительного стресса[3].
Во внутреннем слое, внешней мембраны микобактерий миколовые кислоты ковалентно связаны с полисахаридом арабиногалактаном, образущие с ним комплекс арбиногалактан-миколат. Посредством арабиногалактана, связываются с муреином. Внешний слой образован гликолипидной оболочкой, в которой миколовые кислоты не связаны ковалентно с полисахаридом[3].
Синтез
Наличие миколовых кислот у M. tuberculosis делает её устойчивой ко многим видам медикаментозного лечения, и их синтез абсолютно необходим для выживания этого патогена. Именно по этой причине синтез миколовых кислот был наиболее детально изучен у этого организма[4][5]. Процесс включает пять стадий, идущих в следующем порядке[6]:
- Синтез C26 насыщенной жирной кислоты ферментом синтаза жирных кислот I типа, которая становится α-алкиловой ветвью миколовой кислоты;
- Синтез C56 жирной кислоты синтазой жирных кислот II типа из которой получается меромиколовая основа;
- Введение в меромиколовую цепь функциональных групп при помощи множества циклопропансинтаз;
- Реакция конденсации α-ветви и меромиколовой цепи ферментом поликетидсинтаза Pks13, после чего происходит финальная реакция синтеза миколовых кислот - восстановление ферментом коринебактериальной миколатредуктазой A (CmrA)[7];
- Соединение остатка миколовой кислоты с арабиногалактаном или другим сахаром, например тригалозой, при помощи комплекса антигена 85;
Функции
Миколовые кислоты выполняют следующие функции:
- Защитная — от ферментативного расщепления, обезвоживания, химического и теплового воздействия. Снижает эффективность гидрофобных антибиотиков. Позволяет патогену M. tuberculosis расти внутри макрофагов, пряча его от иммунной системы[4].
- Секреторная — участвуют в выделении фактора вирулентности микобактерий (например, липопротеина Ag85, M.tuberculosis)[3].
Примечания
- ↑ 1 2 Шлегель Г. Общая микробиология. — М.: Мир, 1987. — С. 97. — 567 с.
- ↑ Katsube T, Matsumoto S, Takatsuka M, Okuyama M, Ozeki Y, Naito M, Nishiuchi Y, Fujiwara N, Yoshimura M, Tsuboi T, Torii M, Oshitani N, Arakawa T, Kobayashi K. J Bacteriol 2007 Nov; 189(22): 8241-8249
- ↑ 1 2 3 Takayama K, Wang C, Besra GS. Clin Microbiol Rev 2005 Jan; 18(1): 81-101
- ↑ 1 2 Takayama K., Wang C., Besra G. S. (2005). "Pathway to Synthesis and Processing of Mycolic Acids in Mycobacterium tuberculosis". Clinical Microbiology Reviews. 18 (1): 81—101. doi:10.1128/CMR.18.1.81-101.2005. PMC 544180. PMID 15653820.
{{cite journal}}: Википедия:Обслуживание CS1 (множественные имена: authors list) (ссылка) - ↑ Raman, K.; Rajagopalan, P.; Chandra, N. (2005). "Flux Balance Analysis of Mycolic Acid Pathway: Targets for Anti-Tubercular Drugs". PLoS Computational Biology. 1 (5): e46. doi:10.1371/journal.pcbi.0010046. PMC 1246807. PMID 16261191.
{{cite journal}}: Википедия:Обслуживание CS1 (не помеченный открытым DOI) (ссылка) - ↑ Bhatt A., Molle V., Besra G. S., Jacobs W. R., Kremer L. (2007). "The Mycobacterium tuberculosis FAS-II condensing enzymes: Their role in mycolic acid biosynthesis, acid-fastness, pathogenesis and in future drug development". Molecular Microbiology. 64 (6): 1442—1454. doi:10.1111/j.1365-2958.2007.05761.x. PMID 17555433.
{{cite journal}}: Википедия:Обслуживание CS1 (множественные имена: authors list) (ссылка) - ↑ David J, Lea-Smith J James S. Pyke, Dedreia Tull, Malcolm J. McConville, Ross L. Coppel, Paul K. Crellin (2007). "The Reductase That Catalyzes Mycolic Motif Synthesis Is Required for Efficient Attachment of Mycolic Acids to Arabinogalactan". Journal of Biological Chemistry. 282 (15): 11000—11008. doi:10.1074/jbc.M608686200. PMID 17308303.
{{cite journal}}: Википедия:Обслуживание CS1 (множественные имена: authors list) (ссылка) Википедия:Обслуживание CS1 (не помеченный открытым DOI) (ссылка)