Реакция Лемгрубера — Бачо
Реакция Лемгрубера — Бачо — синтез индолов из о-нитротолуола 1 через промежуточное образование енамина 2.[1][2][3] На первой стадии с помощью диметилацеталя N,N-диметилформамида и пирролидина образуется енамин 2.[4] Индол 3 образуется на второй стадии восстановлением енамина 2 с последующей циклизацией.
Эффективными восстановителями для второй стадии являются никель Ренея и гидразин (восстановление диимином), палладий на угле и водород, хлорид олова, дитионит натрия[5] или железо в уксусной кислоте[6].
Механизм реакции[править | править код]
На первой стадии происходит взаимодействие диметилацеталя N,N-диметилформамида с пирролидином с выделением диметиламина и образованием более реакционноспособной частицы 4. Метильная группа нитротолуола может депротонироваться в условиях реакции, образующийся карбанион атакует частицу 4 с получением енамина 2 и отщеплением двух молекул метанола. Это взаимодействие может осуществляться и без пирролидина, через N,N-диметиленамин, но в некоторых случаях это значительно увеличивает время реакции.
На второй стадии нитрогруппа превращается соответствующим восстановителем в аминогруппу. Последующая циклизация с отщеплением пирролидина приводит к индолу 3.
Эта реакция стала использоваться в промышленности ещё до того, как отдельные стадии были описаны в научной литературе. Поскольку индолы факмакологически активны, их синтез является важным для фармацевтического производства. Этот процесс стал популярной альтернативой синтезу индолов по Фишеру, потому что многие о-нитротолуолы коммерчески доступны или могут быть легко получены. Кроме того, индолы получаются с высокими выходами и в мягких условиях.
Промежуточно получаемый енамин является «пуш-пул» олефином, обладающим электронноакцепторным заместителем с одной стороны и электроннодонорным — с другой. Высокая степень сопряжения обуславливает интенсивную красную окраску этих соединений.
Примеры[править | править код]
Восстановительная циклизация динитростирола[править | править код]
Восстановительная циклизация динитростирола 5 оказалась эффективной для синтеза 2-алкил-7-метоксииндолов, в то время как большинство основных методов оказались неприемлемы[7].
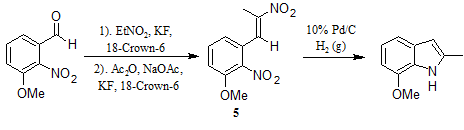 Большинство стандартных методов восстановления могут успешно применяться для этой реакции.
Большинство стандартных методов восстановления могут успешно применяться для этой реакции.
Синтез изонитрила N-метилвелвитиндолинона D[править | править код]
Эта реакция является первой стадией в синтезе изонитрила N-метилвелвитиндолинона D 6 , осуществленного В. Равалем в Университете Чикаго[8].

Примечания[править | править код]
- ↑ Batcho, A. D.; Leimgruber, W. U.S. Patent 3,976,639.
- ↑ Batcho, A. D.; Leimgruber, W. U.S. Patent 3,732,245.
- ↑ Batcho, A. D.; Leimgruber, W. INDOLES FROM 2-METHYLNITROBENZENES BY CONDENSATION WITH FORMAMIDE ACETALS FOLLOWED BY REDUCTION: 4-BENZYLOXYINDOLE // Org. Synth.. — 1985. — Т. 63. — С. 214-220. Архивировано 4 февраля 2012 года.
- ↑ Maehr, H.; Smallheer, J. M. A new approach to 4-substituted indoles // J. Org. Chem.. — 1981. — Т. 46. — С. 1753. — doi:10.1021/jo00321a053. Архивировано 10 ноября 2021 года.
- ↑ Garcia, E. E.; Fryer, R. I. A new synthesis of o-nitrobenzylketones // J. Het. Chem.. — 1974. — Т. 11. — С. 219-221. — doi:10.1002/jhet.5570110220.
- ↑ Ponticello, G. S.; Baldwin, J. J. Useful synthesis of 4-substituted indoles // J. Org. Chem.. — 1979. — Т. 44. — С. 4003-4005. — doi:10.1021/jo01336a065. Архивировано 10 ноября 2021 года.
- ↑ Chen, B.-C.; Hynes, Jr., J.; Randit, C. R.; Zhao, R.; Skoumbourdis, A. P.; Wu, H.; Sundeen, J. E.; Leftheris. A General Large Scale Synthesis of 2-Alkyl-7-methoxyindoles // Heterocycles. — 2001. — Т. 55. — С. 951-960. — doi:10.3987/COM-01-9162. (недоступная ссылка)
- ↑ V. Bhat, K. M. Allan, V. H. Rawal. Total Synthesis of N-Methylwelwitindolinone D Isonitrile // J. Am. Chem. Soc.. — 2011. — Т. 133. — С. 5798. — doi:10.1021/ja201834u. Архивировано 15 апреля 2017 года.
На эту статью не ссылаются другие статьи Википедии. |


