Релятивистская квантовая химия
Релятивистская квантовая химия — раздел квантовой химии, использующий понятия из области квантовой механики и теории относительности для объяснения и предсказания свойств и структур соединений или атомов. Речь идёт об атомах, электроны которых имеют характерные скорости движения близкие к скорости света (0,2 с и выше). Примером могут служить атомы тяжёлых и сверхтяжёлых элементов.
Первоначально квантовая механика была разработана без учёта теории относительности[1]. «Релятивистскими эффектами» являются расхождения между значениями, рассчитанными с помощью моделей с учётом и без учёта теории относительности. Релятивистские эффекты имеют важное значение для элементов с большими атомными номерами. Например, для лантаноидов и актиноидов[2].
История[править | править код]
Начиная с 1935 года, Берта Свелс провела релятивистское описание многоэлектронных систем[3], вопреки сделанному в 1929 году Полем Дираком заявлению, что единственные недостатки, остающиеся в квантовой механике «… приводят к возникновению трудностей только тогда, когда задействованы высокоскоростные частицы, и поэтому не имеют значения при рассмотрении строения атомов и молекул и обычных химических реакций, в которых обычные квантово-механические расчёты, как правило, достаточно точны, если пренебречь релятивистским изменением массы и скорости, и принимать в расчёт только кулоновское взаимодействие между электронами и атомными ядрами»[4].
Химики-теоретики в целом соглашались с заявлением Дирака вплоть до 1970-х годов, когда появились работы, которые показали реализацию релятивистских эффектов в соединениях тяжёлых элементов[5]. Уравнение Шрёдингера в оригинальной статье 1926 года не учитывала теорию относительности. Релятивистские поправки к уравнению были сделаны позже (см. уравнения Клейна-Гордона-Фока), чтобы объяснить тонкую структуру атомных спектров. Однако эти и другие поправки к уравнению Шрёдингера не сразу получили распространение в химическом сообществе. Поскольку атомные спектры разрабатывались в значительной степени в области физики, а не химии, большинство химиков не были знакомы с релятивистской квантовой механикой, а их внимание было сосредоточено на свойствах более лёгких элементов[2].
Мнение Дирака о роли релятивистских эффектов для квантовой химии оказалось ошибочным по двум причинам:
- электроны s- и р-орбиталей движутся со значительной долей скорости света, если боровский радиус и заряд ядра достаточно велики
- существуют косвенные последствия релятивистских эффектов, которые особенно заметны для d- и f-атомных орбиталей[5].
Качественное описание[править | править код]
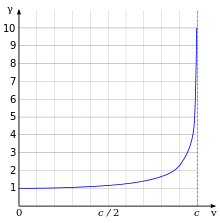
Одним из наиболее важных и известных результатов релятивистской механики является то, что релятивистская масса электрона увеличивается
где — масса покоя электрона, скорость электрона и скорость света соответственно. Рисунок справа иллюстрирует изменение релятивистской массы электрона в зависимости от его скорости. Изменение массы электрона непосредственно влияет на боровский радиус этого электрона
где — приведённая постоянная Планка, а α — постоянная тонкой структуры (релятивистская поправка к модели Бора)
Арнольд Зоммерфельд подсчитал, что для 1s-электрона атома водорода орбитальный радиус 0,0529 нм и α ≈ 1/137. То есть, такой электрон движется почти с 1/137 скорости света[6]. Можно распространить этот результат на более сложные электронные системы, используя для грубой оценки вклада релятивистских эффектов формулу v ≈ Zc/137 для 1s-электрона, где v является радиальной скоростью этого электрона, Z — заряд ядра (или порядковый номер элемента в таблице Менделеева), а с — скорость света. Например, для золота (Z = 79) получается результат α = 0,58c — то есть он имеет скорость, близкую к 58 % скорости света. Подставляя это в отношение v/c для расчёта релятивистской массы, получаем mrel = 1.22me. Используя это для оценки боровского радиуса , получаем, что он изменяется на 22 % по сравнению с нерялитивистским радиусом для такого же электрона.
Если подставить в уравнение для релятивистской массы радиус Бора, то можно записать
тогда
Рисунок справа показывает, как изменяется отношение релятивистского радиуса Бора к нерелятивистскому в зависимости от скорости электрона. Обратите внимание на то, что релятивистская модель предсказывает уменьшение радиуса с увеличением скорости.

Когда боровское описание распространяется на водородоподобные атомы с помощью квантового правила, радиус Бора становится
где — главное квантовое число, а Z — атомный номер. В квантовой механике момент импульса описывается как . Если подставить это в уравнение выше, то для получается выражение
Используя атомную систему единиц, можно упростить выражение
Подставляя это в приведённое выше отношение Бора, получаем
При низком значении и высоком значении будет . Это интуитивно понятно: электроны с более низкими главными квантовыми числами будет иметь более высокую плотность вероятности нахождения у ядра. Ядро с большим зарядом придаёт электронам более высокую скорость (кулоновское взаимодействие прямо пропорционально величине заряда). Более высокая скорость означает повышенную релятивистскую массу, в результате чего такие электроны будут больше времени находиться вблизи ядра (в квантовой механике полная энергия электрона обратно пропорциональна массе электрона и прямо пропорциональна характерному расстоянию электрона от ядра) и тем самым понижают эффективный радиус орбиталей этих электронов[7].
Влияние на периодичность свойств элементов[править | править код]
Многие из химических и физических различий между 6-м периодом (Cs-Rn) и 5-м периодом (Rb-Xe) возникают из значительных релятивистских эффектов для элементов 6-го периода. Большой заряд ядра и одновременная удаленность электронов от него (на внешних оболочках) заставляет последних двигаться с околосветовыми скоростями. Эти релятивистские эффекты особенно велики для золота, платины[8] и ртути.
Ртуть[править | править код]
Ртуть (Hg) имеет температуру плавления Тпл.= −39 °C. Связи между атомами ртути Hg-Hg в её кристаллической решётке слабее, чем в простых веществах соседних с ней элементов — кадмия (Тпл.=321 °C) и золота (Тпл.=1064 °C). Лантаноидное сжатие даёт только частичное объяснение этой аномалии. В отличие от многих металлов, в газовой фазе ртуть также обнаруживается в одноатомной форме Hg(g). Также в газовой фазе обнаруживаются и стабильные частицы вида Hg22+(g). Перечисленные три свойства могут быть объяснены исходя из релятивистских свойств внешних электронных оболочек атомов ртути[6].
Hg2(g) не формируется потому, что 6s2-орбиталь сжимается благодаря релятивистскому эффекту и из-за этого мало подходит для образования каких-либо связей с другими атомами; на самом деле Hg-Hg соединение должно быть в основном результатом ван-дер-ваальсовых сил, что объясняет, почему взаимодействие Hg-Hg достаточно слабое, чтобы позволить ртути быть жидкостью при комнатной температуре[6].
Разница между Au2(g) и Hg(g) сходна с разницей между H2(g) и He(g). Релятивистское сжатие 6s2-орбитали меняет свойства ртути таким образом, что газообразная ртуть может быть названа «псевдо-благородным газом»[6].
Цвет золота и цезия[править | править код]

Отражательные свойства Au, Ag, Al показаны на рисунке справа. Человеческий глаз видит электромагнитное излучение с длиной волны около 600 нм как жёлтый свет. Как видно из его спектра отражения, золото кажется жёлтым, так как оно поглощает синий свет больше, чем другие видимые длины волн света. В отражённом свете (который и определяет то, что мы видим) меньше представлена синяя часть оптического спектра.
Поглощение света происходит за счёт электронного перехода 5d --> 6s уровня. Аналогичный переход происходит и в случае Ag, но релятивистские эффекты ниже для Ag. Несмотря на небольшое сжатие 4d- и 5s-орбиталей, расстояние (разница энергий) между ними для Ag по-прежнему намного больше, чем 5d-6s расстояния у Au, так как релятивистские эффекты в последнем случае значительно сильнее. Таким образом, нерелятивистское золото будет белым. Релятивистские эффекты обеспечивают повышение энергии 5d-орбитали и снижение энергии 6s-орбитали[9].
Аналогичный эффект имеет место для цезия. В то время как другие щелочные металлы серебристо-белые, цезий имеет ярко выраженный золотистый оттенок.
Прочие явления[править | править код]
Другие явления, обычно объясняемые с помощью релятивистских эффектов:
- Существование фторида ртути (IV)[10][11]
- Аурофильность[12][13]
- Кристаллическая структура свинца (ГЦК вместо алмазоподобной)
- Поразительное сходство между цирконием и гафнием
- Небольшие атомные радиусы франция и радия
- Около 10 % лантаноидного сжатия объясняется релятивистской поправкой к массе электрона
- Для некоторых элементов (например, золото-79 — которое почти вдвое плотнее, чем свинец-82) значительно больше 10 % сжатия объясняется релятивистской поправкой
Влияние на структуру соединений[править | править код]
С помощью релятивистских эффектов объясняют стабильность анионов «благородных» металлов в таких соединениях, как
- аурид цезия[14]
- платиниды цезия[15] и бария
- Стабильность катиона уранила, а также катионов соседних с ураном актиноидов (Pa-Am) в высоких степенях окисления
- Повышение степени ковалентности связей M-L (металл-неметалл) в соединениях трансактиниевых элементов. На примере соединений вида ML5 четырёх элементов, показано, что ковалентность связей повышается в результате понижения эффективного заряда на атомах металла и повышения заселённости связывающих орбиталей[2].
Литература[править | править код]
- Мотт Н, Снеддон И. «Волновая механика и её применения». — М.:Наука, 1966. — 430 с.
- Зайцевский А. В. «Релятивистская теория строения молекул». — М.: Изд-во МГУ, 2005. — 93 с.
- Kaldor, U.; Wilson, Stephen «Theoretical Chemistry and Physics of Heavy and Superheavy Elements» — Dordrecht, Netherlands: Kluwer Academic Publishers, 2003.
- Liu W. «Handbook of Relativistic Quantum Chemistry» — Springer, 2017. — 907 p. — ISBN 978-3-642-40766-6; 978-3-642-40765-9
- De Jong W.A. «Relativistic Quantum Chemistry Applied» — Wibe Albert de Jong, 1997. — 159 p.
- Dyall K.G., Knut F. «Introduction to relativistic quantum chemistry» — Oxford University Press, 2007. — 545 p.
- Hess B.A. «Relativistic effects in heavy-element chemistry and physics» — John Wiley & Sons Ltd, 2003. — 301 p.
- Reiher M., Wolf A. «Relativistic Quantum Chemistry. The Fundamental Theory of Molecular Science» — Wiley-VCH, 2014. — 765 p.
Примечания[править | править код]
- ↑ Kleppner, Daniel (1999). «A short history of atomic physics in the twentieth century» Reviews of Modern Physics. 71 (2) doi:10.1103/RevModPhys.71.S78
- ↑ 1 2 3 Kaldor, U.; Wilson, Stephen (2003). Theoretical Chemistry and Physics of Heavy and Superheavy Elements. Dordrecht, Netherlands: Kluwer Academic Publishers.
- ↑ Swirles, B. (1935). «The Relativistic Self-Consistent Field». Proceedings of the Royal Society A: Mathematical, Physical and Engineering Sciences. 152 (877): 625. doi:10.1098/rspa.1935.0211.
- ↑ Dirac, P. A. M. (1929). «Quantum Mechanics of Many-Electron Systems». Proceedings of the Royal Society A: Mathematical, Physical and Engineering Sciences. 123 (792): 714. doi:10.1098/rspa.1929.0094
- ↑ 1 2 Pyykko, Pekka (1988). «Relativistic effects in structural chemistry». Chemical Reviews. 88 (3): 563. doi:10.1021/cr00085a006
- ↑ 1 2 3 4 Norrby, Lars J. Why is mercury liquid? Or, why do relativistic effects not get into chemistry textbooks? (англ.) // Journal of Chemical Education. — 1991. — February (iss. 68, no. 2). — P. 110. — doi:10.1021/ed068p110.
- ↑ Pitzer, Kenneth S. (1979). «Relativistic effects on chemical properties». Accounts of Chemical Research. 12 (8): 271. doi:10.1021/ar50140a001
- ↑ Martin Jansen «Effects of relativistic motion of electrons on the chemistry of gold and platinum» Solid State Sciences 7 (2005): 1464—1474 doi:10.1016/j.solidstatesciences.2005.06.015
- ↑ Pyykko, Pekka; Desclaux, Jean Paul (1979). «Relativity and the periodic system of elements». Accounts of Chemical Research. 12 (8): 276. doi:10.1021/ar50140a002
- ↑ Xuefang Wang; Lester Andrews; Sebastian Riedel; Martin Kaupp (2007). «Mercury Is a Transition Metal: The First Experimental Evidence for HgF4.». Angew. Chem. Int. Ed. 46 (44): 8371-8375. doi:10.1002/anie.200703710
- ↑ Martin Kaupp, Hans Georg von Schnering, «Gaseous Mercury(IV) Fluoride, HgF4: An Ab Initio Study», Angewandte Chemie International Edition in English, 32/6 (1993) 861—863. doi: 10.1002/anie.199308611
- ↑ Hubert Schmidbaur (2000). «The Aurophilicity Phenomenon: A Decade of Experimental Findings, Theoretical Concepts and Emerging Application». Gold Bulletin. 33 (1): 3-10. doi:10.1007/BF03215477
- ↑ Hubert Schmidbaur (1995). «Ludwig Mond Lecture. High-carat gold compounds». Chem. Soc. Rev. 24 (6): 391—400. doi:10.1039/CS9952400391
- ↑ Sommer A.H. Nature 152 (1943) 215
- ↑ Smetana V, Mudring A.V. «Cesium Platinide Hydride 4Cs2 Pt⋅CsH: An Intermetallic Double Salt Featuring Metal Anions» Angew Chem Int Ed Engl. 2016 Nov 14;55(47):14838-14841. doi: 10.1002/anie.201606682




















