Хемиосмос
Хемиосмос — биохимический механизм, с помощью которого осуществляется превращение энергии цепи переноса электронов в энергию АТФ. Включает изменение электрохимического потенциала клеточной мембраны.
Центральный постулат хемиосмотической гипотезы Митчелла гласит, что электронпереносящие цепи митохондрий, хлоропластов и бактерий сопряжены с системой синтеза АТФ через разность электрохимических потенциалов протонов на сопрягающих мембранах. Электрохимический потенциал протонов служит термодинамической мерой того, насколько градиент протонов через мембрану далёк от равновесия. Перенос электронов и синтез АТФ сопряжены с работой двух различных обратимых протонных помп. При переносе электронов образуется разность потенциалов, которая затем используется для обращения протонной помпы, гидролизующей АТФ (АТФ-синтаза), то есть для синтеза АТФ.
Просматривается аналогия между электрической цепью и протонным циклом. В обоих случаях имеются генераторы потенциала (батарея и дыхательная цепь), а также потенциал (разность электрических потенциалов и разность электрохимических потенциалов протонов), который измеряется в вольтах. И в том и в другом случае потенциал можно использовать для совершения работы (свет лампы и синтез АТФ). Обе цепи могут быть замкнуты накоротко. Скорости химических реакций как в батарее, так и в дыхательной цепи тесно связаны с током электронов и протонов в остальной части цепи, а он в свою очередь зависит от сопротивления в этой части цепи. При увеличении тока потенциал в обеих цепях падает.
Хемиосмотическая теория[править | править код]
Питер Д. Митчелл предложил хемиосмотическую гипотезу в 1961 году[1].
Протон-движущая сила[править | править код]
Движение ионов через мембрану зависит от комбинации двух факторов:
- диффузионной силой, которая обусловлена градиентом концентрации (химическим градиентом или разницей концентраций) — все частицы имеют тенденцию диффундировать из области с более высокой концентрацией в область с более низкой концентрацией.
- электростатической силы, вызванной градиентом электрических потенциалов — катионами, такими как протоны Н+, как правило, они имеют тенденцию диффундировать вниз по электрическому потенциалу, в то время, как анионы диффундируют в противоположном направлении.
Эти два градиента, взятые вместе, могут быть выражены в виде электрохимического градиента, по уравнению:
.
Уравнения процесса[править | править код]
Протон-движущая сила происходит от свободной энергии Гиббса по уравнению[2]:
ΔG является изменением свободной энергии Гиббса (кДж/Кмоль), при передаче 1 моль катионов Xm+ от фазы А к фазе B вниз по электрическому потенциалу, Δψ есть разность электрических потенциалов (электрический градиент или ЭДС) (мВ) между фазами + и - (A и B), [Xm+]A и [Xm+]B — концентрации катионов на противоположных сторонах мембраны (химический градиент), F — постоянная Фарадея, R — универсальная газовая постоянная. Изменение свободной энергии Гиббса здесь выражается также часто, как электрохимический градиент ионов ΔμXm+:
В случае электрохимического протонного градиента уравнение можно упростить:
,
где
соответственно pH (+) фазы и pH (-) фазы.
В митохондриях[править | править код]
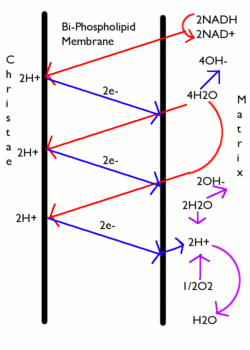
На рисунке слева — кристы, справа — матрикс митохондрий.
Известно, что через мембрану митохондрии могут свободно проникать только небольшие незаряженные молекулы, а также гидрофобные молекулы. Энергия, которая выделяется при переносе электронов по цепи МтО, приводит к переносу протонов (Н+) из матрикса митохондрии в межмембранное пространство. Поэтому на внутренней мембране митохондрий образуется градиент концентраций протонов: в межмембранном пространстве Н+ становится много, а в матриксе остается мало. Образуется разность потенциалов 0,14В —наружная часть мембраны заряжена положительно, а внутренняя — отрицательно. Накопившиеся в межмембранном пространстве Н+ стремятся выйти обратно в матрикс по градиенту их концентраций, но митохондриальная мембрана для них непроницаема. Единственный обратный путь в матрикс для протонов — через протонный канал фермента АТФ-синтетазы, которая интегрирован во внутреннюю мембрану митохондрий. При движении протонов по этому каналу в матрикс их энергия используется АТФ-синтазой для синтеза АТФ. Синтезируется АТФ в матриксе митохондрий.
Этот раздел статьи ещё не написан. |
В растениях[править | править код]
Этот раздел статьи ещё не написан. |
В прокариотах[править | править код]
Этот раздел статьи ещё не написан. |
Примечания[править | править код]
- ↑ Peter Mitchell. Coupling of phosphorylation to electron and hydrogen transfer by a chemi-osmotic type of mechanism (англ.) // Nature : journal. — 1961. — Vol. 191, no. 4784. — P. 144—148. — doi:10.1038/191144a0. — . — PMID 13771349.
- ↑ Nicholls D. G.; Ferguson S. J. Bioenergetics 2 (неопр.). — 2nd. — San Diego: Academic Press, 1992. — ISBN 9780125181242.
См. также[править | править код]
Для улучшения этой статьи желательно:
|

![{\displaystyle \Delta G=-mF\Delta \psi +2,3RT\lg \left({[X^{m^{+}}]_{B} \over [X^{m^{+}}]_{A}}\right)}](https://wikimedia.org/api/rest_v1/media/math/render/svg/35337ec987c184041c69343d120c1c71e43a04af)


