Альфа-аминоадипиновая полуальдегидная синтаза, митохондриальная
| Альфа-аминоадипиновая полуальдегидная синтаза, митохондриальная | |||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Идентификаторы | |||||||||||||||||||||||||||||||||||||||||||||||||||
| Псевдонимы | AASS, LKR/SDH, LKRSDH, LORSDH, aminoadipate-semialdehyde synthase | ||||||||||||||||||||||||||||||||||||||||||||||||||
| Внешние ID | OMIM: 605113 MGI: 1353573 HomoloGene: 4212 GeneCards: AASS | ||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||
Альфа-аминоадипиновая полуальдегидная синтаза (англ. Alpha-aminoadipic semialdehyde synthase) — фермент, кодируемый геном AASS у людей. Участвует в расщеплении лизина. Он подобен ферментам, кодируемыми генами LYS1 и LYS9 у дрожжей, и связан, хотя и не похож по структуре с бифункциональным ферментом, найденным в растениях[5][6]. У людей мутации в гене AASS и соответствующий альфа-аминоадипиновый фермент полуальдегидсинтазы связаны с семейной гиперлизинемией[5][7][8]. Это состояние наследуется по аутосомно-рецессивному типу и не считается особенно негативным состоянием, что делает его редким заболеванием[9].
Функции
[править | править код]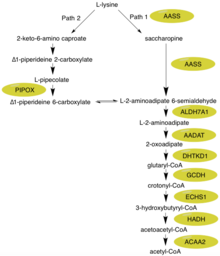
Альфа-аминоадипиновый белок полуанальдегидсинтазы катализирует первые две стадии расщепления L-лизина млекопитающих через сахаропиновый путь в митохондриях, который считается основным метаболическим путем для расщепления лизина у верхних эукариот[11][12]. Другой путь, на котором фокусируется этот фермент, является синтез глутарил-СоА из L-лизина[9]. Глутарил-СоА может быть промежуточным звеном в более расширенном пути превращения/расщепления L-лизина в Ацетил CoA.
Два заметных компонента расщепления L-лизина через сахаропиновый путь представляют собой промежуточную реакцию/продукт глутамата и возможно, Ацетил CoA с углеродом. Глутамат является важным веществом в теле организма из группы нейромедиаторов, связан с болезнью Хантингтона[13][14]. Ацетил CoA, возможно, имеет еще более высокий уровень важности, действуя как один из интегральных компонентов лимонной кислоты/цикла Кребса, с основной функцией доставки ацетильной группы, подлежащей окислению для производства энергии[15]. Таким образом, функция альфа-аминоадипиновой полуальдегидной синтазы связана с уровнями двух интегральных соединений внутри организма.
Механизм
[править | править код]
Во-первых, N-концевая часть этого фермента, которая содержит активность лизин-кетоглутаратредуктазы (LOR/LKR) (Шифр КФ: 1.5.1.8), конденсирует лизин и 2-оксоглутарат с молекулой, называемой сахаропином (реакция 1 на рисунке справа)[7][11]. Затем С-концевая часть этого фермента, которая содержит активность сахаропиндегидрогеназы (SHD) (Шифр КФ: 1.5.1.9), катализирует окисление сахаропина с образованием альфа-аминоадипидного полуальдегида и глутамата (реакция 2 на рисунке справа) [7][11]. Примечание: Эти реакции являются обратными к соответствующим стадиям путей биосинтеза лизина, присутствующих в дрожжах и грибах[16][17][18].
Эти реакции можно визуализировать также в форме уравненных реакций:
N(6)-(L-1,3-dicarboxypropyl)-L-lysine + NADP+ + H2O = L-lysine + 2-oxoglutarate + NADPH с последующим
N(6)-(L-1,3-dicarboxypropyl)-L-lysine + NAD+ + H2O = L-glutamate + (S)-2-amino-6-oxohexanoate + NADH[9].
Структура
[править | править код]Нативный, человеческий фермент является бифункциональным, подобно лизин-кетоглутаратредуктазе или сахаропиндегидрогеназе (LKR/SHD), найденных в растениях, поэтому и считается, что он похож по структуре[16]. Бифункциональность этого фермента исходит от того, что он исполняет две активные функции, одну на своем C-конце, другой на N-конце[7]. С-концевая часть альфа-аминоадипиновой полуальдегидной синтазы содержит активность SHD, а N-концевая часть содержит LKR[19]. На сегодняшний день структура альфа-аминоадипиновой полуальдегидной синтазы не определена[20]. Фермент не имеет линкерной области, присутствующей в растениях, и область активности LKR связана с областью SHD-активности, как в Magnaporthe grisea[19].

Актуальность заболевания
[править | править код]Альфа-аминоадипиновая полуанальдегидная синтаза кодируется геном AASS, а мутации этого гена приводят к гиперлизинемии[5][7]. Это характеризуется нарушением расщепления лизина, что приводит к повышенным уровням лизина в крови и моче. Повышение уровня лизина не оказывает отрицательного влияния на организм[8].
Гиперлизинемия характеризуется повышенными уровнями лизина в плазме, который превышает 600 мкмоль/л и может достичь до 2000 мкмоль/л[21][22]. Это повышение лизина не оказывает отрицательного влияния на организм[8]. Главная причина, лизин может заменить некоторые биохимические реакции. Во-первых лизин можно использовать вместо орнитина в цикле мочевины, что приводит к получению гомоаргинина[23]. Кроме того, несмотря на то, что большинство млекопитающих используют сахаропиновый путь для расщепления лизина (путь 1), мозг имеет альтернативный путь (путь 2), который проходит через промежуточное соединение L-пипеколиновой кислоты — оба из них можно увидеть на рисунке[23]. Стоит отметить, что путь 1 происходит в митохондриях, в то время как путь 2 происходит в пероксисоме[12]. Рассматривая другие ключевые ферменты в пути расщеплении L-лизина, ALDH7A1 дефицитен у детей с пиридоксин-зависимыми судорогами[24]. GCDH дефицит глутаровой ацидурии типа 1[25]. Промежуточный 2-оксоудипат метаболизируется 2-оксоадипатдегидрогеназой, сходной с циррозой кислотой / Кребским ферментным комплексом 2-оксоглутаратдегидрогеназы[10].
На данный момент описаны два типа семейной гиперлизинемии: тип I связан с комбинированным дефицитом двух ферментных активностей, LOR и SDH, тогда как в семейной гиперглинемии II типа нарушается только активность сахаропиндегидрогеназы[26][27]. Гиперлизинемия II типа также упоминается как сахаропинурия[10].
Дополнительным симптомом, связанным с гиперлизинемией, является дефицит диеноил-КоА-редуктазы, хотя это относительно недавнее открытие, и публикаций, поддерживающих это, мало[28].
Примечания
[править | править код]- ↑ 1 2 3 GRCh38: Ensembl release 89: ENSG00000008311 - Ensembl, May 2017
- ↑ 1 2 3 GRCm38: Ensembl release 89: ENSMUSG00000029695 - Ensembl, May 2017
- ↑ Ссылка на публикацию человека на PubMed: Национальный центр биотехнологической информации, Национальная медицинская библиотека США.
- ↑ Ссылка на публикацию мыши на PubMed: Национальный центр биотехнологической информации, Национальная медицинская библиотека США.
- ↑ 1 2 3 Sacksteder K. A., Biery B. J., Morrell J. C., Goodman B. K., Geisbrecht B. V., Cox R. P., Gould S. J., Geraghty M. T. Identification of the alpha-aminoadipic semialdehyde synthase gene, which is defective in familial hyperlysinemia (англ.) // American Journal of Human Genetics[англ.] : journal. — 2000. — June (vol. 66, no. 6). — P. 1736—1743. — doi:10.1086/302919. — PMID 10775527. — PMC 1378037.
- ↑ Zhu X., Tang G., Galili G. The activity of the Arabidopsis bifunctional lysine-ketoglutarate reductase/saccharopine dehydrogenase enzyme of lysine catabolism is regulated by functional interaction between its two enzyme domains (англ.) // The Journal of Biological Chemistry : journal. — 2002. — December (vol. 277, no. 51). — P. 49655—49661. — doi:10.1074/jbc.M205466200. — PMID 12393892.
- ↑ 1 2 3 4 5 Entrez Gene: AASS aminoadipate-semialdehyde synthase. Дата обращения: 1 ноября 2017. Архивировано 6 марта 2010 года.
- ↑ 1 2 3 hyperlysinemia. Genetics Home Reference. Дата обращения: 4 марта 2017. Архивировано 5 марта 2017 года.
- ↑ 1 2 3 Alpha-aminoadipic semialdehyde synthase, mitochondrial. UniProt. Дата обращения: 4 марта 2017. Архивировано 7 ноября 2017 года.
- ↑ 1 2 3 Houten S. M., Te Brinke H., Denis S., Ruiter J. P., Knegt A. C., de Klerk J. B., Augoustides-Savvopoulou P., Häberle J., Baumgartner M. R., Coşkun T., Zschocke J., Sass J. O., Poll-The B. T., Wanders R. J., Duran M. Genetic basis of hyperlysinemia (англ.) // Orphanet Journal of Rare Diseases[англ.] : journal. — 2013. — April (vol. 8). — P. 57. — doi:10.1186/1750-1172-8-57. — PMID 23570448.
- ↑ 1 2 3 Papes F., Kemper E. L., Cord-Neto G., Langone F., Arruda P. Lysine degradation through the saccharopine pathway in mammals: involvement of both bifunctional and monofunctional lysine-degrading enzymes in mouse (англ.) // The Biochemical Journal[англ.] : journal. — 1999. — December (vol. 344 Pt 2, no. Pt 2). — P. 555—563. — doi:10.1042/0264-6021:3440555. — PMID 10567240. — PMC 1220675.
- ↑ 1 2 Danhauser K., Sauer S. W., Haack T. B., Wieland T., Staufner C., Graf E., Zschocke J., Strom T. M., Traub T., Okun J. G., Meitinger T., Hoffmann G. F., Prokisch H., Kölker S. DHTKD1 mutations cause 2-aminoadipic and 2-oxoadipic aciduria (англ.) // American Journal of Human Genetics[англ.] : journal. — 2012. — December (vol. 91, no. 6). — P. 1082—1087. — doi:10.1016/j.ajhg.2012.10.006. — PMID 23141293. — PMC 3516599.
- ↑ Meldrum B. S. Glutamate as a neurotransmitter in the brain: review of physiology and pathology (англ.) // The Journal of Nutrition[англ.] : journal. — 2000. — April (vol. 130, no. 4S Suppl). — P. 1007S—15S. — PMID 10736372. Архивировано 16 мая 2017 года.
- ↑ About Glutamate Toxicity. Huniting Disease Outreach for Education at Stanford (HOPES). Huntington’s Disease Society of America. Дата обращения: 5 марта 2017. Архивировано 12 марта 2017 года.
- ↑ Acetyl CoA Crossroads Compound. Virtual ChemBook. Elmhurst College (2003). Дата обращения: 1 ноября 2017. Архивировано 15 ноября 2016 года.
- ↑ 1 2 Markovitz P. J., Chuang D. T., Cox R. P. Familial hyperlysinemias. Purification and characterization of the bifunctional aminoadipic semialdehyde synthase with lysine-ketoglutarate reductase and saccharopine dehydrogenase activities (англ.) // The Journal of Biological Chemistry : journal. — 1984. — October (vol. 259, no. 19). — P. 11643—11646. — PMID 6434529.
- ↑ Jones E. E., Broquist H. P. Saccharopine, an intermediate of the aminoadipic acid pathway of lysine biosynthesis. Ii. studies in saccharomyces cereviseae (англ.) // The Journal of Biological Chemistry : journal. — 1965. — June (vol. 240). — P. 2531—2536. — PMID 14304864.
- ↑ Trupin J. S., Broquist H. P. Saccharopine, an intermediate of the aminoadipic acid pathway of lysine biosynthesis. I. studies in neurospora crassa (англ.) // The Journal of Biological Chemistry : journal. — 1965. — June (vol. 240). — P. 2524—2530. — PMID 14304863.
- ↑ 1 2 Johansson E., Steffens J. J., Lindqvist Y., Schneider G. Crystal structure of saccharopine reductase from Magnaporthe grisea, an enzyme of the alpha-aminoadipate pathway of lysine biosynthesis (англ.) // Structure : journal. — 2000. — October (vol. 8, no. 10). — P. 1037—1047. — doi:10.1016/s0969-2126(00)00512-8. — PMID 11080625.
- ↑ AASS - aminoadipate-semialdehyde synthase. RCSB Protein Data Bank. Дата обращения: 1 ноября 2017. Архивировано из оригинала 7 ноября 2017 года.
- ↑ Hoffmann G. F., Kolker S. Cerebral organic acid disorders and other disorders of lysine catabolism // Inborn metabolic diseases diagnosis and treatment (англ.) / Saudubray J. M., van den Berghe G., Walter J. H.. — 5th. — Berlin: Springer, 2012. — P. 333—346. — ISBN 978-3-642-15720-2.
- ↑ Saudubray J. M., Rabier D. Biomarkers identified in inborn errors for lysine, arginine, and ornithine (англ.) // The Journal of Nutrition[англ.] : journal. — 2007. — June (vol. 137, no. 6 Suppl 2). — P. 1669S—1672S. — PMID 17513445.
- ↑ 1 2 vd Heiden C., Brink M., de Bree P. K., v Sprang F. J., Wadman S. K., de Pater J. M., van Biervliet J. P. Familial hyperlysinaemia due to L-lysine alpha-ketoglutarate reductase deficiency: results of attempted treatment (англ.) // Journal of Inherited Metabolic Disease[англ.] : journal. — 1978. — Vol. 1, no. 3. — P. 89—94. — PMID 116084.
- ↑ Mills P. B., Struys E., Jakobs C., Plecko B., Baxter P., Baumgartner M., Willemsen M. A., Omran H., Tacke U., Uhlenberg B., Weschke B., Clayton P. T. Mutations in antiquitin in individuals with pyridoxine-dependent seizures (англ.) // Nature Medicine : journal. — 2006. — March (vol. 12, no. 3). — P. 307—309. — doi:10.1038/nm1366. — PMID 16491085.
- ↑ Goodman S. I., Kratz L. E., DiGiulio K. A., Biery B. J., Goodman K. E., Isaya G., Frerman F. E. Cloning of glutaryl-CoA dehydrogenase cDNA, and expression of wild type and mutant enzymes in Escherichia coli (англ.) // Human Molecular Genetics[англ.] : journal. — Oxford University Press, 1995. — September (vol. 4, no. 9). — P. 1493—1498. — PMID 8541831.
- ↑ Dancis J., Hutzler J., Cox R. P. Familial hyperlysinemia: enzyme studies, diagnostic methods, comments on terminology (англ.) // American Journal of Human Genetics[англ.] : journal. — 1979. — May (vol. 31, no. 3). — P. 290—299. — PMID 463877.
- ↑ Cederbaum S. D., Shaw K. N., Dancis J., Hutzler J., Blaskovics J. C. Hyperlysinemia with saccharopinuria due to combined lysine-ketoglutarate reductase and saccharopine dehydrogenase deficiencies presenting as cystinuria (англ.) // The Journal of Pediatrics[англ.] : journal. — 1979. — August (vol. 95, no. 2). — P. 234—238. — PMID 571908.
- ↑ Houten S. M., Denis S., Te Brinke H., Jongejan A., van Kampen A. H., Bradley E. J., Baas F., Hennekam R. C., Millington D. S., Young S. P., Frazier D. M., Gucsavas-Calikoglu M., Wanders R. J. Mitochondrial NADP(H) deficiency due to a mutation in NADK2 causes dienoyl-CoA reductase deficiency with hyperlysinemia (англ.) // Human Molecular Genetics[англ.] : journal. — Oxford University Press, 2014. — September (vol. 23, no. 18). — P. 5009—5016. — doi:10.1093/hmg/ddu218. — PMID 24847004.





