Ацетоуксусный эфир: различия между версиями
| [отпатрулированная версия] | [отпатрулированная версия] |
Kurgus (обсуждение | вклад) Нет описания правки |
Kurgus (обсуждение | вклад) |
||
| Строка 76: | Строка 76: | ||
'''Ацетоуксусный эфир'''(этиловый эфир ацетоуксусной кислоты, этилацетоацетат) - бесцветная подвижная жидкость со своеобразным нерезким запахом. Растворяется в воде (14,3 % при 16,5 °C), смешивается с [[этанол]]ом и [[Диэтиловый эфир|диэтиловым эфиром]]. |
'''Ацетоуксусный эфир'''(этиловый эфир ацетоуксусной кислоты, этилацетоацетат) - бесцветная подвижная жидкость со своеобразным нерезким запахом. Растворяется в воде (14,3 % при 16,5 °C), смешивается с [[этанол]]ом и [[Диэтиловый эфир|диэтиловым эфиром]]. |
||
== |
== Свойства == |
||
Для ацетоуксусного эфира, как и для других 1,3-дикарбонильных соединений характерна кето-енольная [[таутомерия]]: |
|||
: [[Файл:Betaketocarbonicacid equilibrium.png|400 px]] , |
|||
енольный таутомер стабилизирован за счет образования водородной связи между протоном и соседним карбонильным кислородом. Положение равновесия и, соответственно, соотношение таутомеров зависит от растворителя и температуры. Так, в чистом ацетоуксусном эфире при комнатной температуре концентрация енольной формы составляет 7.5%. |
|||
При депротонировании ацетоуксусного эфира образуется [[Химический резонанс|резонансно стабилизированный]] анион: |
|||
: [[Файл:Resonance of acetoacetate anion.png|500 px]] |
|||
== Синтез == |
|||
Классическим методом синтеза ацетоуксусного эфира является сложноэфирная конденсации [[этилацетат|этилацетата]] в присутствии этанола под действием металлического натриря, катализатором конденсации является образующийся ''in situ'' [[Алкоголяты|этилат]] натрия. Образующийся натрийацетоуксусный эфир действием разбавленной минеральной кислоты переводят в ацетоуксусный эфир<ref> С.В.Пономарев, А.С.Золотарева, Л.Г.Сагинова, В.И.Теренин "Практикум по органической химии"</ref>: |
Классическим методом синтеза ацетоуксусного эфира является сложноэфирная конденсации [[этилацетат|этилацетата]] в присутствии этанола под действием металлического натриря, катализатором конденсации является образующийся ''in situ'' [[Алкоголяты|этилат]] натрия. Образующийся натрийацетоуксусный эфир действием разбавленной минеральной кислоты переводят в ацетоуксусный эфир<ref> С.В.Пономарев, А.С.Золотарева, Л.Г.Сагинова, В.И.Теренин "Практикум по органической химии"</ref>: |
||
: [[Файл:Claisen ethyl acetate.png|460 px]] |
: [[Файл:Claisen ethyl acetate.png|460 px]] |
||
Версия от 12:15, 26 декабря 2011
| Ацетоуксусный эфир | |
|---|---|
 | |
| Общие | |
| Систематическое наименование |
Этил-3-оксобутират |
| Традиционные названия | Этилацетоуксусный эфир, этиловый эфир ацетоуксусной кислоты |
| Хим. формула | C6H10O3 |
| Физические свойства | |
| Состояние | жидкость |
| Молярная масса | 130.14 г/моль |
| Плотность | 1.0284 г/см³ |
| Термические свойства | |
| Температура | |
| • плавления | -45 °C |
| • кипения | 180.8 °C |
| Химические свойства | |
| Константа диссоциации кислоты | 10.68 (в воде), 14.2 (в ДМСО) |
| Оптические свойства | |
| Показатель преломления | 1.4198 |
| Классификация | |
| Рег. номер CAS | 141-97-9 |
| PubChem | 8868 |
| Рег. номер EINECS | 205-516-1 |
| SMILES | |
| InChI | |
| RTECS | AK5250000 |
| ChEBI | 4893 |
| ChemSpider | 13865426 |
| Безопасность | |
| NFPA 704 | |
| Приведены данные для стандартных условий (25 °C, 100 кПа), если не указано иное. | |
Ацетоуксусный эфир(этиловый эфир ацетоуксусной кислоты, этилацетоацетат) - бесцветная подвижная жидкость со своеобразным нерезким запахом. Растворяется в воде (14,3 % при 16,5 °C), смешивается с этанолом и диэтиловым эфиром.
Свойства
Для ацетоуксусного эфира, как и для других 1,3-дикарбонильных соединений характерна кето-енольная таутомерия:
енольный таутомер стабилизирован за счет образования водородной связи между протоном и соседним карбонильным кислородом. Положение равновесия и, соответственно, соотношение таутомеров зависит от растворителя и температуры. Так, в чистом ацетоуксусном эфире при комнатной температуре концентрация енольной формы составляет 7.5%. При депротонировании ацетоуксусного эфира образуется резонансно стабилизированный анион:
Синтез
Классическим методом синтеза ацетоуксусного эфира является сложноэфирная конденсации этилацетата в присутствии этанола под действием металлического натриря, катализатором конденсации является образующийся in situ этилат натрия. Образующийся натрийацетоуксусный эфир действием разбавленной минеральной кислоты переводят в ацетоуксусный эфир[1]:
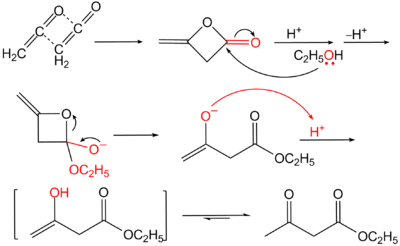
Ацетоуксусный эфир также может быть синтезирован ацилированием этанола дикетеном, этот метод является промышленным методом синтеза:
Применение
Ацетоуксусный эфир широко применяется в органическом синтезе. Будучи 1,3-дифункциональным реагентом, он применяется для синтеза гетероциклических соединений. В промышленности применяется в производстве фармацевтических препаратов (пирамидона, акрихина, витамина B1), а также красителей для цветной фотографии, ряда органических веществ.
Биологическое действие
Обладает кожнораздражающим действием. Всасывается через кожу. ПДК 1 мг/м³
Примечания
- ↑ С.В.Пономарев, А.С.Золотарева, Л.Г.Сагинова, В.И.Теренин "Практикум по органической химии"
Ссылки
- Ацетоуксусный эфир // Энциклопедический словарь Брокгауза и Ефрона : в 86 т. (82 т. и 4 доп.). — СПб., 1890—1907.
Это заготовка статьи об органическом веществе. Помогите Википедии, дополнив её. |
Для улучшения этой статьи желательно:
|