Ацетоуксусный эфир: различия между версиями
| [отпатрулированная версия] | [непроверенная версия] |
762bot (обсуждение | вклад) м автоматическое удаление некоторых параметорв карточки {{Вещество}} |
Djem92 (обсуждение | вклад) Нет описания правки |
||
| Строка 2: | Строка 2: | ||
| заголовок = <!-- заголовок карточки (по умолч. совпадает с назв. страницы) --> |
| заголовок = <!-- заголовок карточки (по умолч. совпадает с назв. страницы) --> |
||
| картинка = Ethyl acetoacetate-Structural Formula V.1.svg |
| картинка = Ethyl acetoacetate-Structural Formula V.1.svg |
||
| картинка3D = |
| картинка3D = Ethylacetoacetaat-3D.png |
||
| ⚫ | |||
| картинка малая = <!-- имя файла --> |
|||
| ⚫ | |||
| ⚫ | |||
| ⚫ | |||
| рац. формула = C<sub>6</sub>H<sub>10</sub>O<sub>3</sub> |
|||
| ⚫ | |||
| молярная масса = 130,1418 ± 0,0064 |
|||
| сокращения = <!-- принятые сокращения названия --> |
|||
| |
| плотность = 1,0284 |
||
| ⚫ | |||
| ⚫ | |||
| |
| темп. плавления = -45 |
||
| ⚫ | |||
| |
| темп. вспышки = 84 |
||
| ⚫ | |||
| предел прочности = <!-- число, в Н/мм² --> |
|||
| пределы взрываемости = 9,5 |
|||
| твёрдость = <!-- число (безразм.) --> |
|||
| давление пара = 100 Па при 20 °С |
|||
| примеси = <!-- типичное кол-во, указать единицы --> |
|||
| ⚫ | |||
| ⚫ | |||
| ⚫ | |||
| динамическая вязкость = <!-- число, в Па·с (при 20 °C) --> |
|||
| ⚫ | |||
| кинематическая вязкость = <!-- число, в см²/с (при 20 °C) --> |
|||
| темп. плавления = -45 |
|||
| ⚫ | |||
| темп. разложения = <!-- число, в °C --> |
|||
| темп. вспышки = <!-- число, в °C --> |
|||
| темп. воспламенения = <!-- число, в °C --> |
|||
| ⚫ | |||
| тройная точка = <!-- ? K (? °C), ? Па --> |
|||
| критическая точка = <!-- ? K (? °C), ? Па --> |
|||
| теплоёмкость = <!-- число, в Дж/(моль·К) (молярная теп.-ём.) --> |
|||
| теплоёмкость2 = <!-- число, в Дж/(кг·К) (удельная теп.-ём.) --> |
|||
| теплопроводность = <!-- число, в Вт/(м·K) --> |
|||
| энтальпия образования = <!-- число, в кДж/моль --> |
|||
| удельная теплота парообразования = <!-- число, в Дж/кг --> |
|||
| удельная теплота плавления = <!-- число, в Дж/кг --> |
|||
| тепловое расширение = <!-- число (безразм.) --> |
|||
| интервал трансформации = <!-- число, в ° --> |
|||
| температура размягчения = <!-- число, в ° --> |
|||
| давление пара = <!-- число (с указанием ед. изм!); можно добавить любой текст --> |
|||
| ⚫ | |||
| ⚫ | |||
| растворимость1 = |
|||
| вещество1 = |
|||
| растворимость2 = <!-- число, в г/100 мл --> |
|||
| вещество2 = <!-- веществе 2 --> |
|||
| растворимость3 = <!-- число, в г/100 мл --> |
|||
| вещество3 = <!-- веществе 3 --> |
|||
| растворимость4 = <!-- число, в г/100 мл --> |
|||
| вещество4 = <!-- веществе 4 --> |
|||
| вращение = <!-- число, в ° --> |
|||
| изоэлектрическая точка = <!-- число (безразм.) --> |
|||
| диапазон прозрачности = <!-- число-число, в нм --> |
|||
| ⚫ | |||
| угол Брюстера = <!-- число, в ° --> |
|||
| гибридизация = <!-- ? --> |
|||
| координационная геометрия = <!-- ? --> |
|||
| кристаллическая структура = <!-- описание решётки --> |
|||
| дипольный момент = <!-- число, в дебаях --> |
|||
| CAS = 141-97-9 |
| CAS = 141-97-9 |
||
| PubChem = |
| PubChem = 8868 |
||
| EINECS = <!-- № по EINECS --> |
| EINECS = <!-- № по EINECS --> |
||
| SMILES = |
| SMILES = CCOC(=O)CC(=O)C |
||
| ЕС = <!-- Регистрационный № EC --> |
| ЕС = <!-- Регистрационный № EC --> |
||
| RTECS = AK5250000 |
| RTECS = AK5250000 |
||
| ЛД50 = <!-- число, в мг/кг --> |
| ЛД50 = <!-- число, в мг/кг --> |
||
| токсичность = <!-- краткое описание --> |
| токсичность = <!-- краткое описание --> |
||
<br /> [[File:Hazard Xi|60 px]] |
|||
}} |
}} |
||
'''Ацетоуксусный эфир''' (этиловый эфир [[Ацетоуксусная кислота|ацетоуксусной кислоты]], этилацетоацетат) - бесцветная подвижная жидкость со своеобразным нерезким запахом. Растворяется в воде (14,3 % при 16,5 °C), смешивается с [[этанол]]ом и [[Диэтиловый эфир|диэтиловым эфиром]]. |
'''Ацетоуксусный эфир''' (этиловый эфир [[Ацетоуксусная кислота|ацетоуксусной кислоты]], этилацетоацетат) - бесцветная подвижная жидкость со своеобразным нерезким запахом. Растворяется в воде (14,3 % при 16,5 °C), смешивается с [[этанол]]ом и [[Диэтиловый эфир|диэтиловым эфиром]]. |
||
Версия от 07:16, 21 августа 2013
| Ацетоуксусный эфир | |||
|---|---|---|---|
| |||
| Общие | |||
| Систематическое наименование |
Этил-3-оксобутаноат | ||
| Традиционные названия |
Этилацетоуксусный эфир, этиловый эфир ацетоуксусной кислоты, этилацетоацетат |
||
| Хим. формула | CH3COCH2COOС2Н5 | ||
| Рац. формула | C6H10O3 | ||
| Физические свойства | |||
| Состояние | бесцветная жидкость с фруктовым запахом | ||
| Молярная масса | 130,1418 ± 0,0064 г/моль | ||
| Плотность | 1,0284 г/см³ | ||
| Термические свойства | |||
| Температура | |||
| • плавления | -45 °C | ||
| • кипения | 180,8 °C | ||
| • вспышки | 84 °C | ||
| • самовоспламенения | 304 °C | ||
| Пределы взрываемости | 9,5 % | ||
| Давление пара | 100 Па при 20 °С | ||
| Химические свойства | |||
| Константа диссоциации кислоты |
10,68 (в воде), 14,2 (в ДМСО) |
||
| Растворимость | |||
| • в воде | 2,86 г/100 мл | ||
| Оптические свойства | |||
| Показатель преломления | 1,4198 | ||
| Классификация | |||
| Рег. номер CAS | 141-97-9 | ||
| PubChem | 8868 | ||
| Рег. номер EINECS | 205-516-1 | ||
| SMILES | |||
| InChI | |||
| RTECS | AK5250000 | ||
| ChEBI | 4893 | ||
| ChemSpider | 13865426 | ||
| Безопасность | |||
| Токсичность |
Файл:Hazard Xi |
||
| NFPA 704 | |||
| Приведены данные для стандартных условий (25 °C, 100 кПа), если не указано иное. | |||
Ацетоуксусный эфир (этиловый эфир ацетоуксусной кислоты, этилацетоацетат) - бесцветная подвижная жидкость со своеобразным нерезким запахом. Растворяется в воде (14,3 % при 16,5 °C), смешивается с этанолом и диэтиловым эфиром.
Свойства
Для ацетоуксусного эфира, как и для других 1,3-дикарбонильных соединений характерна кето-енольная таутомерия:
Енольный таутомер стабилизирован за счет образования внутримолекулярной водородной связи между протоном и соседним карбонильным кислородом. Положение равновесия и, соответственно, соотношение таутомеров зависит от растворителя и температуры. Так, в чистом ацетоуксусном эфире при комнатной температуре концентрация енольной формы составляет 7,5 %. Равновесие сдвигается в сторону енольной формы при уменьшении полярности растворителя, так, при 18 °C доля енольной формы в водном растворе составляет 0,4 %, в диэтиловом эфире — 27,1 %, в циклогексане — 46,4 %.
Кетонная форма ацетоуксусного эфира может быть выделена из равновесной смеси вымораживанием, енольная - вакуумной перегонкой в кварцевой посуде. Скорость установления кето-енольного равновесия зависит от температуры и материала сосуда, чистые таутомеры хранятся в кварцевой посуде при низких температурах (-80°C - охлаждение сухим льдом).
Содержание енольной формы определяется бромометрически: бром практически мгновенно присоединяется по двойной связи енола, что сопровождается исчезновением желто-оранжевой окраски молекулярного брома.
Реакциями енольной формы также обусловлено O-ацилирование ацетоуксусного эфира хлорангидридами карбоновых кислот в пиридине, при этом образуются сложные эфиры β-гидроксикротоновой кислоты:
- CH3(HO)C=CHCOOC2H5 + ROCl CH3(ROO)C=CHCOOC2H5 + HCl
При взаимодействии с пентахлоридом фосфора гидроксил енольной формы ацетоуксусного эфира замещается на хлор с образованием этилового эфира β-хлоркротоновой кислоты:
- CH3(HO)C=CHCOOC2H5 + PCl5 CH3ClC=CHCOOC2H5 + POCl3 + HCl
С металлами ацетоуксусный эфир образует хелаты, в которых ацетилацетат-анион выступает в роли бидентантного лиганда, так, с солями трехвалентного железа ацетоуксусный эфир образует окрашеный в пурпурный цвет комплекс:
Под действием сильных оснований и щелочных металлов ацетоуксусный эфир депротонируется с образованием резонансно стабилизированного аниона:
Образование натриевой соли ацетилацетата (натрийацетоуксусного эфира) под действием алкоголята натрия - в том числе и под действием этилата натрия, образующегося in situ при действии металлического натрия на ацетоуксусный эфир - широко используется в синтетической практике вследствие высокой нуклеофильности аниона.
Ацетилацетат натрия в реакциях с мягкими электрофилами выступает в роли C-нуклеофила. Так, он легко алкилируется галогеналкилами с образованием соответствующих алкилацетоуксусных эфиров, из которых, в свою очередь, могут быть получены и затем проалкилированы натриевые производные:
- CH3COCH2COOC2H5 + EtONa CH3COCH-COOC2H5 Na+ + EtOH
- CH3COCH-COOC2H5 Na+ + RHal CH3COCHRCOOC2H5 + NaHal
В безводных условиях в присутствии бикарбоната натрия ацетоуксусный эфир самоконденсируется с образованием дегидроацетовой кислоты[1]:
2  |
→ 
|
| Ацетоуксусный эфир | Дегидроацетовая кислота |
Под действием серной кислоты на ацетоуксусный эфир происходит самоконденсация с двух молекул эфира с замыканием α-пиронового цикла, ведущая к образованию изодегидроацетовой кислоты[2].
Под действием водных кислот или разбавленных растворов щелочей ацетоуксусный эфир омыляется с образованием нестабильной ацетоуксуслой кислоты, которая в мягких условиях декарбоксилируется с образованием ацетона:
- CH3COCH2COOC2H5 + H2O CH3COCH2COOH + C2H5OH
- CH3COCH2COOH CH3COCH3 + CO2 + H2O
Аналогичным образом ведут себя и моно- и дизамещенные ацетоуксусные эфиры, полученные алкилированием натрийацетоуксусного эфира (кетонное расщепление), эта реакция используется для синтеза замещенных метилкетонов.
Иначе протекает взаимодействие ацетоуксусного эфира с концентрированными растворами щелочей: в этом случае протекает отщепление ацетильной группы с образованием двух молекул уксусной кислоты (кислотное расщепление), эта реакция идет и с замещенными ацетоуксусными эфирами и используется для синтеза гомологов уксусной кислоты через алкилпроизводные ацетоуксусного эфира:
- CH3COCHRCOOC2H5 + OH- + H2O CH3COO- + RCH2COOH + C2H5OH
Синтез
Классическим методом синтеза ацетоуксусного эфира является сложноэфирная конденсации этилацетата в присутствии этанола под действием металлического натрия, катализатором конденсации является образующийся in situ этилат натрия. Образующийся натрийацетоуксусный эфир действием разбавленной минеральной кислоты переводят в ацетоуксусный эфир[3]:
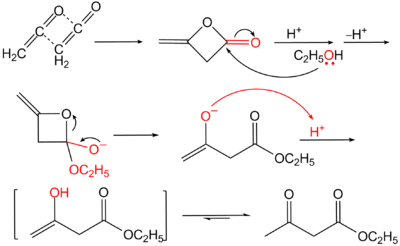
Ацетоуксусный эфир также может быть синтезирован ацилированием этанола дикетеном, этот метод является промышленным методом синтеза:
Применение
Ацетоуксусный эфир широко применяется в органическом синтезе.
Алкилирование натрийацетоуксусного эфира 2 с последующим кетонным либо кислотным расщеплением моно- и дизамещенных ацетоуксусныых эфиров 3 используется как препаративный метод синтеза метилкетонов 4 и замещенных уксусных кислот 5:
Будучи 1,3-дифункциональным реагентом, он применяется для синтеза гетероциклических соединений. В промышленности применяется в производстве фармацевтических препаратов (пирамидона, акрихина, витамина B1), а также красителей для цветной фотографии, ряда органических веществ.
Биологическое действие
Обладает кожнораздражающим действием. Всасывается через кожу. ПДК 1 мг/м³
Примечания
- ↑ F. Arndt. Dehydroacetic acid. Organic Syntheses, Coll. Vol. 3, p.231 (1955); Vol. 20, p.26 (1940).
- ↑ Newton R. Smith, Richard H. Wiley. Isodehydroacetic acid and ethyl isodehydroacetate. Organic Syntheses, Coll. Vol. 4, p.549 (1963); Vol. 32, p.76 (1952).
- ↑ С.В.Пономарев, А.С.Золотарева, Л.Г.Сагинова, В.И.Теренин "Практикум по органической химии"
Ссылки
- Ацетоуксусный эфир // Энциклопедический словарь Брокгауза и Ефрона : в 86 т. (82 т. и 4 доп.). — СПб., 1890—1907.
Это заготовка статьи об органическом веществе. Помогите Википедии, дополнив её. |
Для улучшения этой статьи желательно:
|