Гидроксоний: различия между версиями
| [непроверенная версия] | [отпатрулированная версия] |
Внесена ссылка на литературный источник. |
статья оставлена, шаблон КУ снят |
||
| Строка 1: | Строка 1: | ||
{{К удалению|2017-01-16|Хим-фарм с КУЛ}} |
|||
{{Нет ссылок|дата=2015-07-29}} |
{{Нет ссылок|дата=2015-07-29}} |
||
{{Вещество |
{{Вещество |
||
Версия от 17:43, 10 февраля 2017
В статье не хватает ссылок на источники (см. рекомендации по поиску). |
| Гидроксоний | |
|---|---|
 | |
| Общие | |
| Систематическое наименование |
оксоний, гидроний |
| Традиционные названия | гидроксоний |
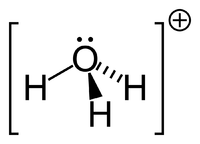
| Хим. формула | H3O+ |
| Физические свойства | |
| Молярная масса | 19,02 г/моль |
| Химические свойства | |
| Константа диссоциации кислоты | −1,7 |
| Классификация | |
| Рег. номер CAS | 13968-08-6 |
| PubChem | 123332 |
| SMILES | |
| InChI | |
| ChEBI | 29412 |
| ChemSpider | 109935 |
| Приведены данные для стандартных условий (25 °C, 100 кПа), если не указано иное. | |
Гидроксо́ний (оксоний, гидроний) НзО+ — комплексный ион, соединение протона с молекулой воды.
Водородные ионы в водных и спиртовых растворах кислот существуют в виде гидратированных или сольватированных ионов гидроксония. Для измерения концентрации водородных ионов используется водородный электрод. Ион гидроксония был обнаружен также в газовой фазе. Этот катион часто используется для представления природы протонов в водном растворе. Также существуют такие катионы, как H5O2+ ,H7O3+, H9O4+.
Стандартная энтропия иона гидроксония составляет 192,25 Дж/(моль·K).
Вода диссоциирует с образованием иона гидроксония [НзО]' и иона гидроксила OH'.[1]
Г. Реми, Курс неорганической химии, т. 1, стр. 74. - издательство иностранной литературы, Москва, 1963 г.
Это заготовка статьи по физической химии. Помогите Википедии, дополнив её. |
- ↑ Г. Реми. Курс неорганической химии.
