Фактор свёртывания крови XIII
| Фактор свёртывания XIII, A-цепь | |
|---|---|
 Неактивный гомодимер пептида A1 со всеми доменами и основными каталитическими остатками, показанными разными цветами. | |
| Обозначения | |
| Символы | F13A1; F13A |
| АТХ | B02BD07 |
| Entrez Gene | 2162 |
| HGNC | 3531 |
| OMIM | 134570 |
| RefSeq | NM_000129 |
| UniProt | P00488 |
| Другие данные | |
| Шифр КФ | 2.3.2.13 |
| Локус | 6-я хр. , 6p24 .2-p23 |
| Фактор свёртывания XIII, В-цепь | |
|---|---|
| Обозначения | |
| Символы | F13B |
| АТХ | B02BD07 |
| Entrez Gene | 2165 |
| HGNC | 3534 |
| OMIM | 134580 |
| RefSeq | NM_001994 |
| UniProt | P05160 |
| Другие данные | |
| Локус | 1-я хр. , 1q31 -q32.1 |
Фактор свёртывания крови XIII (сокр. фактор XIII), протрансглутаминаза, также фибрин-стабилизирующий фактор или фактор Лаки-Лоранда[1] — представляет собой белок зимоген, обнаруженный в крови человека и некоторых других животных. Он активируется тромбином, путём частичного протеолиза молекул зимогена до фактора XIIIa или трансглутаминазу (КФ 2.3.2.13). Фактор XIIIa представляет собой фермент системы свёртывания крови, сшивающий растворимые молекулы фибрина-мономера (агрегированного фибрина), превращая его в более прочную и нерастворимую форму — фибрин-полимер (стабилизация фибринового сгустка). Дефицит фактора XIII ухудшает стабильность сгустка и увеличивает склонность к кровотечениям[2]. Впервые обнаружен в 1948 году венгерскими биохимиками, изучавшими процесс коагуляции крови — Калманом Лаки и Лазло Лорандом[3].
Структура
[править | править код]Фактор XIII плазмы крови человека представляет собой гетеротетрамер, состоящий двух линейных полипептидов А и двух В или «цепей», с молекулярной массой около 320 кДа. Субъединицы А являются потенциально каталитическими; субъединицы В — нет. Цепи А образуют димерный центр. Нековалентно связанные цепи В образуют кольцеобразную структуру вокруг центра. Цепи B удаляются посредством частичного протеолиза, когда происходит процесс активации фактора XIII в XIIIa. Димеры, содержащие только субъединицы А, также встречаются внутри клеток, таких как тромбоциты. Большое количество единичных В-цепей (мономеров) также встречается в крови. Эти димеры и мономеры, как известно, не участвуют в коагуляции, тогда как тетрамеры участвуют[2].
Субъединицы А имеют массу около 83 кДа, включают в себя 731 аминокислотных остатков, 5 белковых доменов (перечислены от N-конца к С-концу, номера аминокислотных остатков указаны в скобках):[2]
- пептид активации (1–37)
- β-сэндвич (38–184)
- каталитический домен (185–515), в котором остатки C314, H373, D396 и W279 участвуют в катализе
- β-цилиндр 1 (516–628)
- β-цилиндр 2 (629–731).
В-субъединицы представляют собой гликопротеины. Каждый имеет массу около 80 кДа (8,5% массы приходится на углеводные остатки), включают в себя 641 аминокислотных остатков и 10 доменов-Sushi. Каждый домен содержит около 60 аминокислотных остатков и 2 внутренние дисульфидные связи[2].
Функции
[править | править код]В плазме крови во время коагуляции молекулы тромбина (IIa) расщепляют фибриноген до фибрина, и на основе фибрина образуется кровяной сгусток. Фактор XIII представляет собой протрансглутаминазу, которая циркулирует в крови человека в виде гетеротетрамера, состоящую из двух субъединиц А и двух субъединиц В. Фактор XIII связывается с тромбом через свои В-субъединицы. В присутствии молекул фибрина, тромбин эффективно расщепляет пептидную связь арг37-гли38 каждой А-цепи в тетрамере фактора XIII. Субъединицы А высвобождают свои N-концевые пептиды активации[2].
Обе нековалентно связанные субъединицы В тетрамера, с помощью ионов кальция (Ca2+) в крови после расщепления способны к диссоциации; эти ионы также активируют оставшийся димер двух А-цепей, посредством их конформационного изменения[2]. Таким образом происходит активация трансглутаминазы (XIIIa).
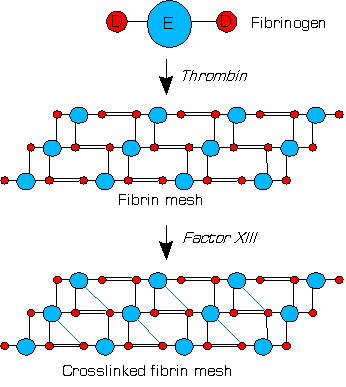
Фактор XIIIa (димер двух активных субъединиц А) сшивает молекулы агрегированного фибрина-мономера внутри сгустка, образуя амидные (псевдопептидные) связи между различными остатками глутамина и лизина a- и g-цепей агрегированного фибрина-мономера. Данные ковалентные связи делают сгусток физически более прочным, нерастворимым и защищают его от преждевременной ферментативной деградации (фибринолиза)[2]. Этот процесс называется стабилизацией фибринового сгустка.
У человека плазмин, антитромбин и ингибитор пути тканевого фактора (TFPI) являются наиболее значимыми протеолитическими ингибиторами активного фактора XIIIa. α2-макроглобулин является значительным непротеолитическим ингибитором[2].
-
Пептиды активации (розовые) цепей А удаляются тромбином (IIa) в присутствии фибрина (ограниченный протеолиз). Цепи В (серые) высвобождаются с помощью ионов кальция (Ca2+), а димер субъединицы А активируется (трансглутаминаза или активная форма XIIIa).
-
XIIIa катализирует образование поперечных сшивок между молекулами агрегированного фибрина-мономера, превращая последний в более стабильную форму (изображение упрощенно).
Гены
[править | править код]Фактор XIII человека состоит из субъединиц А и В и, соответственно кодируется двумя генами. Ген субъединицы А — F13A1. Локализован на 6-й хромосоме в локусе 6p24–25. Он охватывает более 160 т.п.н., имеет 14 интронов и 15 экзонов. Его мРНК составляет 3,9 т.п.н. Он включает 5'-UTR (5'-нетранслируемая область) размером 84 п.н. и 3'-UTR (3'-нетранслируемая область) размером 1,6 т.п.н. Экзон(ы) F13A1[2]
- 1 кодирует 5'-UTR
- 2 кодирует активационный пептид
- 2–4 кодируют β-сэндвич
- 4–12 кодируют каталитический домен
- 12–13 кодируют β-цилиндр 1
- 13–15 кодируют β-цилиндр 2.
Ген субъединицы В — F13B. Он находится на 1-й хромосоме в локусе 1q31–32.1. Он охватывает 28 т.п.н, имеет 11 интронов и 12 экзонов. Его мРНК составляет 2,2 т.п.н. Экзон 1 кодирует 5'-UTR. Экзоны 2–12 кодируют 10 различных доменов Sushi[2].
Физиология
[править | править код]А-субъединицы фактора XIII человека синтезируются в основном тромбоцитами и другими клетками костномозгового происхождения. В-субъединицы секретируются в кровь гепатоцитами. В плазме крови субъединицы А и В ассоциируются с образованием гетеротетрамеров, состоящего соответственно из двух субъединиц А и двух субъединиц В. Концентрация гетеротетрамеров в плазме крови составляет 14–48 мг/л, а период полувыведения составляет 9–14 дней[2].
Сгусток, не стабилизированный XIIIa, растворим в 5М растворе мочевины, в то время как стабилизированный сгусток не растворяется в ней[3].
Дефицит
[править | править код]Дефицит фактора XIII (FXIIID), является редко встречаемым заболеванием, однако в Иране зарегистрирован самый высокий уровень заболеваемости этим расстройством в мире — 473 случая. Город Хаш, расположенный в провинции Систан и Белуджистан, имеет самый высокий уровень по заболеваемости FXIIID в Иране, где наблюдают высокий уровень близкородственных браков[4].
Использование в диагностике
[править | править код]Уровни фактора XIII обычно не измеряются, но могут быть рассмотрены у пациентов с необъяснимой склонностью к кровотечениям. Поскольку фермент довольно специфичен для моноцитов и макрофагов, определение присутствия фактора XIII может быть использовано для идентификации и классификации злокачественных заболеваний, поражающих эти клетки[5].
Примечания
[править | править код]- ↑ Марри Р., Греннер Д., Мейес П., Родуэлл В. Биохимия человека / Л. Гинодман. — М.: БИНОМ, 2009. — С. 331-336. — 451 с. — ISBN 978-5-9963-0016-7.
- ↑ 1 2 3 4 5 6 7 8 9 10 11 Muszbek L, Bereczky Z, Bagoly Z, Komáromi I, Katona É (July 2011). "Factor XIII: a coagulation factor with multiple plasmatic and cellular functions". Physiological Reviews. 91 (3): 931—72. doi:10.1152/physrev.00016.2010. PMID 21742792. S2CID 24703788.
- ↑ 1 2 Laki K, Lóránd L (September 1948). "On the Solubility of Fibrin Clots". Science. 108 (2802): 280. Bibcode:1948Sci...108..280L. doi:10.1126/science.108.2802.280. PMID 17842715.
- ↑ Dorgalaleh A, Naderi M, Hosseini MS, Alizadeh S, Hosseini S, Tabibian S, et al. (2015). "Factor XIII Deficiency in Iran: A Comprehensive Review of the Literature. Seminars in thrombosis and hemostasis". 41 (3): 323—29.
{{cite journal}}: Cite journal требует|journal=(справка) - ↑ Muszbek L, Ariëns RA, Ichinose A (January 2007). "Factor XIII: recommended terms and abbreviations". Journal of Thrombosis and Haemostasis. 5 (1): 181—83. doi:10.1111/j.1538-7836.2006.02182.x. PMID 16938124. S2CID 20424049.