ARNTL: различия между версиями
| [отпатрулированная версия] | [отпатрулированная версия] |
Djem92 (обсуждение | вклад) |
Djem92 (обсуждение | вклад) |
||
| Строка 16: | Строка 16: | ||
После того, как белки PER и CRY накапливаются до достаточных концентраций, они взаимодействуют со своими мотивам PAS с образованием большого репрессорного комплекса, который перемещается в ядро, чтобы ингибировать транскрипционную активность гетеродимера CLOCK:BMAL1<ref>{{cite journal | vauthors = Bollinger T, Schibler U | title = Circadian rhythms - from genes to physiology and disease | journal = Swiss Medical Weekly | volume = 144 | pages = w13984 | date = 2014 | pmid = 25058693 | doi = 10.4414/smw.2014.13984 }}</ref>. Этот процесс приводит к ингибированию транскрипции Per и Cry гены, и вызывает снижение концентрации белка PER и CRY. Эта транскрипция, петля отрицательной обратной связи трансляции (TTFL) модулируется в цитоплазме путём фосфорилирования белков PER казеинкиназой 1ε или δ (CK1 ε или CK1 δ), сигнализируя эти белки для деградации протеасомами 26S<ref name="buhr" /><ref>{{cite journal | vauthors = Maywood ES, Chesham JE, Smyllie NJ, Hastings MH | title = The Tau mutation of casein kinase 1ε sets the period of the mammalian pacemaker via regulation of Period1 or Period2 clock proteins | journal = Journal of Biological Rhythms | volume = 29 | issue = 2 | pages = 110–8 | date = April 2014 | pmid = 24682205 | pmc = 4131702 | doi = 10.1177/0748730414520663 }}</ref>. SIRT1 также регулирует деградацию белка PER посредством ингибирования транскрипционной активности гетеродимера BMAL1:CLOCK путем циркадного (кругового) деацетилирования<ref>{{cite journal | vauthors = Asher G, Gatfield D, Stratmann M, Reinke H, Dibner C, Kreppel F, Mostoslavsky R, Alt FW, Schibler U | title = SIRT1 regulates circadian clock gene expression through PER2 deacetylation | journal = Cell | volume = 134 | issue = 2 | pages = 317–28 | date = July 2008 | pmid = 18662546 | doi = 10.1016/j.cell.2008.06.050 }}</ref>. Деградация PER-белков предотвращает образование комплекса больших белков и, таким образом, предотвращает ингибирование транскрипционной активности гетеродимера BMAL1:CLOCK<ref name="buhr" />. Белок CRY также сигнализируют о деградации поли-убиквированием белка FBXL3, также предотвращая ингибирование гетеродимера CLOCK:BMAL1. Это позволяет возобновить транскрипцию генов Per и Cry. В петле TTFL ночных мышей наблюдалось, что уровни транскрипции пика гена Bmal1 в CT18 во время средней субъективной ночи имеют антифазный уровень транскрипции Per, Cry и других генов контроля частоты, пик в CT6, в середине-субъективного дня. Этот процесс происходит с длиной периода около 24 часов и поддерживает представление о том, что этот молекулярный механизм ритмичен<ref>{{cite journal | vauthors = Ueda HR, Chen W, Adachi A, Wakamatsu H, Hayashi S, Takasugi T, Nagano M, Nakahama K, Suzuki Y, Sugano S, Iino M, Shigeyoshi Y, Hashimoto S | title = A transcription factor response element for gene expression during circadian night | journal = Nature | volume = 418 | issue = 6897 | pages = 534–9 | date = August 2002 | pmid = 12152080 | doi = 10.1038/nature00906 | bibcode = 2002Natur.418..534U }}</ref>. |
После того, как белки PER и CRY накапливаются до достаточных концентраций, они взаимодействуют со своими мотивам PAS с образованием большого репрессорного комплекса, который перемещается в ядро, чтобы ингибировать транскрипционную активность гетеродимера CLOCK:BMAL1<ref>{{cite journal | vauthors = Bollinger T, Schibler U | title = Circadian rhythms - from genes to physiology and disease | journal = Swiss Medical Weekly | volume = 144 | pages = w13984 | date = 2014 | pmid = 25058693 | doi = 10.4414/smw.2014.13984 }}</ref>. Этот процесс приводит к ингибированию транскрипции Per и Cry гены, и вызывает снижение концентрации белка PER и CRY. Эта транскрипция, петля отрицательной обратной связи трансляции (TTFL) модулируется в цитоплазме путём фосфорилирования белков PER казеинкиназой 1ε или δ (CK1 ε или CK1 δ), сигнализируя эти белки для деградации протеасомами 26S<ref name="buhr" /><ref>{{cite journal | vauthors = Maywood ES, Chesham JE, Smyllie NJ, Hastings MH | title = The Tau mutation of casein kinase 1ε sets the period of the mammalian pacemaker via regulation of Period1 or Period2 clock proteins | journal = Journal of Biological Rhythms | volume = 29 | issue = 2 | pages = 110–8 | date = April 2014 | pmid = 24682205 | pmc = 4131702 | doi = 10.1177/0748730414520663 }}</ref>. SIRT1 также регулирует деградацию белка PER посредством ингибирования транскрипционной активности гетеродимера BMAL1:CLOCK путем циркадного (кругового) деацетилирования<ref>{{cite journal | vauthors = Asher G, Gatfield D, Stratmann M, Reinke H, Dibner C, Kreppel F, Mostoslavsky R, Alt FW, Schibler U | title = SIRT1 regulates circadian clock gene expression through PER2 deacetylation | journal = Cell | volume = 134 | issue = 2 | pages = 317–28 | date = July 2008 | pmid = 18662546 | doi = 10.1016/j.cell.2008.06.050 }}</ref>. Деградация PER-белков предотвращает образование комплекса больших белков и, таким образом, предотвращает ингибирование транскрипционной активности гетеродимера BMAL1:CLOCK<ref name="buhr" />. Белок CRY также сигнализируют о деградации поли-убиквированием белка FBXL3, также предотвращая ингибирование гетеродимера CLOCK:BMAL1. Это позволяет возобновить транскрипцию генов Per и Cry. В петле TTFL ночных мышей наблюдалось, что уровни транскрипции пика гена Bmal1 в CT18 во время средней субъективной ночи имеют антифазный уровень транскрипции Per, Cry и других генов контроля частоты, пик в CT6, в середине-субъективного дня. Этот процесс происходит с длиной периода около 24 часов и поддерживает представление о том, что этот молекулярный механизм ритмичен<ref>{{cite journal | vauthors = Ueda HR, Chen W, Adachi A, Wakamatsu H, Hayashi S, Takasugi T, Nagano M, Nakahama K, Suzuki Y, Sugano S, Iino M, Shigeyoshi Y, Hashimoto S | title = A transcription factor response element for gene expression during circadian night | journal = Nature | volume = 418 | issue = 6897 | pages = 534–9 | date = August 2002 | pmid = 12152080 | doi = 10.1038/nature00906 | bibcode = 2002Natur.418..534U }}</ref>. |
||
=== Регулирование активности Bmal1 === |
|||
В дополнение к циркадной регуляторной TTFL-петле, описанной выше, транскрипция Bmal1 регулируется конкурентным связыванием с сайтом связывания с ретиноидной кислотой, связанным с сайтом-рецептором (RORE) в промоторной области Bmal1. Гетеродимер CLOCK:BMAL1 также связывается с элементами E-box в промоторных областях генов Rev-Erbα и RORα/ß, активируя транскрипцию и трансляцию белков REV-ERB и ROR. Белки REV-ERBα и ROR регулируют экспрессию BMAL1 через вторичный контур обратной связи и конкурируют за связывание с элементами ответа Rev-Erb/ROR в промоторной области Bmal1, в результате чего экспрессию BMAL1 подавляют REV-ERBα и активируют белки ROR. Было показано, что другие ядерные рецепторы тех же семейств (NR1D2 (Rev-erb-β), NR1F2 (ROR-β) и NR1F3 (ROR-γ)) также действуют на транскрипционную активность Bmal1<ref>{{cite journal | vauthors = Akashi M, Takumi T | title = The orphan nuclear receptor RORalpha regulates circadian transcription of the mammalian core-clock Bmal1 | journal = Nature Structural & Molecular Biology | volume = 12 | issue = 5 | pages = 441–8 | date = May 2005 | pmid = 15821743 | doi = 10.1038/nsmb925 }}</ref><ref>{{cite journal | vauthors = Guillaumond F, Dardente H, Giguère V, Cermakian N | title = Differential control of Bmal1 circadian transcription by REV-ERB and ROR nuclear receptors | journal = Journal of Biological Rhythms | volume = 20 | issue = 5 | pages = 391–403 | date = October 2005 | pmid = 16267379 | doi = 10.1177/0748730405277232 }}</ref><ref>{{cite journal | vauthors = Ueda HR, Hayashi S, Chen W, Sano M, Machida M, Shigeyoshi Y, Iino M, Hashimoto S | title = System-level identification of transcriptional circuits underlying mammalian circadian clocks | journal = Nature Genetics | volume = 37 | issue = 2 | pages = 187–92 | date = February 2005 | pmid = 15665827 | doi = 10.1038/ng1504 }}</ref><ref>{{cite journal | vauthors = Liu AC, Tran HG, Zhang EE, Priest AA, Welsh DK, Kay SA | title = Redundant function of REV-ERBα and β and non-essential role for Bmal1 cycling in transcriptional regulation of intracellular circadian rhythms | journal = PLoS Genetics | volume = 4 | issue = 2 | pages = e1000023 | date = February 2008 | pmid = 18454201 | pmc = 2265523 | doi = 10.1371/journal.pgen.1000023 | editor1-last = Takahashi | editor1-first = Joseph S. }}</ref>. |
|||
Несколько [[Посттрансляционная модификация|посттрансляционных модификаций]] BMAL1 определяют время циклов обратной связи CLOCK:BMAL1. [[Фосфорилирование]] BMAL1 нацеливает его на убиквитинирование и деградацию, а также на деубиквитинирование и стабилизацию. [[Ацетилирование]] BMAL1 рекрутирует CRY1 для подавления трансактивации CLOCK:BMAL1<ref>{{cite journal | vauthors = Hirayama J, Sahar S, Grimaldi B, Tamaru T, Takamatsu K, Nakahata Y, Sassone-Corsi P | title = CLOCK-mediated acetylation of BMAL1 controls circadian function | journal = Nature | volume = 450 | issue = 7172 | pages = 1086–90 | date = December 2007 | pmid = 18075593 | doi = 10.1038/nature06394 | bibcode = 2007Natur.450.1086H }}</ref>. Сумоилирование BMAL1 с помощью небольшого модификатора, связанного с убиквитином 3 (SUMO3), сигнализирует о его убиквитинировании в ядре, что приводит к трансактивации гетеродимера CLOCK:BMAL1<ref name="dualmod">{{cite journal | vauthors = Lee J, Lee Y, Lee MJ, Park E, Kang SH, Chung CH, Lee KH, Kim K | title = Dual modification of BMAL1 by SUMO2/3 and ubiquitin promotes circadian activation of the CLOCK/BMAL1 complex | journal = Molecular and Cellular Biology | volume = 28 | issue = 19 | pages = 6056–65 | date = October 2008 | pmid = 18644859 | pmc = 2546997 | doi = 10.1128/MCB.00583-08 }}</ref>. Трансактивация комплекса CLOCK:BMAL1<ref>{{cite journal | vauthors = Eide EJ, Vielhaber EL, Hinz WA, Virshup DM | title = The circadian regulatory proteins BMAL1 and cryptochromes are substrates of casein kinase Iepsilon | journal = The Journal of Biological Chemistry | volume = 277 | issue = 19 | pages = 17248–54 | date = May 2002 | pmid = 11875063 | pmc = 1513548 | doi = 10.1074/jbc.m111466200 }}</ref> активируется фосфорилированием казеинкиназы 1ε и ингибируется фосфорилированием MAPK<ref>{{cite journal | vauthors = Sanada K, Okano T, Fukada Y | title = Mitogen-activated protein kinase phosphorylates and negatively regulates basic helix-loop-helix-PAS transcription factor BMAL1 | journal = The Journal of Biological Chemistry | volume = 277 | issue = 1 | pages = 267–71 | date = January 2002 | pmid = 11687575 | doi = 10.1074/jbc.m107850200 }}</ref>. Фосфорилирование CK2α регулирует внутриклеточную локализацию BMAL1<ref>{{cite journal | vauthors = Tamaru T, Hirayama J, Isojima Y, Nagai K, Norioka S, Takamatsu K, Sassone-Corsi P | title = CK2alpha phosphorylates BMAL1 to regulate the mammalian clock | journal = Nature Structural & Molecular Biology | volume = 16 | issue = 4 | pages = 446–8 | date = April 2009 | pmid = 19330005 | doi = 10.1038/nsmb.1578 }}</ref, а фосфорилирование GSK3B контролирует стабильность BMAL1 и предготавливает его для последующего убиквитинирования<ref>{{cite journal | vauthors = Sahar S, Zocchi L, Kinoshita C, Borrelli E, Sassone-Corsi P | title = Regulation of BMAL1 protein stability and circadian function by GSK3beta-mediated phosphorylation | journal = PloS One | volume = 5 | issue = 1 | pages = e8561 | date = January 2010 | pmid = 20049328 | doi = 10.1371/journal.pone.0008561 | bibcode = 2010PLoSO...5.8561S }}</ref>. |
|||
== Взаимодействия с белками == |
== Взаимодействия с белками == |
||
Версия от 21:15, 14 сентября 2017
ARNTL (сокр. от англ. Aryl hydrocarbon receptor nuclear translocator-like protein 1) — белок, подобный ядерному транслокатору AHR, кодируется одноимённым геном ARNTL, расположенным на коротком плече (p-плече) 11-ой хромосомы[4]. Также известен как BMAL1, MOP3 и, реже, BHLHE5, BMAL, BMAL1C, JAP3, PASD3 и TIC.
Белок состоит из последовательности 626 аминокислот и имеет молекулярную массу 68 762[5].
История
Структура
Белок BMAL1 содержит четыре домена в соответствии с его кристаллографической структурой: домен bHLH, два домена PAS, называемые PAS-A и PAS-B, и транс-активирующий домен. Димеризация белков CLOCK: BMAL1 включает сильные взаимодействия между доменами bHLH, PAS-A и PAS-B как CLOCK, так и BMAL1 и образует асимметричный гетеродимер с тремя различными белковыми интерфейсами. Взаимодействие PAS-A между CLOCK и BMAL1, состоит из α-спирали CLOCK PAS-A и ß-листа BMAL1 PAS-A и α-спирального мотива домена BMAL1 PAS-A и ß-листа CLOCK PAS-A[6]. Области CLOCK и BMAL1 PAS-B располагаются параллельно, что приводит к сокрытию различных гидрофобных остатков аминокислот на ß-листе BMAL1 PAS-B и спиральной поверхности CLOCK PAS-B, таких как остатки Tyr 310 и Phe 423[6]. Ключевые взаимодействия со специфическими аминокислотными остатками, особенно CLOCK His 84 и BMAL1 Leu 125, важны для димеризации этих молекул[7].
Функции
Белок, кодируемый геном Bmal1 у млекопитающих, связывается со вторым белком bHLH-PAS через домен PAS, CLOCK (или его паралог, NPAS2) с образованием гетеродимера в клеточном ядре[8]. Через свой домен BHLH этот гетеродимер связывается с элементами отклика E-box[9] в областях промотора Per (Per1 и Per2) и Cry генов (Cry1 и Cry2)[9]. Это связывание активирует транскрипцию и трансляцию белков PER1, PER2, CRY1 и CRY2.
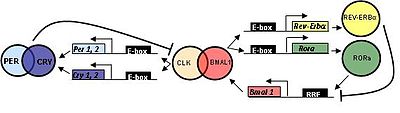
После того, как белки PER и CRY накапливаются до достаточных концентраций, они взаимодействуют со своими мотивам PAS с образованием большого репрессорного комплекса, который перемещается в ядро, чтобы ингибировать транскрипционную активность гетеродимера CLOCK:BMAL1[10]. Этот процесс приводит к ингибированию транскрипции Per и Cry гены, и вызывает снижение концентрации белка PER и CRY. Эта транскрипция, петля отрицательной обратной связи трансляции (TTFL) модулируется в цитоплазме путём фосфорилирования белков PER казеинкиназой 1ε или δ (CK1 ε или CK1 δ), сигнализируя эти белки для деградации протеасомами 26S[9][11]. SIRT1 также регулирует деградацию белка PER посредством ингибирования транскрипционной активности гетеродимера BMAL1:CLOCK путем циркадного (кругового) деацетилирования[12]. Деградация PER-белков предотвращает образование комплекса больших белков и, таким образом, предотвращает ингибирование транскрипционной активности гетеродимера BMAL1:CLOCK[9]. Белок CRY также сигнализируют о деградации поли-убиквированием белка FBXL3, также предотвращая ингибирование гетеродимера CLOCK:BMAL1. Это позволяет возобновить транскрипцию генов Per и Cry. В петле TTFL ночных мышей наблюдалось, что уровни транскрипции пика гена Bmal1 в CT18 во время средней субъективной ночи имеют антифазный уровень транскрипции Per, Cry и других генов контроля частоты, пик в CT6, в середине-субъективного дня. Этот процесс происходит с длиной периода около 24 часов и поддерживает представление о том, что этот молекулярный механизм ритмичен[13].
Регулирование активности Bmal1
В дополнение к циркадной регуляторной TTFL-петле, описанной выше, транскрипция Bmal1 регулируется конкурентным связыванием с сайтом связывания с ретиноидной кислотой, связанным с сайтом-рецептором (RORE) в промоторной области Bmal1. Гетеродимер CLOCK:BMAL1 также связывается с элементами E-box в промоторных областях генов Rev-Erbα и RORα/ß, активируя транскрипцию и трансляцию белков REV-ERB и ROR. Белки REV-ERBα и ROR регулируют экспрессию BMAL1 через вторичный контур обратной связи и конкурируют за связывание с элементами ответа Rev-Erb/ROR в промоторной области Bmal1, в результате чего экспрессию BMAL1 подавляют REV-ERBα и активируют белки ROR. Было показано, что другие ядерные рецепторы тех же семейств (NR1D2 (Rev-erb-β), NR1F2 (ROR-β) и NR1F3 (ROR-γ)) также действуют на транскрипционную активность Bmal1[14][15][16][17].
Несколько посттрансляционных модификаций BMAL1 определяют время циклов обратной связи CLOCK:BMAL1. Фосфорилирование BMAL1 нацеливает его на убиквитинирование и деградацию, а также на деубиквитинирование и стабилизацию. Ацетилирование BMAL1 рекрутирует CRY1 для подавления трансактивации CLOCK:BMAL1[18]. Сумоилирование BMAL1 с помощью небольшого модификатора, связанного с убиквитином 3 (SUMO3), сигнализирует о его убиквитинировании в ядре, что приводит к трансактивации гетеродимера CLOCK:BMAL1[19]. Трансактивация комплекса CLOCK:BMAL1[20] активируется фосфорилированием казеинкиназы 1ε и ингибируется фосфорилированием MAPK[21]. Фосфорилирование CK2α регулирует внутриклеточную локализацию BMAL1Ошибка в сносках?: Отсутствует закрывающий тег </ref>.
Взаимодействия с белками
ARNTL взаимодействует со следующими белками:
Примечания
- ↑ 1 2 3 GRCm38: Ensembl release 89: ENSMUSG00000055116 - Ensembl, May 2017
- ↑ Ссылка на публикацию человека на PubMed: Национальный центр биотехнологической информации, Национальная медицинская библиотека США.
- ↑ Ссылка на публикацию мыши на PubMed: Национальный центр биотехнологической информации, Национальная медицинская библиотека США.
- ↑ ARNTL aryl hydrocarbon receptor nuclear translocator-like [ Homo sapiens (human) ]. National Center for Biotechnology Information.
- ↑ UniProt, O00327 (англ.).
- ↑ 1 2 Huang N, Chelliah Y, Shan Y, Taylor CA, Yoo SH, Partch C, Green CB, Zhang H, Takahashi JS (July 2012). "Crystal structure of the heterodimeric CLOCK:BMAL1 transcriptional activator complex". Science. 337 (6091): 189—94. Bibcode:2012Sci...337..189H. doi:10.1126/science.1222804. PMC 3694778. PMID 22653727.
- ↑ Wang Z, Wu Y, Li L, Su XD (February 2013). "Intermolecular recognition revealed by the complex structure of human CLOCK-BMAL1 basic helix-loop-helix domains with E-box DNA". Cell Research. 23 (2): 213—24. doi:10.1038/cr.2012.170. PMC 3567813. PMID 23229515.
- ↑ Harfmann BD, Schroder EA, Esser KA (April 2015). "Circadian rhythms, the molecular clock, and skeletal muscle". Journal of Biological Rhythms. 30 (2): 84—94. doi:10.1177/0748730414561638. PMC 4470613. PMID 25512305.
- ↑ 1 2 3 4 Buhr ED, Takahashi JS (2013). "Molecular components of the Mammalian circadian clock". Handbook of Experimental Pharmacology. Handbook of Experimental Pharmacology. 217 (217): 3—27. doi:10.1007/978-3-642-25950-0_1. ISBN 978-3-642-25949-4. PMC 3762864. PMID 23604473.
- ↑ Bollinger T, Schibler U (2014). "Circadian rhythms - from genes to physiology and disease". Swiss Medical Weekly. 144: w13984. doi:10.4414/smw.2014.13984. PMID 25058693.
- ↑ Maywood ES, Chesham JE, Smyllie NJ, Hastings MH (April 2014). "The Tau mutation of casein kinase 1ε sets the period of the mammalian pacemaker via regulation of Period1 or Period2 clock proteins". Journal of Biological Rhythms. 29 (2): 110—8. doi:10.1177/0748730414520663. PMC 4131702. PMID 24682205.
- ↑ Asher G, Gatfield D, Stratmann M, Reinke H, Dibner C, Kreppel F, Mostoslavsky R, Alt FW, Schibler U (July 2008). "SIRT1 regulates circadian clock gene expression through PER2 deacetylation". Cell. 134 (2): 317—28. doi:10.1016/j.cell.2008.06.050. PMID 18662546.
- ↑ Ueda HR, Chen W, Adachi A, Wakamatsu H, Hayashi S, Takasugi T, Nagano M, Nakahama K, Suzuki Y, Sugano S, Iino M, Shigeyoshi Y, Hashimoto S (August 2002). "A transcription factor response element for gene expression during circadian night". Nature. 418 (6897): 534—9. Bibcode:2002Natur.418..534U. doi:10.1038/nature00906. PMID 12152080.
- ↑ Akashi M, Takumi T (May 2005). "The orphan nuclear receptor RORalpha regulates circadian transcription of the mammalian core-clock Bmal1". Nature Structural & Molecular Biology. 12 (5): 441—8. doi:10.1038/nsmb925. PMID 15821743.
- ↑ Guillaumond F, Dardente H, Giguère V, Cermakian N (October 2005). "Differential control of Bmal1 circadian transcription by REV-ERB and ROR nuclear receptors". Journal of Biological Rhythms. 20 (5): 391—403. doi:10.1177/0748730405277232. PMID 16267379.
- ↑ Ueda HR, Hayashi S, Chen W, Sano M, Machida M, Shigeyoshi Y, Iino M, Hashimoto S (February 2005). "System-level identification of transcriptional circuits underlying mammalian circadian clocks". Nature Genetics. 37 (2): 187—92. doi:10.1038/ng1504. PMID 15665827.
- ↑ Liu AC, Tran HG, Zhang EE, Priest AA, Welsh DK, Kay SA (February 2008). Takahashi JS (ed.). "Redundant function of REV-ERBα and β and non-essential role for Bmal1 cycling in transcriptional regulation of intracellular circadian rhythms". PLoS Genetics. 4 (2): e1000023. doi:10.1371/journal.pgen.1000023. PMC 2265523. PMID 18454201.
{{cite journal}}: Википедия:Обслуживание CS1 (не помеченный открытым DOI) (ссылка) - ↑ Hirayama J, Sahar S, Grimaldi B, Tamaru T, Takamatsu K, Nakahata Y, Sassone-Corsi P (December 2007). "CLOCK-mediated acetylation of BMAL1 controls circadian function". Nature. 450 (7172): 1086—90. Bibcode:2007Natur.450.1086H. doi:10.1038/nature06394. PMID 18075593.
- ↑ Lee J, Lee Y, Lee MJ, Park E, Kang SH, Chung CH, Lee KH, Kim K (October 2008). "Dual modification of BMAL1 by SUMO2/3 and ubiquitin promotes circadian activation of the CLOCK/BMAL1 complex". Molecular and Cellular Biology. 28 (19): 6056—65. doi:10.1128/MCB.00583-08. PMC 2546997. PMID 18644859.
- ↑ Eide EJ, Vielhaber EL, Hinz WA, Virshup DM (May 2002). "The circadian regulatory proteins BMAL1 and cryptochromes are substrates of casein kinase Iepsilon". The Journal of Biological Chemistry. 277 (19): 17248—54. doi:10.1074/jbc.m111466200. PMC 1513548. PMID 11875063.
{{cite journal}}: Википедия:Обслуживание CS1 (не помеченный открытым DOI) (ссылка) - ↑ Sanada K, Okano T, Fukada Y (January 2002). "Mitogen-activated protein kinase phosphorylates and negatively regulates basic helix-loop-helix-PAS transcription factor BMAL1". The Journal of Biological Chemistry. 277 (1): 267—71. doi:10.1074/jbc.m107850200. PMID 11687575.
{{cite journal}}: Википедия:Обслуживание CS1 (не помеченный открытым DOI) (ссылка) - ↑ 1 2 3 4 Hogenesch JB, Gu YZ, Jain S, Bradfield CA (May 1998). "The basic-helix-loop-helix-PAS orphan MOP3 forms transcriptionally active complexes with circadian and hypoxia factors". Proceedings of the National Academy of Sciences of the United States of America. 95 (10): 5474—9. Bibcode:1998PNAS...95.5474H. doi:10.1073/pnas.95.10.5474. PMC 20401. PMID 9576906.
{{cite journal}}: Википедия:Обслуживание CS1 (множественные имена: authors list) (ссылка) - ↑ Ooe N, Saito K, Mikami N, Nakatuka I, Kaneko H (January 2004). "Identification of a novel basic helix-loop-helix-PAS factor, NXF, reveals a Sim2 competitive, positive regulatory role in dendritic-cytoskeleton modulator drebrin gene expression". Molecular and Cellular Biology. 24 (2): 608—16. doi:10.1128/MCB.24.2.608-616.2004. PMC 343817. PMID 14701734.
{{cite journal}}: Википедия:Обслуживание CS1 (множественные имена: authors list) (ссылка) - ↑ 1 2 McNamara P, Seo SB, Rudic RD, Sehgal A, Chakravarti D, FitzGerald GA (June 2001). "Regulation of CLOCK and MOP4 by nuclear hormone receptors in the vasculature: a humoral mechanism to reset a peripheral clock". Cell. 105 (7): 877—89. doi:10.1016/S0092-8674(01)00401-9. PMID 11439184.
{{cite journal}}: Википедия:Обслуживание CS1 (множественные имена: authors list) (ссылка) - ↑ Takahata S, Ozaki T, Mimura J, Kikuchi Y, Sogawa K, Fujii-Kuriyama Y (September 2000). "Transactivation mechanisms of mouse clock transcription factors, mClock and mArnt3". Genes to Cells. 5 (9): 739—47. doi:10.1046/j.1365-2443.2000.00363.x. PMID 10971655.
{{cite journal}}: Википедия:Обслуживание CS1 (множественные имена: authors list) (ссылка) - ↑ 1 2 3 Xu H, Gustafson CL, Sammons PJ, Khan SK, Parsley NC, Ramanathan C, Lee HW, Liu AC, Partch CL (June 2015). "Cryptochrome 1 regulates the circadian clock through dynamic interactions with the BMAL1 C terminus". Nature Structural & Molecular Biology. 22 (6): 476—84. doi:10.1038/nsmb.3018. PMC 4456216. PMID 25961797.
{{cite journal}}: Википедия:Обслуживание CS1 (множественные имена: authors list) (ссылка)



