Фторноватистая кислота
| Фторноватистая кислота | |||
|---|---|---|---|
| |||
| Общие | |||
| Систематическое наименование |
фторноватистая кислота | ||
| Хим. формула | HOF | ||
| Физические свойства | |||
| Молярная масса | 36,0057 г/моль | ||
| Термические свойства | |||
| Температура | |||
| • плавления | −117 °C | ||
| • кипения | 19 °C | ||
| • разложения | 20 °C | ||
| Энтальпия | |||
| • образования | −98,3 кДж/моль | ||
| Классификация | |||
| Рег. номер CAS | 14034-79-8 | ||
| PubChem | 123334 | ||
| SMILES | |||
| InChI | |||
| ChEBI | 47864 | ||
| ChemSpider | 109936 | ||
| Безопасность | |||
| Токсичность | Чрезвычайно ядовита, СДЯВ | ||
| NFPA 704 | |||
| Приведены данные для стандартных условий (25 °C, 100 кПа), если не указано иное. | |||
Фторноватистая кислота (фтороксигенат(0) водорода) — неорганическое соединение HOF, в котором формальная степень окисления кислорода равна 0. Название получила по аналогии с хлорноватистой кислотой. Кислотных свойств не проявляет, солей не образует, однако существуют ковалентные производные формального замещения водорода, называемые гипофторитами.
Строение[править | править код]
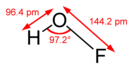
Угол H-O-F составляет 97°. Длина связей H—O равна 0,0964 нм, у O—F — 0,1442 нм.
Получение[править | править код]
Данное соединение впервые удалось получить М. Студьеру и Э. Эплмену в 1971 г. фторированием льда при −40 °C:
Свойства[править | править код]
Светло-желтая жидкость, ниже −117 °С застывающая в бесцветные кристаллы. Кипит, разлагаясь, при 19 °С.
Взрывоопасна, разлагается на фтороводород и кислород:
Химические свойства[править | править код]
Сильный окислитель. Реагирует с водой с образованием пероксида водорода и фтороводорода:
Со фтором реагирует с образованием фторида кислорода:
С фторидом кислорода(II) даёт диоксидифторид:
С ацетонитрилом дает относительно стабильный в растворе комплекс 1:1.
Применение[править | править код]
Комплекс с ацетонитрилом предложен как очень эффективный эпоксидирующий агент для алкенов (в том числе пространственно затрудненных).
Литература[править | править код]
- Гринвуд Н., Эрншо А. Химия элементов. — Т.1. — М.: БИНОМ. Лаборатория знаний, 2008. — С. 593
- Некрасов Б. В. Основы общей химии. — Т.1. — М.: Химия, 1973. — С. 242
- Степин Б. Д., Цветков А. А. Неорганическая химия. — М.: Высшая школа, 1994. — С. 323
- Успехи химии. — 2004. — Т.73, № 6. — С. 662—665