5,10,15,20-тетрафенилпорфирин
| 5,10,15,20-Тетрафенилпорфирин | |
|---|---|
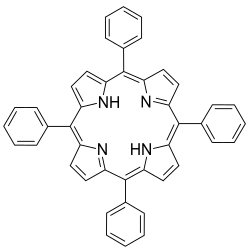 | |
| Общие | |
| Систематическое наименование |
5,10,15,20-Тетрафенилпорфирин |
| Сокращения | ТФП |
| Традиционные названия | Тетрафенилпорфирин |
| Хим. формула | C44H30N4 |
| Физические свойства | |
| Молярная масса | 614.74 г/моль |
| Классификация | |
| Рег. номер CAS | 917-23-7 |
| PubChem | 70186 |
| Рег. номер EINECS | 213-025-9 |
| SMILES | |
| InChI | |
| ChEBI | 52279 |
| ChemSpider | 21171760 |
| Приведены данные для стандартных условий (25 °C, 100 кПа), если не указано иное. | |
5,10,15,20-Тетрафенилпорфирин (он же тетрафенилпорфирин, ТФП) — гетероциклическое соединение, аналог природных порфиринов. Представляет собой порошок пурпурного цвета, нерастворимый в воде; растворимый в некоторых органических растворителях, например, в хлороформе, бензоле, ацетоне и ДМСО.
Синтез и структура[править | править код]
Тетрафенилпорфирин был впервые синтезирован в 1935 году Ротмундом при нагревании смеси пиррола и бензальдегида в запаянной ампуле при 150 °C в течение 24 часов[1]. Модифицированная методика, позволяющая получать продукт с более высоким выходом, была предложена Адлером и Лонго. Пиррол и бензальдегид реагируют в кипящей пропионовой кислоте (141 °C) на воздухе[2]:
8 C4H4NH + 8 C6H5CHO + 3 O2 → 2 (C6H5C)4(C4H2N)2(C4H2NH)2 + 14 H2O
Молекула тетрафенилпорфирина имеет группу симметрии C2h. Фенильные заместители расположены в так называемых «мезо» положениях порфиринового макроцикла, поэтому данное соединение также называют мезо-тетрафенилпорфирином. Известны многие производные тетрафенилпорфирина, в частности, содержащие заместители в фенильных группах. Одним из первых опубликованных функциональных аналогов миоглобина был комплекс тетранитротетрафенилпорфирина с железом. ТФП вступает в реакцию сульфирования, давая водорастворимые сульфо-производные
4 SO3 + (C6H5C)4(C4H2N)2(C4H2NH)2 → (HO3SC6H4C)4(C4H2N)2(C4H2NH)2 + 4 H2O
Комплексы с металлами[править | править код]
Процесс комплексообразование ТФП с металлами проходит в несколько стадий, без образования соответствующего дианиона. Соответствующие комплексы обладают симметричной структурой и характеризуются простыми ЯМР и ЭПР спектрами. Комплексы с переходными металлами, например, с железом, обладают более сложными свойствами за счет возможности изменения степени окисления и координационного числа.
Оптические свойства[править | править код]

Тетрафенилпорфирин имеет сильную полосу поглощения с максимумом при 419 нм (так называемая полоса Соре) и четыре слабых полосы поглощения с максимумами при 515, 550, 593 и 649 нм (так называемые Q-полосы). Флуоресцирует красным светом. Квантовый выход флуоресценции — 11 %[3].
Применение[править | править код]
ТФП используется как сенсибилизатор для генерации синглетного кислорода.
Ссылки[править | править код]
- ↑ Rothemund Paul. A New Porphyrin Synthesis. The Synthesis of Porphin1 (англ.) // Journal of the American Chemical Society. — 1936. — April (vol. 58, no. 4). — P. 625—627. — ISSN 0002-7863. — doi:10.1021/ja01295a027.
- ↑ Adler Alan D., Longo Frederick R., Finarelli John D., Goldmacher Joel, Assour Jacques, Korsakoff Leonard. A simplified synthesis for meso-tetraphenylporphine (англ.) // The Journal of Organic Chemistry. — 1967. — February (vol. 32, no. 2). — P. 476—476. — ISSN 0022-3263. — doi:10.1021/jo01288a053.
- ↑ Kim J. B., Leonard J. J., Longo F. R. A mechanistic study of the synthesis and spectral properties of meso-tetraarylporphyrins. (англ.) // Journal Of The American Chemical Society. — 1972. — 31 May (vol. 94, no. 11). — P. 3986—3992. — doi:10.1021/ja00766a056. — PMID 5037983.