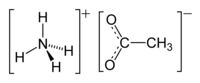
Ацетат аммония
Текущая версия страницы пока не проверялась опытными участниками и может значительно отличаться от версии, проверенной 13 июня 2016 года; проверки требуют 12 правок.
| Ацетат аммония | |
|---|---|
 | |
| Общие | |
| Систематическое наименование |
Ацетат аммония |
| Традиционные названия | Уксуснокислый аммоний |
| Хим. формула | C2H7NO2 |
| Рац. формула | CH3COONH4 |
| Физические свойства | |
| Состояние | кристаллическое |
| Молярная масса | 77,0825 г/моль |
| Плотность | 1,07 г/см³ |
| Термические свойства | |
| Температура | |
| • разложения | 112 °C |
| Химические свойства | |
| Растворимость | |
| • в воде | 148 г/100 мл |
| Структура | |
| Кристаллическая структура | ромбическая сингония |
| Классификация | |
| Рег. номер CAS | 631-61-8 |
| PubChem | 517165 |
| Рег. номер EINECS | 211-162-9 |
| SMILES | |
| InChI | |
| RTECS | AF3675000 |
| ChEBI | 62947 |
| ChemSpider | 11925 |
| Безопасность | |
| NFPA 704 | |
| Приведены данные для стандартных условий (25 °C, 100 кПа), если не указано иное. | |
Ацета́т аммо́ния — органическое вещество, аммониевая соль уксусной кислоты. Пищевая добавка E264 (консервант).
Получение[править | править код]
Ацетат аммония получают по реакциям:
Химические свойства[править | править код]
При сравнительно низкой температуре 112 °C (385 K) разлагается на воду и ацетамид:
В водном растворе подвергается гидролизу:
Применение[править | править код]
Соль слабой кислоты и слабого основания, ацетат аммония применяется:
- как биоразлагаемый реагент — антиобледенитель
- как буфер совместно с раствором уксусной кислоты. Особенностью данного буфера является его разложение при низких температурах без образования ионов.
- в органическом синтезе: реакция Кнёвенагеля.
- Растворенный в дистиллированной воде используется как коагулянт, осаждающий белки из раствора.
Ссылки[править | править код]
- ↑ Получение ацетата аммония. Дата обращения: 3 марта 2017. Архивировано 4 марта 2017 года.
См. также[править | править код]
• Ацетаты
Это заготовка статьи об органическом веществе. Помогите Википедии, дополнив её. |



![{\displaystyle {\ce {CH3COONH4 ->[t] CH3C(O)NH2 + H2O}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/9ec3bf37d97e3ead1a1fb331f1020e2105102813)
