Циклооктатетраен
| Циклооктатетраен | |||
|---|---|---|---|
| |||
| Общие | |||
| Систематическое наименование |
циклоокта-1,3,5,7-тетраен | ||
| Хим. формула | C8H8 | ||
| Физические свойства | |||
| Состояние | Золотисто-желтая жидкость | ||
| Молярная масса | 104,15 г/моль | ||
| Плотность | 0,925 г/см³ | ||
| Термические свойства | |||
| Температура | |||
| • плавления | −6 °C | ||
| • кипения | 142 °C | ||
| • вспышки | 20 °C | ||
| Классификация | |||
| Рег. номер CAS | 629-20-9 | ||
| PubChem | 637866 | ||
| Рег. номер EINECS | 211-080-3 | ||
| SMILES | |||
| InChI | |||
| ChEBI | 47034 | ||
| ChemSpider | 553448 | ||
| Безопасность | |||
| Фразы риска (R) | R45, R46, R11, R36/38, R48/23/24/25, R65 | ||
| Фразы безопасности (S) | S53, S45 | ||
| NFPA 704 | |||
| Приведены данные для стандартных условий (25 °C, 100 кПа), если не указано иное. | |||
Циклооктатетрае́н ( [8]-аннулен ) — циклический непредельный углеводород, бесцветная или слегка желтая горючая жидкость. Имеет замкнутую систему сопряженных двойных связей, но, в отличие от бензола, не является ароматическим.
Получение[править | править код]
Впервые получен Рихардом Вильштеттером в 1905 году многостадийным синтезом из псевдопельтьерина[англ.][1].
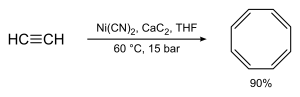
Впоследствии Вальтером Реппе был найден одностадийный способ синтеза путём тетрамеризации ацетилена при высоком давлении в присутствии катализатора[2]:
Химические свойства[править | править код]
Циклооктатетраен проявляет свойства, характерные для непредельных углеводородов. Частично или полностью гидрируется водородом, окисляется надкислотами до эпоксидов.
Известны реакции, ведущие к образованию ароматических соединений, сопровождающиеся сужением цикла до бензольного кольца [2][3].
Примечания[править | править код]
- ↑ Richard Willstätter, Ernst Waser. Über Cyclo‐octatetraen (англ.) // Berichte der deutschen chemischen Gesellschaft. — 1911-07. — Vol. 44, iss. 3. — P. 3423–3445. — ISSN 0365-9496. — doi:10.1002/cber.191104403216.
- ↑ 1 2 Walter Reppe, Otto Schlichting, Karl Klager, Tim Toepel. Cyclisierende Polymerisation von Acetylen I Über Cyclooctatetraen (нем.) // Justus Liebigs Annalen der Chemie. — 1948-07-31. — Bd. 560, H. 1. — S. 1–92. — doi:10.1002/jlac.19485600102.
- ↑ Sango Kunichika. Cyclopolyolefins Derived from Acetylene (англ.) // Bulletin of the Institute for Chemical Research, Kyoto University. — 1953-09-30. — Vol. 31, iss. 5. — P. 323–335. — ISSN 0023-6071. Архивировано 19 мая 2023 года.
Литература[править | править код]
- Луис Физер, Мэри Физер. 16.6 Циклооктатетраен. // Органическая химия. Углубленный курс / Под ред. Н. С. Вульфсона. — М.: Химия, 1966. — Т. 2. — 783 с. — 15 000 экз.
- Химическая энциклопедия / Редкол.: Зефиров Н. С. (гл. ред.) и др.. — М.: Большая Российская энцикл., 1998. — Т. 5. — С. [369] (стб. 729). — 783 с. — 20 000 экз. — ISBN 5-85270-310-9.
Это заготовка статьи об органическом веществе. Помогите Википедии, дополнив её. |