Ацетилен
| Ацетилен | |||
|---|---|---|---|
| |||
 | |||
| Общие | |||
| Систематическое наименование |
Этин | ||
| Традиционные названия | Ацетилен | ||
| Хим. формула | C2H2 | ||
| Рац. формула | HC ≡ CH | ||
| Физические свойства | |||
| Состояние | Газ | ||
| Молярная масса | 26,038[1] г/моль | ||
| Плотность | 1,0896 г/л | ||
| Энергия ионизации | 11,4 эВ[2][3] | ||
| Термические свойства | |||
| Температура | |||
| • плавления | -80,8 1277 мм Hg °C | ||
| • сублимации | −83,9 °C[2] | ||
| • кипения | −83,6 °C | ||
| • самовоспламенения | 335 °C | ||
| Пределы взрываемости | 2,5 об.%[2] | ||
| Тройная точка | −80,55 | ||
| Критическая точка | 35,2°С; 6,4 МПа | ||
| Мол. теплоёмк. | 44,036 Дж/(моль·К) | ||
| Энтальпия | |||
| • образования | +226,88 кДж/моль | ||
| • сгорания | –1302 кДж/моль | ||
| Давление пара | 4 478 565 Па[2] | ||
| Химические свойства | |||
| Константа диссоциации кислоты | 25 | ||
| Растворимость | |||
| • в воде | малорастворим | ||
| • в этаноле | малорастворим | ||
| Структура | |||
| Гибридизация | sp-гибридизация | ||
| Дипольный момент | 0 Кл·м[3] | ||
| Классификация | |||
| Рег. номер CAS | 74-86-2 | ||
| PubChem | 6326 | ||
| Рег. номер EINECS | 200-816-9 | ||
| SMILES | |||
| InChI | |||
| RTECS | AO9600000 | ||
| ChEBI | 27518 | ||
| Номер ООН | 1001 | ||
| ChemSpider | 6086 | ||
| Безопасность | |||
| Пиктограммы ECB |
|
||
| NFPA 704 | |||
| Приведены данные для стандартных условий (25 °C, 100 кПа), если не указано иное. | |||
Ацетиле́н (от лат. acetum — «уксус»[4], эти́н, химическая формула — C2H2 или HC ≡ CH) — органическое соединение, возглавляющее класс непредельных углеводородов — алкинов.
При нормальных условиях, ацетилен — это бесцветный, слаботоксичный, очень горючий и взрывоопасный газ[5].
Карбанионные соли ацетилена называются ацетилени́дами.
История
[править | править код]Открыт в 1836 году Э. Дэви, синтезирован из угля и водорода (дуговой разряд между двумя угольными электродами в атмосфере водорода) М. Бертло (1862 год).
Физические свойства
[править | править код]
При нормальных условиях — бесцветный газ, легче воздуха. Чистый 100 % ацетилен не обладает запахом (запах ему придают примеси, например дифосфин). Растворим в воде, хорошо растворяется в ацетоне. Температура кипения −83,6 °C[6]. Тройная точка −80,55 °C при давлении 961,5 мм рт. ст., критическая точка 35,18 °C при давлении 61,1 атм[7]. Имеет тройную связь между атомами углерода.
Ацетилен требует большой осторожности при обращении. Может взрываться от удара, при нагреве до 500 °C или при сжатии выше 0,2 МПа[8] при комнатной температуре. Струя ацетилена, выпущенная на открытый воздух, может загореться от малейшей искры, в том числе от разряда статического электричества с пальца руки. Технический ацетилен хранится в баллонах с пористым наполнителем, пропитанным ацетоном (так как чистый ацетилен при сжатии взрывается), и может содержать другие примеси, которые придают ему резкий запах[9][10].
Ацетилен обнаружен на Уране и Нептуне.
Химические свойства
[править | править код]
Ацетилен с водой, в присутствии солей ртути и других катализаторов, образует уксусный альдегид (реакция Кучерова). В силу наличия тройной связи, молекула высокоэнергетична и обладает большой удельной теплотой сгорания — 14000 ккал/м3 (50,4 МДж/кг). При сгорании в кислороде температура пламени достигает 3150 °C. Ацетилен может полимеризироваться в бензол и другие органические соединения (полиацетилен, винилацетилен). Для полимеризации в бензол необходим графит и температура в ~500 °C. В присутствии катализаторов, например, трикарбонил(трифенилфосфин)никеля, температуру реакции циклизации можно снизить до 60—70 °C.
Кроме того, атомы водорода ацетилена относительно легко отщепляются в виде протонов, то есть он проявляет кислотные свойства. Так, ацетилен вытесняет метан из эфирного раствора магнийметилбромида (образуется содержащий ацетиленид-ион раствор), образует нерастворимые взрывчатые осадки с солями серебра и одновалентной меди.
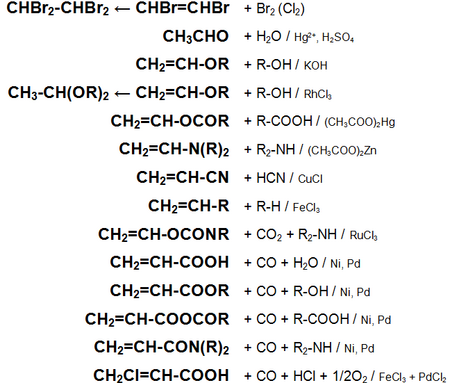
Основные химические реакции ацетилена (реакции присоединения, сводная таблица 1.):
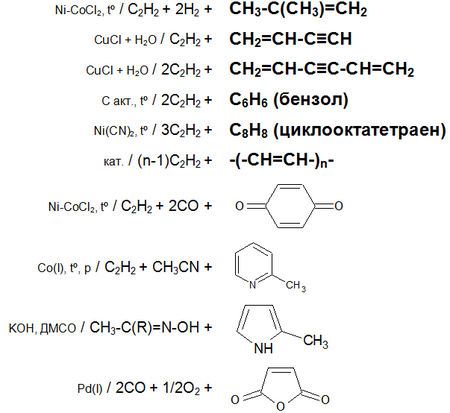
Основные химические реакции ацетилена (реакции присоединения, димеризации, полимеризации, цикломеризации, сводная таблица 2.):
Ацетилен обесцвечивает бромную воду и раствор перманганата калия.
Реагирует с аммиачными растворами солей Cu(I) и Ag(I) с образованием малорастворимых, взрывчатых ацетиленидов — эта реакция используется для качественного определения ацетилена и его отличия от алкенов (которые тоже обесцвечивают бромную воду и раствор перманганата калия).
Получение
[править | править код]В лаборатории
[править | править код]В лаборатории, а также в газосварочном оборудовании, ацетилен получают действием воды на карбид кальция[11] (Ф. Вёлер, 1862 год)[8]:
а также при дегидрировании двух молекул метана при температуре свыше 1400 °C:
В промышленности
[править | править код]В промышленности ацетилен получают гидролизом карбида кальция и пиролизом углеводородного сырья — метана или пропана с бутаном. В последнем случае ацетилен получают совместно с этиленом и примесями других углеводородов. Карбидный метод позволяет получать очень чистый ацетилен, но требует высокого расхода электроэнергии. Пиролиз существенно менее энергозатратен, так как для нагрева реактора используется сгорание того же рабочего газа во внешнем контуре, но в газовом потоке продуктов концентрация самого ацетилена низка. Выделение и концентрирование индивидуального ацетилена в таком случае представляет сложную задачу. Экономические оценки обоих методов многочисленны, но противоречивы[12][:стр. 274].

Получение пиролизом
[править | править код]Электрокрекинг
[править | править код]Метан превращают в ацетилен и водород в электродуговых печах (температура 2000—3000 °С, напряжение между электродами 1000 В). Метан при этом разогревается до 1600 °С. Расход электроэнергии составляет около 13000 кВт•ч на 1 тонну ацетилена, что относительно много (примерно равно затрачиваемой энергии по карбидному методу) и потому является недостатком процесса. Выход ацетилена составляет 50 %.
Регенеративный пиролиз
[править | править код]Иное название — Вульф-процесс. Сначала разогревают насадку печи путём сжигания метана при 1350—1400 °С. Далее через разогретую насадку пропускают метан. Время пребывания метана в зоне реакции очень мало и составляет доли секунды. Процесс реализован в промышленности, но экономически оказался не таким перспективным, как считалось на стадии проектирования.
Окислительный пиролиз
[править | править код]Метан смешивают с кислородом. Часть сырья сжигают, а образующееся тепло расходуют на нагрев остатка сырья до 1600 °С. Выход ацетилена составляет 30—32 %. Метод имеет преимущества — непрерывный характер процесса и низкие энергозатраты. Кроме того, с ацетиленом образуется ещё и синтез-газ. Этот процесс (Заксе-процесс или BASF-процесс) получил наиболее широкое внедрение.
Гомогенный пиролиз
[править | править код]Является разновидностью окислительного пиролиза. Часть сырья сжигают с кислородом в топке печи, газ нагревается до 2000 °С. Затем в среднюю часть печи вводят остаток сырья, предварительно нагретый до 600 °С. Образуется ацетилен. Метод характеризуется большей безопасностью и надёжностью работы печи.
Пиролиз в струе низкотемпературной плазмы
[править | править код]Процесс разрабатывается с 1970-х годов, но, несмотря на перспективность, пока не внедрён в промышленности. Сущность процесса состоит в нагреве метана ионизированным газом. Преимущество метода заключается в относительно низких энергозатратах (5000—7000 кВт•ч) и высоких выходах ацетилена (87 % в аргоновой плазме и 73 % в водородной).
Карбидный метод
[править | править код]Этот способ известен с XIX века, но не потерял своего значения до настоящего времени. Сначала получают карбид кальция, сплавляя оксид кальция (негашёную известь) и кокс в электропечах при 2500—3000 °С:
Негашёную известь получают из карбоната кальция:
Далее карбид кальция обрабатывают водой:
Получаемый ацетилен имеет высокую степень чистоты 99,9 %. Основным недостатком процесса является высокий расход электроэнергии: 10000—11000 кВт•ч на 1 тонну ацетилена.
Применение
[править | править код]
Ацетилен используется:
- Для газовой сварки и резки металлов;
- Как источник очень яркого, белого света в автономных светильниках, где он получается реакцией карбида кальция и воды (см. карбидная лампа);
- В производстве взрывчатых веществ (см. ацетилениды);
- Для получения уксусной кислоты, этилового спирта, растворителей, пластических масс, каучука, ароматических углеводородов;
- Для получения технического углерода;
- В атомно-абсорбционной спектрофотометрии при пламенной атомизации;
- В ракетных двигателях (вместе с аммиаком)[13];
- В начале XX века широкое распространение имели автомобильные ацетиленовые фары, которые только в 1920-е были вытеснены электрическими.
Безопасность
[править | править код]
справа — ацетиленовый газовый баллон с ацетиленовым редуктором,
слева кислородный газовый баллон с кислородным редуктором.
Поскольку ацетилен плохо растворим в воде, и его смеси с кислородом могут взрываться в очень широком диапазоне концентраций (2,5 — 93 %%), его не следует собирать в газометры.
Ацетилен взрывается при температуре около 500 °C или давлении выше 0,2 МПа; КПВ 2,3—80,7 %, температура самовоспламенения 335 °C. Взрывоопасность уменьшается при разбавлении ацетилена другими газами, например азотом, метаном или пропаном.
При длительном соприкосновении ацетилена с медью и серебром образуются ацетилениды меди и серебра, которые взрываются при ударе или повышении температуры. Поэтому при хранении ацетилена не используются материалы, содержащие медь (например, вентили баллонов).
Ацетилен обладает незначительным токсическим действием. Для ацетилена нормирован ПДКм.р. = ПДК с.с. = 1,5 мг/м³ согласно гигиеническим нормативам ГН 2.1.6.1338-03 «Предельно допустимые концентрации (ПДК) загрязняющих веществ в атмосферном воздухе населённых мест».
ПДКр.з. (рабочей зоны) не установлен (по ГОСТ 5457-75 и ГН 2.2.5.1314-03), так как концентрационные пределы распределения пламени в смеси с воздухом составляет 2,5—100 %.
Хранят и перевозят ацетилен в заполненных инертной пористой массой (например, древесным углём) стальных баллонах белого цвета с красной надписью «АЦЕТИЛЕН» в виде раствора в ацетоне. Баллон ёмкостью 40 л под давлением 15—16 кгс/см2 вмещает около 5000 л газообразного ацетилена (взятого при нормальном атмосферном давлении).
Примечания
[править | править код]- ↑ ГОСТ 5457-75. Ацетилен растворённый и газообразный технический. Технические условия. Дата обращения: 8 февраля 2012. Архивировано 19 июля 2017 года.
- ↑ 1 2 3 4 http://www.cdc.gov/niosh/npg/npgd0008.html
- ↑ 1 2 David R. Lide, Jr. Basic laboratory and industrial chemicals (англ.): A CRC quick reference handbook — CRC Press, 1993. — ISBN 978-0-8493-4498-5
- ↑ Словарь иностранных слов. — М.: «Русский язык», 1989. — 624 с. ISBN 5-200-00408-8
- ↑ Acetylene - New World Encyclopedia. www.newworldencyclopedia.org. Дата обращения: 9 июля 2023. Архивировано 9 июля 2023 года.
- ↑ Корольченко. Пожаровзрывоопасность веществ, 2004, с. 198.
- ↑ Миллер. Ацетилен, его свойства, получение и применение, 1969, с. 72.
- ↑ 1 2 Хвостов, 1988.
- ↑ Большая энциклопедия нефти и газа. Неприятный запах — ацетилен. Дата обращения: 10 октября 2013. Архивировано 29 октября 2013 года.
- ↑ Ацетилен. Дата обращения: 10 октября 2013. Архивировано из оригинала 1 октября 2013 года.
- ↑ Видео данного процесса. Дата обращения: 29 сентября 2017. Архивировано 16 ноября 2015 года.
- ↑ Лапидус А. Л., Голубева И. А., Жагфаров Ф. Г. Газохимия. Учебное пособие. — М.: ЦентрЛитНефтеГаз, 2008. — 450 с. — ISBN 978-5-902665-31-1.
- ↑ В России разработали ракетный двигатель на аммиаке — Известия. Дата обращения: 7 мая 2012. Архивировано 7 мая 2012 года.
Литература
[править | править код]- Миллер С. А. Ацетилен, его свойства, получение и применение. — Л.: Химия, 1969. — Т. 1. — 680 с.
- Корольченко А. Я., Корольченко Д. А. Пожаровзрывоопасность веществ и материалов и средства их тушения. Справочник: в 2-х частях. Часть 1. — М.: Ассоциация «Пожнаука», 2004. — 713 с. — ISBN 5-901283-02-3.
- Хвостов И. В. Ацетилен // Химическая энциклопедия : в 5 т. / Гл. ред. И. Л. Кнунянц. — М.: Советская энциклопедия, 1988. — Т. 1: А — Дарзана. — С. 226—228. — 623 с. — 100 000 экз. — ISBN 5-85270-008-8.
Ссылки
[править | править код]- Ацетилен // Энциклопедический словарь Брокгауза и Ефрона : в 86 т. (82 т. и 4 доп.). — СПб., 1890—1907.