Реакция Дёбнера — Миллера

Реакция Дёбнера — Миллера (синтез Дёбнера — Миллера) — именная химическая реакция, метод получения производных хинолина циклоконденсацией ароматических аминов, у которых свободно орто-положение, с альдегидами и кетонами в присутствии конденсирующего агента, в роли которого обычно выступает соляная кислота или хлорид цинка, присутствующие в растворе. Открыта в 1881 году немецкими химиками О. Дёбнером и В. Миллером[1]. Механизм реакции подобен механизму реакции Скраупа.
Механизм
[править | править код]
Приведён механизм реакции на примере анилина и ненасыщенного альдегида.
В начале реакции аминогруппа анилина (1) атакует двойную углерод-углеродную связь (2), осуществляя сопряжённое присоединение. Это приводит к образованию енолята (3). Протон водорода отщепляется от аминогруппы, переходя к кислороду енольной группы (4). После этого в результате кето-енольной таутомерии образуется кетон (5). Под действием ионов водорода, находящихся в растворе, атомы кислорода и азота протонируются, образуя неустойчивый ион (6), который в результате внутримолекулярного электрофильного присоединения образует соединение, содержащее два цикла (7). Оно отщепляет протон, таким образом переходя в более стабильную форму существования (8). Затем при нагревании происходит дегидратация полученного соединения, образование новой двойной связи (9). Завершает реакцию окисление полученного вещества с образованием производного хинолина (10). В качестве окислителя может быть использован элементарный иод, кислород воздуха или основание Шиффа, которое непременно образуется в реакционной смеси в результате взаимодействия ароматического амина и карбонильного соединения, если протекание этой побочной реакции допустимо в данных конкретных условиях проведения синтеза[2][3].
Механизм реакции Дёбнера — Миллера близок к механизму реакции Скраупа. Однако, в отличие от него, ненасыщенные карбонильные соединения в рассматриваемом синтезе образуются другим способом. Их могут добавить сразу в реакционную смесь или синтезировать непосредственно в ней методом кротоновой конденсации, имея изначально насыщенный альдегид или кетон[4]. Здесь большую роль играют конденсирующие агенты, которые и осуществляют протекание данного процесса. В качестве них используют хлорид цинка, соляную или серную кислоту[4]. Также они участвуют в предпоследней стадии реакции Дёбнера-Миллера, облегчая дегидратацию соединения 8, особенно если кислоты концентрированные.
Модификации
[править | править код]К. Бейером в 1886 году была предложена модификация рассматриваемой реакции. Она подразумевает получение 2,4-дизамещённых хинолинов взаимодействием смеси альдегида и метилкетона с ароматическим амином. В реакционной смеси альдегид и метилкетон реагируют с образованием ненасыщенных карбонильных соединений, которые и вступают в реакцию с ароматическим амином, давая необходимый продукт[5].

Для получения 2,4-дизамещённых производных хинолина предлагается использовать пировиноградную кислоту в качестве метилкетона[4], а альдегид оставить неизменным. Однако производные хинолина образуется лишь в случае использования ароматического альдегида, тогда как в присутствии алифатического альдегида образуются производные пирролидона ввиду другого механизма протекания рассматриваемой реакции[5].
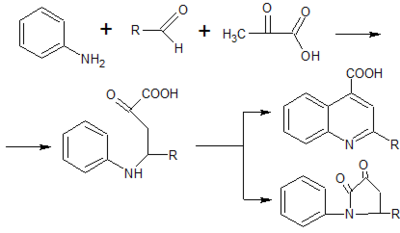
Примечания
[править | править код]- ↑ Нейланд, 1990, с. 697.
- ↑ Ли, 2006, с. 123, 317.
- ↑ Джилкрист, 1996, с. 187.
- ↑ 1 2 3 Кнунянц и др., 1990, с. 8.
- ↑ 1 2 Кнунянц и др., 1990, с. 9.
Литература
[править | править код]- Химическая энциклопедия / Редкол.: Кнунянц И.Л. и др.. — М.: Советская энциклопедия, 1990. — Т. 2. — 673 с. — ISBN 5-85270-035-5.
- Дж.Дж. Ли. Именные реакции. Механизмы органических реакций. — М.: Бином. Лаборатория знаний, 2006. — 456 с. — ISBN 5-94774-368-X.
- Нейланд О.Я. Органическая химия. — М.: Высшая школа, 1990. — 751 с. — ISBN 5-06-001471-1.
- Джилкрист Т. Химия гетероциклических соединений / под ред. М.А. Юровской. — М.: Мир, 1996. — 464 с. — ISBN 5-03-003103-0.
На эту статью не ссылаются другие статьи Википедии. |