Дендротоксин: различия между версиями
| [непроверенная версия] | [непроверенная версия] |
дополнение, источники |
дополнение |
||
| Строка 17: | Строка 17: | ||
=== Биологически важные радикалы === |
=== Биологически важные радикалы === |
||
== Использование в исследованиях == |
== Использование в исследованиях == |
||
Калиевые каналы нейронов [[Позвоночные|позвоночных]] имеют множество разновидностей, позволяющих им подстраивать свойства их электрических сигналов проявлением различных комбинаций подгрупп калиевых каналов. |
|||
== Примечания == |
== Примечания == |
||
{{примечания}} |
{{примечания}} |
||
Версия от 07:33, 8 июня 2015
Дендротоксины — класс пресинаптических нейротоксинов, вырабатываемых змеями рода мамба и блокирующих определённые подтипы потенциалзависимых калиевых каналов в нейронах, тем самым повышая высвобождение ацетилхолина в нервно-мышечных синапсах. Благодаря высокой эффективности и селективности для калиевых каналов, дендротоксины оказались чрезвычайно полезными в качестве фармакологических средств для изучения структуры и функции этих белков ионных каналов.
Функциональные эффекты в нервной системе
Дендротоксины показали способность к блокированию определённых подтипов потенциалзависимых каналов калия (K+) в ткани нейронов. В нервной системе K+ каналы контролируют возбудимость нервов и мышц, контролируя мембранный потенциал покоя и реполяризируя мембрану во время потенциалов действия. Дендротоксин, как было показано, связывает узлы Ранвье мотонейронов[1] и блокирует активность калиевых каналов. Таким образом, дендротоксины продлевают продолжительность потенциалов действия и увеличивают высвобождение ацетилхолина в нервно-мышечном соединении, которое может привести к мышечной перевозбудимости и судорогам.
Структура дендротоксинов
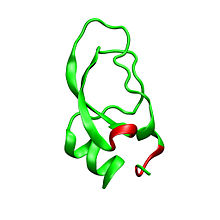
Дендротоксины являются ~ 7kDa белками, состоящими из одной пептидной цепи из приблизительно 57-60 аминокислот. Были выделены несколько гомологов альфа-дендротоксина, все обладающие несколько иной последовательностью. Тем не менее, молекулярная архитектура и складная конформация этих белков очень похожи. Дендротоксины обладают очень короткой 310-спиралью вблизи N-конца пептида, в то время как два оборота альфа-спирали происходит вблизи С-конца. Двунитевой антипараллельный β-лист занимает центральную часть молекулярной структуры. Эти две β-нити соединены искаженной областью β-оборота[2], что, предположительно, играет важную роль в активности связывания белка. Все дендротоксины сшиты тремя дисульфидными связями, которые добавляют стабильность белку и в значительной степени способствует её структурной конформации. Радикалы цистеина, образующие эти дисульфидные связи были законсервированы среди всех членов семейства дендротоксинов, и расположены в C7-C57, С16-С40, и С32-С53 (нумерация согласно альфа-дендротоксинам).
Дендротоксины структурно гомологичны ингибиторам серпиновых протеаз (ИСП), в том числе апротинину. Было показано, что последовательности альфа-дендротоксина и ИСП идентичны на 35% и имеют идентичные дисульфидные связи. Несмотря на структурную гомологию между этими двумя белками, дендротоксины не показывают никакого ощутимо ингибирующего действия, в отличие от ИСП. Эта потеря активности возможно является результатом отсутствия ключевых аминокислотных радикалов, которые производят структурные различия, препятствующие ключевым взаимодействиям, необходимым для активности ИСП.
Дендротоксины – основные белки, имеющие положительный заряд при нейтральном pH. Большинство положительно заряженных радикалов аминокислот находятся в нижней части структуры, создавая катионную область в одной части белка. Положительный заряд исходит от радикалов лизина(Lys) и аргинина(Arg), которые сконцентрированы на трёх основных участках: вблизи N-конца (Arg3, Arg4, Lys5), вблизи C-конца (Arg54, Arg55) и узкой области β-оборота (Lys28, Lys29, Lys30).[3] Полагают, что эти положительно заряженные радикалы могут играть критичную роль в связывающей активности дендротоксинов, так как они могут взаимодействовать с анионными участками (отрицательно заряженными аминокислотами) в порах калиевых каналов.
Биологическая активность
Механизм действия
Одна молекула дендротоксина обратимо связывается с калиевым каналом для того, чтобы оказать ингибирующий эффект. Предполагается что это взаимодействие инициируется электростатическими взаимодействиями между положительно заряженными радикалами аминокислот в катионной области дендротоксина и отрицательно заряженными радикалами в порах ионных каналов. Калиевые каналы, как и другие катионно-избирательные каналы, предположительно имеют облако отрицательных зарядов, находящихся перед входным отверстием в пору канала, которое помогает проводить ионы калия по пути проникновения. Обычно считается (но не доказано), что молекулы дендротоксина связываются с анионными связями вблизи внеклеточной поверхности канала и физически закрывают пору, тем самым предотвращая проведение ионов. Однако, Имреди и МакКиннон[4] предположили, что дельта-дендротоксин может иметь отклонённое от центра место связывания на целевых белках, и может ингибировать канал путём изменения его структуры, а не физического блокирования пор.
Биологически важные радикалы
Использование в исследованиях
Калиевые каналы нейронов позвоночных имеют множество разновидностей, позволяющих им подстраивать свойства их электрических сигналов проявлением различных комбинаций подгрупп калиевых каналов.
Примечания
- ↑ Gasparini S, Danse J-M, Licoq A, Pinkasfeld S, Zinn-Justin S, Young LC, C.L. de Medeiros C, Rowan EG, Harvey AL, and Me’nez A (1998). Delineation of the Functional Site of alpha-dendrotoxin: The functional topographies of dendrotoxins are different but share a conserved core with those of other KV1 potassium channel-blocking toxins. J Biol Chem 273:25393-25403
- ↑ Katoh E, Nishio H, Inui T, Nishiuchi Y, Kimura T, Sakakibara S, Yamazaki T (2000). Structural Basis for the Biological Activity of Dendrotoxin-I, a Potent Potassium Channel Blocker. Biopolymers 54:44-57
- ↑ Swaminathan P, Hariharan M, Murali R, Singh CU (1996). Molecular Structure, Conformational Analysis, and Structure-Activity Studies of Dendrotoxin and Its Homologues Using Molecular Mechanics and Molecular Dynamics Techniques. J Med Chem. 39:2141-2155
- ↑ Imredy JP, and MacKinnon R (2000). Energetic and Structural Interactions between delta-Dendrotoxin and a Voltage-gated Potassium Channel. J. Mol. Biol. 296:1283-1294
Эта статья или раздел содержит незавершённый перевод с английского языка. |