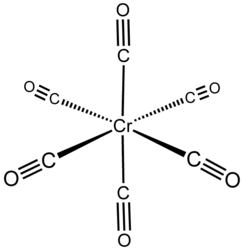
Гексакарбонил хрома
Перейти к навигации
Перейти к поиску
| Гексакарбонил хрома | |
|---|---|
 | |
| Общие | |
| Систематическое наименование |
Гексакарбонил хрома |
| Традиционные названия | Гексакарбонилхром |
| Хим. формула | Сr(CO)6 |
| Физические свойства | |
| Состояние | бесцветные (белые) кристаллы |
| Молярная масса | 220,06 г/моль |
| Плотность | 1,77 г/см³ |
| Термические свойства | |
| Температура | |
| • плавления | 149; 153; 154,5 °C |
| • кипения | возг. °C |
| Мол. теплоёмк. | 240 Дж/(моль·К) |
| Энтальпия | |
| • образования | -1077 кДж/моль |
| Классификация | |
| Рег. номер CAS | 13007-92-6 |
| PubChem | 518677 |
| Рег. номер EINECS | 235-852-4 |
| SMILES | |
| InChI | |
| RTECS | GB5075000 |
| ChEBI | 33031 |
| ChemSpider | 23855 и 21171163 |
| Безопасность | |
| NFPA 704 | |
| Приведены данные для стандартных условий (25 °C, 100 кПа), если не указано иное. | |
Гексакарбонил хрома — неорганическое соединение, карбонильный комплекс хрома состава Сr(CO)6. Бесцветные кристаллы, не растворяется в воде, медленно разлагается на свету.
Получение[править | править код]
- Восстановление раствора хлорида хрома(III) в бензоле алюминием в атмосфере монооксида углерода:
Физические свойства[править | править код]
Гексакарбонил хрома образует диамагнитные бесцветные (белые) кристаллы ромбической сингонии, пространственная группа P nma, параметры ячейки a = 1,1769 нм, b = 1,1092 нм, c = 0,6332 нм, Z = 4.
Не растворяется в воде и метаноле, слабо растворяется в этаноле, бензоле, диэтиловом эфире. Растворяется в тетрахлорметане, хлороформе.
Медленно разлагается на свету. Быстро разлагается при температурах 130-150°С и разлагается со взрывом при 210°С.
Плавится при ≈150°С в запаянной трубке.
Химические свойства[править | править код]
- Разлагается при нагревании:
- Окисляется концентрированной азотной кислотой:
- Окисляется кислородом:
- Медленно реагирует с хлором:
- Реагирует с металлическим натрием в жидком аммиаке с образованием пентакарбонилхромата натрия:
- Реагирует с растворами щелочей:
Применение[править | править код]
- Для получения хромовых покрытий.
- В качестве катализатора.
Литература[править | править код]
- Химическая энциклопедия / Редкол.: Зефиров Н.С. и др.. — М.: Большая Российская энциклопедия, 1998. — Т. 5. — 783 с. — ISBN 5-85270-310-9.
- Справочник химика / Редкол.: Никольский Б.П. и др.. — 2-е изд., испр. — М.—Л.: Химия, 1966. — Т. 1. — 1072 с.
- Справочник химика / Редкол.: Никольский Б.П. и др.. — 3-е изд., испр. — Л.: Химия, 1971. — Т. 2. — 1168 с.
- Лидин Р.А. и др. Химические свойства неорганических веществ: Учеб. пособие для вузов. — 3-е изд., испр. — М.: Химия, 2000. — 480 с. — ISBN 5-7245-1163-0.
- Рипан Р., Четяну И. Неорганическая химия. Химия металлов. — М.: Мир, 1972. — Т. 2. — 871 с.
Это заготовка статьи о неорганическом веществе. Помогите Википедии, дополнив её. |






![{\displaystyle {\mathsf {Cr(CO)_{6}+2Na\ {\xrightarrow {-40^{o}C}}\ Na_{2}[Cr(CO)_{5}]+CO\uparrow }}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/f999e5d1e217761ec2b36af5cef78308f0ec8699)
![{\displaystyle {\mathsf {Cr(CO)_{6}+KOH\ {\xrightarrow {}}\ K[Cr(CO)_{5}H]+CO_{2}\uparrow }}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/b42fc4b62e6a613a2d8a1d954fecca0cb9a729f5)