Кристаллический фиолетовый
| Кристаллический фиолетовый | |||
|---|---|---|---|
 | |||
| |||
| Общие | |||
| Хим. формула | C25N3H30Cl | ||
| Физические свойства | |||
| Молярная масса | 407,99 г/моль | ||
| Термические свойства | |||
| Температура | |||
| • разложения | 215 °C | ||
| Химические свойства | |||
| Растворимость | |||
| • в воде | плохо растворим | ||
| Классификация | |||
| Рег. номер CAS | 548-62-9 | ||
| PubChem | 11057 и 23424024 | ||
| Рег. номер EINECS | 208-953-6 | ||
| SMILES | |||
| InChI | |||
| RTECS | BO9000000 | ||
| ChEBI | 41688 | ||
| Номер ООН | 3077 | ||
| ChemSpider | 10588 | ||
| Приведены данные для стандартных условий (25 °C, 100 кПа), если не указано иное. | |||
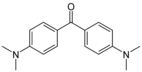
Кристалли́ческий фиоле́товый (N,N,N′,N′,N′′,N′′-гексаметилпарарозанилин хлорид) — органическое соединение, основный трифенилметановый краситель с химической формулой C25H30N3Cl, одна из форм метилового фиолетового. Имеет вид блестящих зелёных кристаллов, применяется в качестве кислотно-основного индикатора и для различных окрасок препаратов в биологии.
Синонимы: метиловый фиолетовый 10B, гексаметиловый фиолетовый, кристаллвиолет, C. I. 42555[1][2].
Свойства
[править | править код]Зелёные кристаллы с бронзовым блеском, имеют синеватый отлив в безводной форме. Молярная масса составляет 407,99 г/моль. Разлагается при температуре 215 °C. Хорошо растворим в спирте, растворим в хлороформе и глицерине, плохо растворим в воде, нерастворим в эфире. Водные растворы имеют фиолетовый цвет, при добавлении соляной кислоты происходит их обесцвечивание. Добавление едкого натра к раствору красителя вызывает выпадение фиолетового осадка[1][2].
Образует кристаллогидрат состава C25H30N3Cl·9H2O, имеющий молярную массу 570,12 г/моль[1].
Получение
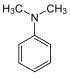
[править | править код]Синтезируют из диметиланилина и кетона Михлера с оксихлоридом фосфора. В процессе реакции образуется промежуточное основание красителя[3]:
Основание отделяют от исходных реагентов, подщелачивают и кипятят несколько раз в слабом растворе соляной кислоты до растворения, затем из растворов осаживают хлоридом натрия[3]:
Общее время лабораторного получения и очистки составляет порядка двух дней с выходом 67—81 %[3].
Применение
[править | править код]  |
| Кристаллический фиолетовый | |
|---|---|
| (pH индикатор) | |
| Нижний предел | Верхний предел |
| pH 0,8 | pH 2,6 |
| green | blue |
В бактериологии применяется в методе окрашивания по Граму для выявления грамоположительных бактерий, также используется в других методиках окрашивания, например в составе раствора Ниссера, окрашивающего дифтерийные палочки и в красителе Вейгерта, применяющемся в гистологии для окраски эластичных тканей[1].
В аналитической химии находит применение как кислотно-основный индикатор. Раствор меняет свою окраску из зелёной в синюю в диапазоне pH 0,8—2,6. Также используется как титриметрический реактив для определения вольфрама, ртути, цинка и цветных реакций на ионы кадмия, сурьмы, таллия, золота и других элементов, образующих комплексы с красителем[1][2].
Производным кристаллического фиолетового является краситель метиловый зелёный[4].
Примечания
[править | править код]- ↑ 1 2 3 4 5 Фрайштат, 1980, с. 197—198.
- ↑ 1 2 3 Чернышова, 1990.
- ↑ 1 2 3 Родионов, 1948, с. 146—147.
- ↑ Метиловый зелёный // Большая медицинская энциклопедия : в 30 т. / гл. ред. Б. В. Петровский. — 3-е изд. — М. : Советская энциклопедия, 1981. — Т. 15 : Меланома — Мудров. — 576 с. : ил.
Литература
[править | править код]- Каррер П. Курс органической химии. — Л.: Государственное научно-техническое издательство химической литературы, 1960.
- Родионов В. М., Богословский Б. М., Федорова А. М. Лабораторное руководство по химии промежуточных продуктов и красителей / под ред. Родионова В. М.. — М., —Л.: Государственное научно-техническое издательство химической литературы, 1948.
- Фрайштат Д. М. Реактивы и препараты для микроскопии. — М.: Химия, 1980. — 480 с.
- Чернышова Т. В. Кристаллический фиолетовый // Химическая энциклопедия : в 5 т. / Гл. ред. И. Л. Кнунянц. — М.: Советская энциклопедия, 1990. — Т. 2: Даффа — Меди. — С. 533. — 671 с. — 100 000 экз. — ISBN 5-85270-035-5.





![{\displaystyle {\ce {->[+{\ce {HCl}}][-{\ce {H2O}}]}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/c49d3a5caf1cf57ed0db6245fd066c444c11f146)
