3D-культура клеток
3D-культура клеток — это искусственно созданная среда, в которой биологические клетки способны расти или взаимодействовать с окружающей средой во всех трех измерениях. В отличие от 2D-сред (чашка Петри), 3D-культура клеток позволяет клеткам in vitro расти во всех направлениях, подобно тому, как это происходит in vivo[1]. Трехмерные культуры обычно выращивают в биореакторах, небольших капсулах, в которых клетки могут превращаться в сфероиды, или в трехмерные клеточные колонии. В одном биореакторе обычно культивируют около 300 сфероидов[1].
3D-культивирование клеток также может быть выполнено на микрофлюидных устройствах, таких как Organoplate®[2], посредством которых создаются перфузируемые трехмерные ткани, а также на устройствах с подвесными каплями для создания трехмерных сфероидов.
История[править | править код]
3D-культуры клеток используются в исследованиях уже несколько десятилетий[3]. Один из первых зарегистрированных подходов к их разработке был сделан в начале 20-го века, когда Алексис Каррел разработал методы длительного культивирования тканей in vitro[4]. Ранние исследования 80-х годов, проведенные Миной Бисселл из Национальной лаборатории Лоуренса в Беркли, подчеркнули важность 3D-методов для создания точных моделей культивирования in vitro. Работа была сосредоточена на изучении важности внеклеточного матрикса и способности культур в искусственных 3D-матрицах производить физиологически значимые многоклеточные структуры, такие как ацинарные структуры в моделях здоровой и раковой ткани молочной железы. Данные методы были применены к моделям заболеваний in vitro, используемым для оценки клеточных ответов на фармацевтические соединения[5].
Эрик Саймон в отчете о гранте NIH SBIR 1988 года показал, что электропрядение можно использовать для производства нано- и субмикронных волокнистых матов из полистирола и поликарбоната (теперь известных как каркасы (scaffolds)), специально предназначенных для использования в качестве клеточных субстратов in vitro. Ранние использования электроформованных волокнистых решеток для клеточной культуры и тканевой инженерии показало, что различные типы клеток, включая фибробласты крайней плоти человека (HFF), трансформированную карциному человека (HEp-2) и эпителий легких норки (MLE), будут прилипать к волокнам и размножаться на них. Было отмечено, что в отличие от уплощенной морфологии, обычно наблюдаемой в 2D-культуре, клетки, выращенные на волокнах электропрядения, демонстрировали более гистотипическую округлую трехмерную морфологию, обычно наблюдаемую in vivo[6].
Характеристики[править | править код]
В живой ткани клетки существуют в трехмерном микроокружении со сложными межклеточными взаимодействиями и межклеточными взаимодействиями, а также со сложной динамикой транспорта питательных веществ и клеток[7][8][9][10][11][12][13][14][15]. Стандартные двумерные или однослойные клеточные культуры не являются адекватным представлением этой среды, что часто делает их ненадежными для прогнозирования эффективности и токсичности лекарств in vivo[16][13]. 3D-сфероиды больше напоминают ткани in vivo с точки зрения клеточной коммуникации и развития внеклеточных матриксов[1]. Эти матрицы помогают клеткам двигаться внутри своего сфероида аналогично тому, как клетки перемещаются в живой ткани[9]. Таким образом, сфероиды представляют собой улучшенные модели клеточной миграции, дифференциации, выживания и роста[14]. Кроме того, 3D-культуры клеток обеспечивают более точное изображение поляризации клеток, поскольку в 2D-режиме клетки могут быть поляризованы лишь частично[9]. Более того, клетки, выращенные в 3D, демонстрируют иную экспрессию генов, чем клетки, выращенные в 2D[9].
Третье измерение клеточного роста обеспечивает больше контактного пространства для механических воздействий и клеточной адгезии, что необходимо для лигирования интегрина, сокращения клеток и даже внутриклеточной передачи сигналов[17][18]. Нормальная диффузия растворенных веществ и связывание с эффекторными белками (такими как факторы роста и ферменты) также зависят от трехмерного клеточного матрикса, поэтому это имеет решающее значение для установления градиентов концентрации растворенных веществ в тканевом масштабе[19][20].
Для целей токсикологического скрининга лекарств гораздо полезнее тестировать экспрессию генов в клетках in vitro, выращенных в 3D, чем в 2D, поскольку экспрессия генов в 3D-сфероидах будет больше напоминать экспрессию генов in vivo. 3D-культуры клеток также обладают большей стабильностью и продолжительностью жизни, чем клеточные культуры в 2D[21]. Это означает, что они больше подходят для долгосрочных исследований и для демонстрации долгосрочных эффектов препарата. Трехмерная среда также позволяет клеткам беспрепятственно расти. В 2D клетки должны подвергаться регулярной трипсинизации, чтобы обеспечить их достаточным количеством питательных веществ для нормального роста клеток[22]. 3D-сфероиды культивировались в лабораторных условиях в течение 302 дней, сохраняя при этом здоровый, нераковый рост[21].
В междисциплинарных исследованиях в области биологии и аэрокосмической промышленности 3D-печатные каркасы также используются для защиты клеток от воздействия гравитации во время запуска[23].
Классификация методов 3D-культуры[править | править код]
Существует большое количество коммерчески доступных инструментов для культивирования, которые утверждают, что обеспечивают преимущества 3D-культивирования клеток. В общем, платформы можно разделить на два типа методов 3D-культивирования: методы с каркасами и методы без каркасов .
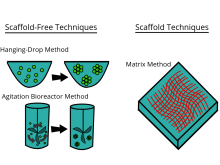
Каркасные методы[править | править код]
Методы создания каркасов включают использование твердых каркасов, гидрогелей и других материалов. В недавнем исследовании возможности стволовых клеток CD34+ человека изучались путем создания 3D-модели в агарозном геле in vitro для понимания процесса окостенения костей[24]. Каркасы можно использовать для создания 3D-модели микроткани путем культивирования фибробластов вне опухолевых клеток, имитируя взаимодействие стромы опухоли[25].
Гидрогели[править | править код]
Поскольку естественный внеклеточный матрикс (ECM) важен для выживания, пролиферации, дифференциации и миграции клеток, различные гидрогелевые матрицы, имитирующие естественную структуру ECM, рассматриваются как потенциальные подходы к культивированию клеток, подобному in vivo[26][27][28]. Гидрогели состоят из взаимосвязанных пор с высокой степенью удержания воды, что обеспечивает эффективный транспорт, например, питательных веществ и газов. Для 3D-культуры клеток доступно несколько различных типов гидрогелей из природных и синтетических материалов, включая, например, гидрогели экстракта ЕСМ животных, белковые гидрогели, пептидные гидрогели, полимерные гидрогели и гидрогель наноцеллюлозы на основе древесины.
Безкаркасные методы[править | править код]
Сфероиды[править | править код]

Сфероид — это тип трехмерного клеточного моделирования, который лучше имитирует условия окружающей среды живой клетки по сравнению с двумерной клеточной моделью, в частности, реакции между клетками и реакции между клетками и матриксом[30]. Сфероиды полезны при изучении изменения физиологических характеристик клеток[31], различий в строении здоровых клеток и опухолевых клеток, а также изменений, которым подвергаются клетки при формировании опухоли[32]. Сфероиды, культивированные совместно с опухолевыми и здоровыми клетками, использовались для моделирования взаимодействия раковых клеток с нормальными клетками[33]. Сфероиды также можно культивировать совместно с фибробластами, чтобы имитировать взаимодействие опухоли и стромы[34]. Сфероиды можно выращивать несколькими различными методами. Одним из распространенных методов является использование планшетов с низкой клеточной адгезией, обычно 96-луночных планшетов, для массового производства сфероидных культур, где агрегаты образуются на закругленном дне клеточных планшетов[29][35]. Сфероиды также можно культивировать методом висячей капли[36], заключающимся в формировании клеточных агрегатов в каплях, свисающих с поверхности клеточной пластинки[30]. Другие исследуемые методы включают использование биореакторов с вращающимися стенками сосудов, которые вращают и культивируют клетки, когда они постоянно находятся в свободном падении, и образуют агрегаты в слоях[37]. Недавно некоторые протоколы были стандартизированы для получения однородных и надежных сфероидов[38]. Исследователи также изучили стандартизированные, экономичные и воспроизводимые методы трехмерной культуры клеток[39]. Чтобы улучшить воспроизводимость и прозрачность экспериментов со сфероидами, международный консорциум разработал MISpheroID (Минимальная информация в идентификации сфероидов)[40].
Кластероиды[править | править код]
Кластероид — это тип трехмерного моделирования клеток, похожий на сфероид, но отличающийся методом создания; их выращивают в виде кластеров клеток в водной двухфазной системе эмульсии Пикеринга «вода в воде», используя межфазное натяжение и осмотическую усадку для упаковки клеток в плотные кластеры, которые затем культивируют в гидрогеле в тканях или органоидах[41][42].
Биореакторы[править | править код]
Биореакторы, используемые для 3D-культур клеток, представляют собой небольшие пластиковые цилиндрические камеры, специально разработанные для выращивания клеток в трех измерениях. В биореакторе используются биоактивные синтетические материалы, такие как мембраны из полиэтилентерефталата, для окружения сфероидных клеток в среде, поддерживающей высокий уровень питательных веществ[43][44]. Их легко открывать и закрывать, поэтому сфероиды клеток можно вынимать для тестирования, при этом в камере сохраняется 100 % влажность[1]. Эта влажность важна для достижения максимального роста и функционирования клеток. Камера биореактора является частью более крупного устройства, которое вращается, чтобы обеспечить одинаковый рост клеток в каждом направлении в трех измерениях[1].Компания MC2 Biotek разработала биореактор для инкубации прототканей, который использует газообмен для поддержания высокого уровня кислорода в клеточной камере[45]. Данное улучшение обеспечивает более высокий уровень кислорода, что помогает клеткам расти и обеспечивать нормальное клеточное дыхание[14].
Микрогидродинамика[править | править код]
Различные клеточные структуры человеческого тела должны быть васкуляризированы, чтобы получать питательные вещества и газообмен, чтобы выжить. Аналогичным образом, 3D-культуры клеток in vitro требуют определённого уровня циркуляции жидкости, что может быть проблемой для плотных 3D-культур, где не все клетки могут иметь адекватный доступ к питательным веществам. Это особенно важно для культур гепатоцитов, поскольку печень является органом с высокой васкуляризацией. В одном исследовании гепатоциты и сосудистые клетки культивировались вместе на каркасе из коллагенового геля между микрожидкостными каналами, сравнивали рост клеток в статической и проточной средах и показали необходимость в моделях с тканями и микрососудистой сетью[46]. Другое исследование показало, что устройство для совместного культивирования сфероидов на основе висячей капли может быть полезным, генерируя два разных клеточных сфероида в соседних каналах микрожидкостного устройства висячей капли и совместно культивируя сфероиды со сливающимися каплями для мониторинга ангиогенеза, индуцированного опухолью[47].
Высокопроизводительный скрининг[править | править код]
Расширенная разработка 3D-моделей для высокопроизводительного скрининга в форматах высокой плотности в последнее время стала возможной благодаря технологическим достижениям, связанным с увеличением плотности микропланшетов. Их можно найти в форматах с 384 и 1536 лунками, которые отталкивают клетки, экономичны и подходят для полностью автоматизированных платформ скрининга[48]. Два варианта, которые позволяют использовать форматы с 1536 лунками, доступны либо от Greiner Bio-One, использующей магнитную 3D-биопечать m3D[49] либо от Corning Life Sciences, которая включает покрытие поверхности со сверхнизким прилеганием, а также геометрию микрополостей и гравитацию для создания 3D-моделей[50][51]. Благодаря быстрым и доступным методам и технологиям, разработанным для 3D-скрининга, стали доступны параллельные высокопроизводительные подходы скрининга для тестирования изогенных пар мутантов, связанных с онкогенами, по сравнению с дикими типами[52].
Фармакология и токсикология[править | править код]
Основная цель выращивания клеток в 3D-каркасах и в виде 3D-клеточных сфероидов in vitro — проверить фармакокинетические и фармакодинамические эффекты лекарств и наноматериалов в доклинических испытаниях[14][53][54][55][56]. Токсикологические исследования показали, что 3D-культуры клеток почти не уступают исследованиям in vivo с целью проверки токсичности лекарственных соединений. При сравнении значений LD50 для 6 распространенных препаратов: ацетаминофена, амиодарона, диклофенака, метформина, фенформина и вальпроевой кислоты значения 3D-сфероидов напрямую коррелировали с показателями исследований in vivo[57]. Хотя 2D-культуры клеток ранее использовались для проверки токсичности наряду с исследованиями in vivo, 3D-сфероиды лучше подходят для тестирования токсичности при хроническом воздействии из-за их большей продолжительности жизни[58]. Матрица в 3D-сфероидах заставляет клетки поддерживать актиновые нити и более физиологически важна для организации цитоскелета, а также полярности и формы клеток человека[59]. Трехмерное расположение позволяет культурам создать модель, которая более точно напоминает человеческую ткань in vivo, без использования подопытных животных[60].
Критика[править | править код]
Существующие 3D-методы не лишены ограничений, включая масштабируемость, воспроизводимость, чувствительность и совместимость с инструментами высокопроизводительного скрининга (HTS). HTS на основе клеток основан на быстром определении клеточного ответа на взаимодействие лекарственного средства, такого как дозозависимая жизнеспособность клеток, взаимодействие клетка-клетка/клетка-матрица и/или миграция клеток, но доступные анализы не оптимизированы для трехмерного культивирования клеток. Ещё одна проблема, с которой сталкивается 3D-культивирование клеток — это ограниченное количество данных и публикаций, посвященных механизмам и корреляциям взаимодействия лекарств, дифференциации клеток и передачи сигналов клетками в этих 3D-средах. Ни один из 3D-методов ещё не заменил 2D-культивирование в больших масштабах, в том числе в процессе разработки лекарств; хотя количество публикаций по 3D-культуре клеток быстро растет, текущие ограниченные биохимические характеристики 3D-тканей уменьшают внедрение новых методов.
Существуют также проблемы с использованием сфероидов в качестве модели раковой ткани. Несмотря на то, что опухолевые сфероиды полезны для 3D-культуры тканей, их критиковали за то, что ими сложно или невозможно «манипулировать градиентами растворимых молекул в [3D-сфероидных] конструкциях и характеризовать клетки в этих сложных градиентах», в отличие от 3D-культуры клеток на бумажной подложке для биоанализы на основе тканей, исследованные Ratmir et al.[44]. Дополнительные проблемы, связанные со сложными методами 3D-культуры клеток, включают: визуализацию из-за больших размеров каркаса и несовместимости со многими флуоресцентными микроскопами, проточную цитометрию, поскольку она требует диссоциации сфероидов в суспензию отдельных клеток, и автоматизацию обработки жидкостей[61].
См. также[править | править код]
- Культура клеток
- Гидрогель
- Линия клеток почек собак Мадина-Дарби
- Микрофизиометрия
- Выращивание органоидов
Источники[править | править код]
- ↑ 1 2 3 4 5 Fey, Stephen. Determination of Acute Lethal and Chronic Lethal Thresholds of Valproic Acid Using 3D Spheroids Constructed From the Immortal Human Hepatocyte Cell Line HEPG2/C3A // Valproic Acid / Stephen Fey, Krzysztof Wrzesinski. — Nova Science Publishers, Inc., 2013. — P. 141–165. — ISBN 978-1-62417-952-5.
- ↑ Our Technology (англ.). www.mimetas.com. Дата обращения: 1 апреля 2022. Архивировано 16 мая 2022 года.
- ↑ Mapanao, Ana Katrina (June 2020). "Three-dimensional tumor models: Promoting breakthroughs in nanotheranostics translational research". Applied Materials Today. 19: 100552. doi:10.1016/j.apmt.2019.100552.
- ↑ "On the Permannet Life of Tissues Outside of the Organisms". The Journal of Experimental Medicine. 15 (5): 516—28. May 1912. doi:10.1084/jem.15.5.516. PMID 19867545.
- ↑ MERIT Award Recipient: Mina J. Bissell, Ph.D. (n.d.). Retrieved 16 June 2016, from http://www.cancer.gov/research/nci-role/spotlight/merit/Bissell Архивировано {{{2}}}.
- ↑ Simon. NIH Phase I Final Report: Fibrous Substrates for Cell Culture (R3RR03544A) (PDF Download Available) (англ.). ResearchGate (1988). Дата обращения: 22 мая 2017.
- ↑ Marx, Vivien (2013-04-11). "A Better Brew" (PDF). Nature. Архивировано из оригинала 31 мая 2016. Дата обращения: 9 июля 2013.
- ↑ "Three-dimensional tissue culture based on magnetic cell levitation". Nature Nanotechnology. 5 (4): 291—6. April 2010. Bibcode:2010NatNa...5..291S. doi:10.1038/nnano.2010.23. PMID 20228788.
- ↑ 1 2 3 4 "The third dimension bridges the gap between cell culture and live tissue". Nature Reviews Molecular Cell Biology. 8 (10): 839—45. October 2007. doi:10.1038/nrm2236. PMID 17684528.
- ↑ "A pericellular collagenase directs the 3-dimensional development of white adipose tissue". Cell. 125 (3): 577—91. May 2006. doi:10.1016/j.cell.2006.02.050. PMID 16678100.
- ↑ "Modeling tissue morphogenesis and cancer in 3D". Cell. 130 (4): 601—10. August 2007. doi:10.1016/j.cell.2007.08.006. PMID 17719539.
- ↑ "Spheroid-based drug screen: considerations and practical approach". Nature Protocols. 4 (3): 309—24. 12 February 2009. doi:10.1038/nprot.2008.226. PMID 19214182.
- ↑ 1 2 "Simplifying the extracellular matrix for 3-D cell culture and tissue engineering: a pragmatic approach". Journal of Cellular Biochemistry. 101 (6): 1370—83. August 2007. doi:10.1002/jcb.21386. PMID 17492655.
- ↑ 1 2 3 4 "Capturing complex 3D tissue physiology in vitro". Nature Reviews Molecular Cell Biology. 7 (3): 211—24. March 2006. doi:10.1038/nrm1858. PMID 16496023.
- ↑ "Three-dimensional cell culture matrices: state of the art" (PDF). Tissue Engineering. Part B, Reviews. 14 (1): 61—86. March 2008. doi:10.1089/teb.2007.0150. PMID 18454635.
- ↑ 3D Cell Culture: A Review of Current Approaches and Techniques // 3D Cell Culture. — 2011. — Vol. 695. — P. 1–15. — ISBN 978-1-60761-983-3. — doi:10.1007/978-1-60761-984-0_1.
- ↑ Building in vitro models of organs // A Survey of Cell Biology. — 2005. — Vol. 244. — P. 137–73. — ISBN 9780123646484. — doi:10.1016/s0074-7696(05)44004-8.
- ↑ "Status and prospects of in vitro tests in risk assessment". Alternatives to Laboratory Animals. 32 (4): 431—5. October 2004. doi:10.1177/026119290403200416. PMID 15651929.
- ↑ "Visualizing muscle cell migration in situ". Current Biology. 10 (10): 576—85. May 2000. doi:10.1016/s0960-9822(00)00486-3. PMID 10837222.
- ↑ "Extracellular matrix-dependent tissue-specific gene expression in mammary epithelial cells requires both physical and biochemical signal transduction". Proceedings of the National Academy of Sciences of the United States of America. 91 (26): 12378—82. December 1994. Bibcode:1994PNAS...9112378R. doi:10.1073/pnas.91.26.12378. PMID 7528920.
- ↑ 1 2 "HepG2/C3A spheroids exhibit stable physiological functionality for at least 24 days after recovering from trypsinisation". Toxicol. Res. 2 (3): 163—172. 2013. doi:10.1039/C3TX20086H.
- ↑ After trypsinisation, 3D spheroids of C3A hepatocytes need 18 days to re-establish similar levels of key physiological functions to those seen in the liver. Дата обращения: 25 ноября 2013. Архивировано из оригинала 2 апреля 2015 года.
- ↑ Han, Y (October 2021). "Molecular genetic analysis of neural stem cells after space flight and simulated microgravity on earth". Biotechnology and Bioengineering. 118 (10): 3832—3846. doi:10.1002/bit.27858. PMID 34125436.
- ↑ "+ stem cells". Molecular Biology Reports. 43 (11): 1233—1242. November 2016. doi:10.1007/s11033-016-4053-4. PMID 27497820.
- ↑ Pednekar, Kunal P. (2021-10-06). "Novel 3D µtissues Mimicking the Fibrotic Stroma in Pancreatic Cancer to Study Cellular Interactions and Stroma-Modulating Therapeutics". Cancers (англ.). 13 (19): 5006. doi:10.3390/cancers13195006. ISSN 2072-6694. PMID 34638490.
{{cite journal}}: Википедия:Обслуживание CS1 (не помеченный открытым DOI) (ссылка) - ↑ "Controlled pattern of cell growth in modulated protein nanocomplexes: Regulating cells spreading in three dimensions". Materials Today. 21 (6): 686—688. 2018. doi:10.1016/j.mattod.2018.06.003.
- ↑ "Hydrogels as extracellular matrix mimics for 3D cell culture". Biotechnology and Bioengineering. 103 (4): 655—63. July 2009. doi:10.1002/bit.22361. PMID 19472329.
- ↑ "Engineering hydrogels as extracellular matrix mimics". Nanomedicine. 5 (3): 469—84. April 2010. doi:10.2217/nnm.10.12. PMID 20394538.
- ↑ 1 2 "The development and characterization of a human mesothelioma in vitro 3D model to investigate immunotoxin therapy". PLOS ONE. 6 (1): e14640. January 2011. Bibcode:2011PLoSO...614640X. doi:10.1371/journal.pone.0014640. PMID 21305058.
{{cite journal}}: Википедия:Обслуживание CS1 (не помеченный открытым DOI) (ссылка) - ↑ 1 2 "Spheroid culture as a tool for creating 3D complex tissues" (PDF). Trends in Biotechnology. 31 (2): 108—15. February 2013. doi:10.1016/j.tibtech.2012.12.003. PMID 23336996.
- ↑ "A multiscale model for avascular tumor growth". Biophysical Journal. 89 (6): 3884—94. December 2005. Bibcode:2005BpJ....89.3884J. doi:10.1529/biophysj.105.060640. PMID 16199495.
- ↑ "Prolonged mammosphere culture of MCF-7 cells induces an EMT and repression of the estrogen receptor by microRNAs". Breast Cancer Research and Treatment. 132 (1): 75—85. February 2012. doi:10.1007/s10549-011-1534-y. PMID 21553120.
- ↑ "A heterologous 3-D coculture model of breast tumor cells and fibroblasts to study tumor-associated fibroblast differentiation". Experimental Cell Research. 266 (1): 74—86. May 2001. doi:10.1006/excr.2001.5210. PMID 11339826.
- ↑ Priwitaningrum, Dwi L. (December 2016). "Tumor stroma-containing 3D spheroid arrays: A tool to study nanoparticle penetration". Journal of Controlled Release (англ.). 244 (Pt B): 257—268. doi:10.1016/j.jconrel.2016.09.004. PMID 27616660. Архивировано из оригинала 15 июня 2022. Дата обращения: 1 октября 2023.
- ↑ "Rapid generation of in vitro multicellular spheroids for the study of monoclonal antibody therapy". Journal of Cancer. 2: 507—14. 2011. doi:10.7150/jca.2.507. PMID 22043235.
- ↑ "High-throughput 3D spheroid culture and drug testing using a 384 hanging drop array". The Analyst. 136 (3): 473—8. February 2011. Bibcode:2011Ana...136..473T. doi:10.1039/c0an00609b. PMID 20967331.
- ↑ "Three-dimensional in vitro tumor models for cancer research and drug evaluation". Biotechnology Advances. 32 (7): 1256—1268. November 2014. doi:10.1016/j.biotechadv.2014.07.009. PMID 25116894.
- ↑ Santi, Melissa (1 July 2020). "Production of 3D tumor models of head and neck squamous cell carcinomas for nanotheranostics assessment". ACS Biomaterials Science & Engineering (англ.). 6 (9): 4862—4869. doi:10.1021/acsbiomaterials.0c00617. ISSN 2373-9878. PMID 33395269.
- ↑ Tan, Loh Teng Hern (2019). "A reliable and affordable 3D tumor spheroid model for natural product drug discovery: A case study of curcumin". Progress in Drug Discovery & Biomedical Science. 2. doi:10.36877/pddbs.a0000017.
- ↑ Peirsman, Arne (2021-11-01). "MISpheroID: a knowledgebase and transparency tool for minimum information in spheroid identity". Nature Methods (англ.). 18 (11): 1294—1303. doi:10.1038/s41592-021-01291-4. ISSN 1548-7105. PMID 34725485.
- ↑ Celik (2019-07-11). "Fabrication of Human Keratinocyte Cell Clusters for Skin Graft Applications by Templating Water-in-Water Pickering Emulsions". Biomimetics (англ.). 4 (3): 50. doi:10.3390/biomimetics4030050. ISSN 2313-7673. PMID 31336810.
{{cite journal}}: Википедия:Обслуживание CS1 (не помеченный открытым DOI) (ссылка) - ↑ Wang, Anheng (2020). "High-throughput fabrication of hepatic cell clusteroids with enhanced growth and functionality for tissue engineering applications". Materials Advances (англ.). 1 (8): 3022—3032. doi:10.1039/D0MA00635A. ISSN 2633-5409.
- ↑ "Synthetic sandwich culture of 3D hepatocyte monolayer". Biomaterials. 29 (3): 290—301. January 2008. doi:10.1016/j.biomaterials.2007.09.016. PMID 17964646.
- ↑ 1 2 "Paper-supported 3D cell culture for tissue-based bioassays". Proceedings of the National Academy of Sciences of the United States of America. 106 (44): 18457—62. November 2009. Bibcode:2009PNAS..10618457D. doi:10.1073/pnas.0910666106. PMID 19846768.
- ↑ Fey, Stephen J. «WO2012022351». European Patent Register.
- ↑ "Transport-mediated angiogenesis in 3D epithelial coculture". FASEB Journal. 23 (7): 2155—64. July 2009. doi:10.1096/fj.08-122820. PMID 19246488.
- ↑ Rodoplu, Didem (2022-03-29). "A microfluidic hanging drop-based spheroid co-culture platform for probing tumor angiogenesis". Lab on a Chip (англ.). 22 (7): 1275—1285. doi:10.1039/D1LC01177D. ISSN 1473-0189. PMID 35191460. Архивировано из оригинала 4 сентября 2023. Дата обращения: 1 октября 2023.
- ↑ Baillargeon, P (2019). "Automating a Magnetic 3D Spheroid Model Technology for High-Throughput Screening". SLAS Technol. 24 (4): 420—428. doi:10.1177/2472630319854337. PMID 31225974.
- ↑ Hou, S (2018). "Advanced Development of Primary Pancreatic Organoid Tumor Models for High-Throughput Phenotypic Drug Screening". SLAS Discov. 23 (6): 574—584. doi:10.1177/2472555218766842. PMID 29673279.
- ↑ Madoux, F (2017). "A 1536-Well 3D Viability Assay to Assess the Cytotoxic Effect of Drugs on Spheroids". SLAS Discov. 22 (5): 516—524. doi:10.1177/2472555216686308. PMID 28346088.
- ↑ Quereda, V (2018). "A Cytotoxic Three-Dimensional-Spheroid, High-Throughput Assay Using Patient-Derived Glioma Stem Cells". SLAS Discov. 23 (8): 842—849. doi:10.1177/2472555218775055. PMID 29750582.
- ↑ Kota, S (2018). "A novel three-dimensional high-throughput screening approach identifies inducers of a mutant KRAS selective lethal phenotype". Oncogene. 37 (32): 4372—4384. doi:10.1038/s41388-018-0257-5. PMID 29743592.
- ↑ "Photothermal effect by NIR-responsive excretable ultrasmall-in-nano architectures". Materials Horizons (англ.). 6 (3): 531—537. 2019. doi:10.1039/C9MH00096H. ISSN 2051-6347.
- ↑ "Endogenously Triggerable Ultrasmall-in-Nano Architectures: Targeting Assessment on 3D Pancreatic Carcinoma Spheroids". ACS Omega. 3 (9): 11796—11801. September 2018. doi:10.1021/acsomega.8b01719. PMID 30320273.
- ↑ Zustiak, Silviya Petrova (February 2016). "Three-dimensional matrix stiffness and adhesive ligands affect cancer cell response to toxins". Biotechnology and Bioengineering. 113 (2): 443—452. doi:10.1002/bit.25709. ISSN 1097-0290. PMID 26184715.
- ↑ (англ.), ISBN 978-1-4939-7677-5
{{citation}}:|title=пропущен или пуст (справка) - ↑ "Determination of drug toxicity using 3D spheroids constructed from an immortal human hepatocyte cell line". Toxicological Sciences. 127 (2): 403—11. June 2012. doi:10.1093/toxsci/kfs122. PMID 22454432.
- ↑ "Multi-cell type human liver microtissues for hepatotoxicity testing". Archives of Toxicology. 87 (1): 209—13. January 2013. doi:10.1007/s00204-012-0968-2. PMID 23143619.
- ↑ "Human embryonic stem cell technologies and drug discovery". Journal of Cellular Physiology. 219 (3): 513—9. June 2009. doi:10.1002/jcp.21732. PMID 19277978.
- ↑ "A novel lab-on-a-chip platform for spheroid metabolism monitoring". Cytotechnology. 70 (1): 375—386. February 2018. doi:10.1007/s10616-017-0152-x. PMID 29032507.
- ↑ "Is It Time to Start Transitioning From 2D to 3D Cell Culture?". Frontiers in Molecular Biosciences (англ.). 7: 33. 2020. doi:10.3389/fmolb.2020.00033. PMID 32211418.
{{cite journal}}: Википедия:Обслуживание CS1 (не помеченный открытым DOI) (ссылка)