Второе начало термодинамики
Второ́е нача́ло термодина́мики (второй закон термодинамики) устанавливает существование энтропии[1] как функции состояния термодинамической системы и вводит понятие абсолютной термодинамической температуры[2], то есть «второе начало представляет собой закон об энтропии»[3] и её свойствах[4]. В изолированной системе энтропия либо остаётся неизменной, либо возрастает (в неравновесных процессах[3]), достигая максимума при установлении термодинамического равновесия (закон возрастания энтропии)[5][6][2]. Встречающиеся в литературе различные формулировки второго начала термодинамики являются частными следствиями закона возрастания энтропии[5][6].
Второе начало термодинамики позволяет построить рациональную температурную шкалу, не зависящую от произвола в выборе термометрического свойства термодинамического тела и устройства для измерения температуры (термометра)[7].
Вместе первое и второе начала составляют основу феноменологической термодинамики, которую можно рассматривать как развитую систему следствий этих двух начал. При этом из всех допускаемых первым началом процессов в термодинамической системе (то есть процессов, не противоречащих закону сохранения энергии) второе начало позволяет выделить фактически возможные процессы, не противоречащие законам термодинамики[7], установить направление протекания самопроизвольных процессов, найти предельное (наибольшее или наименьшее) значение энергии, которое может быть полезным образом использовано (получено или затрачено) в термодинамическом процессе с учётом ограничений, накладываемых законами термодинамики, а также сформулировать критерии равновесия в термодинамических системах[5][6][2].
Историческая справка[править | править код]
Сади Карно в своём исследовании «Размышления о движущей силе огня и о машинах, способных развивать эту силу»[8] (1824), посвящённом паровым машинам, первым сформулировал идею, лежащую в основе второго начала термодинамики: при отсутствии разности температур теплота не может быть преобразована в работу; для постоянного производства работы тепловой машине необходимо иметь по крайней мере два тепловых резервуара с различными температурами — нагреватель и холодильник.
Уильям Томсон (лорд Кельвин), отталкиваясь от работы Карно, предложил абсолютную термодинамическую шкалу температур (1848) и сформулировал второй закон термодинамики следующим образом[9] (1851): невозможен процесс, единственным результатом которого является получение системой теплоты от одного источника (теплового резервуара) и выполнение ею эквивалентного количества работы[10]. Из принципа Томсона следует теорема Карно, на основании которой удаётся построить абсолютную термодинамическую шкалу температур[11].
Название «второе начало термодинамики» и исторически первая его формулировка (1850) принадлежат Рудольфу Клаузиусу (1850): невозможен процесс, единственным результатом которого является получение системой теплоты от одного тела и передача её другому телу, имеющему более высокую температуру, чем наиболее известная: Теплота не может переходить сама собой от более холодного тела к более тёплому[12]).
Джозайя Уиллард Гиббс в опубликованной в 1876—1878 гг. работе «О равновесии гетерогенных веществ»[13] сформулировал закон возрастания энтропии в виде принципа максимума энтропии (по отношению ко всем возможным её вариациям при постоянной внутренней энергии) в состоянии термодинамического равновесия, и вывел фундаментальные уравнения, позволяющие определять направление самопроизвольных процессов и условия термодинамического равновесия для систем любой сложности. Отметим, что упомянутому выше принципу максимума энтропии эквивалентен сформулированный Гиббсом принцип минимума внутренней энергии (в состоянии термодинамического равновесия внутренняя энергия изолированной системы минимальна[14]).
Людвиг Больцман в 1877 г. в работе «О связи между вторым началом механической теории теплоты и теорией вероятностей в теоремах о тепловом равновесии»[15] показал связь между энтропией и статистическим весом (термодинамической вероятностью) макросостояния физической системы[16]. Закон возрастания энтропии у Больцмана получил простую статистическую интерпретацию: система стремится к наиболее вероятному состоянию; самопроизвольно протекают только те процессы, в которых система из менее вероятного состояния переходит в более вероятное. Предложенная Больцманом интерпретация энтропии как меры упорядоченности/неупорядоченности на атомно-молекулярном уровне позволила обнаружить ряд важных закономерностей, которые становятся очевидными, если заменить термин «энтропия» словом «неупорядоченность».
Вильгельм Оствальд в 1892 г. сформулировал второе начало термодинамики в виде утверждения о невозможности создания вечного двигателя 2-го рода[17], то есть циклически действующей изотермической тепловой машины, способной работать от одного теплового резервуара и, следовательно, преобразовывать в работу всю энергию, извлекаемую из имеющей постоянную температуру окружающей среды. Невозможность создания вечного двигателя 2-го рода следует непосредственно из приведённого выше принципа Томсона и эквивалентна ему[11].
Герман Гельмгольц (1884) был первым, кто обратил внимание на то обстоятельство, что для определения энтропии и абсолютной термодинамической температуры нет необходимости рассматривать круговые процессы и привлекать гипотезу о существования идеального газа, ибо в действительности абсолютная температура любого тела есть не что иное, как тот интегрирующий делитель для элементарного количества теплоты, который зависит от одной только температуры тела, отсчитанной в произвольно выбранной шкале[18][19]. Н. Н. Шиллер, ученик Гельмгольца, в своих работах 1887—1910 гг.[20] развил этот тезис[21], а Константин Каратеодори (1909) обосновал идею Гельмгольца посредством принципа адиабатной недостижимости[22]. В формулировке Каратеодори второе начало термодинамики постулирует существование вблизи каждого равновесного состояния системы таких её состояний, которые не могут быть достигнуты из исходного посредством равновесного адиабатного процесса. Недостаточная наглядность данного положения в работе Каратеодори компенсирована тщательностью его математической проработки.
В 1925 г. Татьяна Афанасьева-Эренфест показала[23][24][25][26], что второе начало термодинамики включает в себя две независимые части: утверждение о существовании энтропии и абсолютной термодинамической температуры, и закон возрастания энтропии. В трактовке Т. Афанасьевой-Эренфест первая часть второго начала основана на четырёх аксиомах и относится к состояниям равновесия и равновесным процессам, а вторая — на двух аксиомах и относится к неравновесным процессам.
В 1954 г. Н. И. Белоконь на основе критического анализа различных формулировок второго начала пришёл к выводу, что «построения принципа существования энтропии в рамках второго начала классической термодинамики на основе постулатов необратимости ошибочны и содержат ряд неявных и совершенно нестрогих допущений». Развивая идеи Т. Афанасьевой-Эренфест Белоконь разделил второе начало термодинамики на два начала: «второе начало термостатики» (принцип существования абсолютной термодинамической температуры и энтропии) и, собственно, «второе начало термодинамики» (принцип возрастания энтропии в неравновесных системах), а также предложил независимое от постулата необратимости обоснование принципа существования энтропии на основе очевидного симметричного постулата Белоконя[27].
Открытие и становление второго начала термодинамики[править | править код]
«История открытия второго начала термодинамики представляет собой одну из самых замечательных, полную драматизма глав общей истории науки, последние страницы которой ещё далеко не дописаны. Потребовались усилия не одного, а многих национальных гениев, для того чтобы приоткрыть завесу над сокровенной тайной природы, которую мы называем сейчас вторым началом термодинамики.»[28] Второе начало термодинамики возникло как рабочая теория тепловых двигателей, которая устанавливает условия, при которых превращение тепла в работу достигает максимального эффекта. Теоретические исследования работы тепловых двигателей, впервые проведённые французским инженером Сади Карно, показали, что малая величина этого эффекта — коэффициента полезного действия (КПД) — обуславливается не техническим несовершенством тепловых двигателей, а особенностью теплоты как способа передачи энергии, которая накладывает ограничения на его величину. Карно пришёл к выводу, что КПД тепловых машин не зависит от термодинамического цикла и природы рабочего тела, а целиком определяется в зависимости от температур внешних источников — нагревателя и холодильника (Теорема Карно)[29].
Работа Карно была написана до открытия принципа эквивалентности теплоты и работы и всеобщего признания закона сохранения энергии. Свои выводы он основывал на двух противоречивых основаниях: теплородной теории, которая была вскоре отброшена, и гидравлической аналогии. Несколько позднее Р. Клаузиус и В. Томсон (Кельвин) согласовали теорему Карно с законом сохранения энергии и заложили основу того, что сейчас составляет содержание второго начала классической (равновесной) термодинамики[29].
Второе начало термодинамики, так же, как и первое, представляет собой обобщение общечеловеческого опыта. (Далее будут рассмотрены «обычные», то есть наиболее распространённые, термодинамические системы, в отличие от редко встречающихся «необычных» спиновых систем, о которых будет упомянуто отдельно). Опыт показывает, что теплота и работа, являющиеся, по определению, формами передачи энергии, неравноценны. Если работа может непосредственно переходить в теплоту, например, посредством трения, и при этом изменяется состояние одного тела, то количество теплоты таким свойством не обладает. Подвод тепла приводит лишь к увеличению внутренней энергии системы, то есть к увеличению её параметров, таких как температура, давление, объём и т. д. Термодинамическая работа, произведённая за счёт переданного количества теплоты, может быть получена лишь опосредственно, путём изменения вышеуказанных параметров (например, работа расширения рабочего тела). При этом, кроме охлаждения самого источника тепла, в случае незамкнутого процесса, происходит изменение термодинамического состояния одного (рабочего) тела, а в случае замкнутого процесса — нескольких тел, которым рабочее тело должно передать часть полученного тепла. В тепловом двигателе получателем теплоты является холодильник. Процесс отдачи части тепла другим телам называется компенсацией. Как показывает опыт, невозможно превратить теплоту в работу без компенсации, являющейся ценой, которую надо заплатить за это превращение. Поясним на примере. Работа в тепловых двигателях производится путём расширения рабочего тела. Чтобы сделать работу машины непрерывной, рабочее тело необходимо вернуть в исходное состояние. С этой целью его надо сжать, затратив работу. Если сжатие производить при той же температуре, что и расширение, то потребуется затратить всю работу, полученную при расширении, и эффективность этого двигателя будет равна нулю. Чтобы работа сжатия была меньше работы расширения, необходимо производить сжатие при более низкой температуре. Для понижения температуры рабочего тела следует часть теплоты передать третьему телу — холодильнику. Коэффициент полезного действия теплового двигателя, по определению, равен отношению количества теплоты, превращённой в положительную работу за один цикл, ко всему подведённому к рабочему телу количеству теплоты.
Первоначальная аксиоматика второго начала термодинамики[править | править код]
Для обоснования теоремы Карно в согласии с законом сохранения энергии и для дальнейшего построения второго начала термодинамики необходимо было ввести новый постулат. Ниже приведены наиболее распространённые формулировки постулата второго начала термодинамики, предложенные в середине 19-го и в начале 20-го веков. (В ряде работ формулировки различных постулатов второго начала отождествляются с формулировками собственно второго начала термодинамики. Это может создать ложное впечатление о неоднозначности самого второго начала термодинамики. В других работах различные словесные формулировки относятся к постулатам, а вторым началом термодинамики считается его однозначное математическое выражение).
- Постулат Клаузиуса (1850 г.):
- Теплота не может переходить самопроизвольно от более холодного тела к более тёплому.
- Постулат Томсона (Кельвина) (1852 г.) в формулировке М. Планка:
- Невозможно построить периодически действующую машину, вся деятельность которой сводится к поднятию тяжести и к охлаждению теплового резервуара.
Указание на периодичность действия машины является существенным, так как возможен некруговой процесс, единственным результатом которого было бы получение работы за счёт внутренней энергии, полученной от теплового резервуара. Этот процесс не противоречит постулату Томсона, так как при некруговом процессе машина не является периодически действующей.[30]
По существу постулат Томсона говорит о невозможности создания вечного двигателя второго рода, единственным результатом работы которого являлось превращение теплоты в работу без компенсации, то есть без вынужденной передачи теплоты другим телам, которая будет безвозвратно утрачена для получения работы. Несложно доказать, что постулаты Клаузиуса и Томсона эквивалентны.[31]
Цикл и теорема Карно[править | править код]
Тепловые машины, к которым в термодинамике относятся тепловые двигатели, холодильные машины и тепловые насосы, для обеспечения непрерывной работы должны работать по замкнутому кругу (циклу), при котором рабочее тело тепловой машины периодически возвращается в исходное состояние. Одним из идеализированных циклов тепловой машины является цикл, предложенный Сади Карно для анализа работы тепловых машин с целью повышения эффективности их работы.
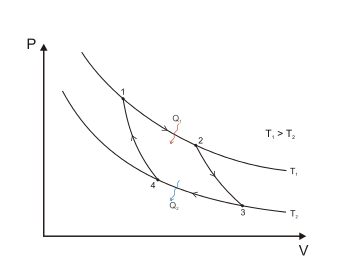
На диаграмме 1 представлен обратимый цикл Карно осуществлённый между двумя источниками теплоты постоянной температуры. Он состоит из двух обратимых изотермических (1—2 и 3—4) и двух обратимых адиабатных (2—3 и 4—1) процессов. Рабочим телом этой тепловой машины является идеальный газ. (Основная статья: Цикл Карно).
Теорема Карно утверждает, что термический КПД обратимого цикла Карно не зависит от природы рабочего тела и определяется только температурами нагревателя и холодильника :
Доказательство теоремы Карно см. в основной статье: Теорема Карно (термодинамика).
Интеграл Клаузиуса и термодинамическая энтропия[править | править код]
Из сопоставления уравнения КПД обратимого цикла Карно
и уравнения КПД любого цикла
следует соотношение
откуда, с учётом принятой системы знаков: плюс ─ для подводимого тепла и минус ─ для отводимого, получим
или
Отношение называется приведённой теплотой, а алгебраическая сумма приведённых теплот для обратимого цикла Карно равна нулю. Далее Клаузиус, разбивает адиабатами произвольный обратимый цикл, на бесконечно большое число элементарных циклов Карно и выводит уравнение
Введя обозначение
получаем:
Это выражение называется интегралом или равенством Клаузиуса. Иногда его называют первым интегралом Клаузиуса. Так как при обратимом процессе интеграл Клаузиуса, взятый по контуру цикла, равен нулю, то его значение не зависит от пути процесса, а определяется лишь начальным и конечным состоянием тела. Это означает, что подынтегральное выражение есть полный дифференциал некоторой функции состояния тела (системы), которую Клаузиус назвал энтропией. Для бесконечно малого обратимого процесса
откуда
Так как элементарное количество тепла не является полным дифференциалом, а есть полный дифференциал, то абсолютная температура выступает здесь как интегрирующий делитель, который превращает неполный дифференциал в полный. Выражение представляет собой математическое выражение второго начала термодинамики для обратимых процессов или принцип существования энтропии. [32]
Рассмотрим необратимый процесс, представленный на рис. 2.

Он состоит из двух ветвей: необратимого процесса AIB и обратимого BIIA, с помощью которого тело возвращается в исходное состояние. Цикл AIBIIA необратимый из-за необратимости процесса AIB. Первый интеграл Клаузиуса можно записать в виде
Второй интеграл, взятый по обратимому участку AIIB, представляет собой разность энтропий между точками A и B. Отсюда следует, что для любого необратимого процесса в любой системе
Это выражение получило название второй интеграл или неравенство Клаузиуса.
В дифференциальном виде:
Следовательно, в изолированной системе, где ,
т.е. во всех необратимых процессах энтропия изолированной системы неизменно возрастает.
Выражение есть принцип возрастания энтропии изолированных систем или математическое выражение второго начала термодинамики для неравновесных процессов. [33].
Общее математическое выражение второго начала термодинамики[править | править код]
Второе начало классической термодинамики формулируется как объединённый принцип существования и возрастания энтропии изолированных систем. Из уравнения (1) и неравенства (2) :
Статистическое определение энтропии[править | править код]
В статистической физике энтропия термодинамической системы рассматривается как функция вероятности её состояния («принцип Больцмана»).
где ─ постоянная Больцмана, ─ термодинамическая вероятность состояния, которая определяется количеством микросостояний, реализующих данное макросостояние.
Физический смысл энтропии[править | править код]
Среди величин, определяющих состояние термодинамической системы, энтропия занимает особое положение. Исходя из математической трактовки энтропии, данной Клаузиусом, следует, что теплота любого бесконечно малого квазистатического процесса равна произведению дифференциала энтропии на термодинамическую температуру. Иными словами, энтропия есть мера приведённой теплоты для любого бесконечно малого квазистатического процесса, а также для любого конечного квазистатического изотермического процесса.
Энтропия как физическая величина отличается своей абстрактностью, физический смысл энтропии непосредственно не вытекает из её математического выражения и не поддаётся простому интуитивному восприятию. В связи с этим неоднократно предпринимались попытки уяснить физический смысл энтропии. Одна из попыток была основана на поиске аналогий энтропии с более доступными для восприятия понятиями. Например, если элементарная работа представляет собой произведение силы на элементарное перемещение, то аналогом работы может служить количество теплоты, аналогом силы — абсолютная температура, а аналогом перемещения — энтропия. Очевидно, что аналогии подобного типа носят искусственный характер, и польза от них для интерпретации энтропии весьма сомнительна. Также несостоятельной является попытка проведения аналогии энтропии с теплоёмкостью. Сравним выражение для удельной энтропии тела:
с выражением удельной теплоёмкости:
.
Подобие этих выражений состоит в использовании одинаковых величин и в одинаковой размерности теплоёмкости и энтропии. Обе величины представляют собой количество теплоты, отнесённое к единице массы и единице температуры. Однако, если в формуле теплоёмкости температура входит в дифференциальной форме и её можно измерять в любой температурной шкале, то в формуле энтропии фигурирует абсолютная температура . Отличие теплоёмкости от энтропии заключается в том, что удельная теплоёмкость представляет собой количество теплоты, необходимое для нагревания тела массой 1кг на один градус Цельсия (или на один Кельвин). При этом значение теплоёмкости не зависит от выбора температурной шкалы. Удельная теплоемкость имеет определённое значение, если указан способ передачи теплоты (например, при постоянном давлении, постоянном объёме и т. п.) и является переменной величиной. Энтропия представляет собой количество тепла, отнесённое к единице массы и единице абсолютной температуры . В некотором смысле это удельная энергия. Энтропия также является функцией состояния, но её значение не зависит от изменения системы вблизи заданного состояния, и она является величиной статической.
С физической точки зрения энтропия характеризует степень необратимости, неидеальности реального термодинамического процесса. Она является мерой диссипации (рассеивания) энергии, а также мерой оценки энергии в плане её пригодности (или эффективности) использования для превращения теплоты в работу. [34] (Два последних утверждения не относятся к необычным системам с отрицательной абсолютной температурой, в которых теплота самопроизвольно может полностью превращаться в работу).
Ревизия постулатной базы и проблема обоснования второго начала термодинамики[править | править код]
На рубеже XIX ─ XX веков стало очевидным, что постулаты запрещения Клаузиуса, Томсона и др. совершенно не соответствуют содержанию и современным требованиям, предъявляемым к обоснованию принципа существования энтропии[35]. Они также не вполне удовлетворяют задаче обоснования и принципа возрастания энтропии, поскольку должны содержать указание об определённой направленности наблюдаемых в природе необратимых явлений, а не отрицание возможности их противоположного течения[36]. В отношении построения второго начала термодинамики по методу Клаузиуса было высказано немало возражений и замечаний. Вот некоторые из них:
1. Построение принципа существования энтропии Клаузиус начинает с выражения КПД обратимого цикла Карно для идеальных газов, а затем распространяет его на все обратимые циклы. Таким образом Клаузиус неявно постулирует возможность существования идеальных газов, подчиняющихся уравнению Клапейрона и закону Джоуля .
2. Обоснование теоремы Карно является ошибочным, так как в схему доказательства внесено лишнее условие ─ более совершенной обратимой машине неизменно приписывается роль теплового двигателя. Однако, полагая, что более совершенной машиной является холодильная, а вместо постулата Клаузиуса принять противоположное утверждение, что тепло не может самопроизвольно переходить от более нагретого тела к более холодному, то теорема Карно будет доказана тем же способом. Отсюда вывод: принцип существования энтропии не зависит от направления протекания самопроизвольных процессов, а постулат необратимости не является основанием для доказательства существования энтропии.
3. Постулат Клаузиуса не является явным утверждением, указывающим на направление протекания наблюдаемых в природе самопроизвольных процессов, в частности, на переход тепла от более нагретого тела к более холодному, так как выражение не может переходить неэквивалентно выражению переходит[37].
4. Утверждение статистической физики о вероятностном характере принципа необратимости и открытие в 1951 г. необычных (квантовых) систем с отрицательными абсолютными температурами, в которых : самопроизвольный теплообмен имеет противоположное направление, теплота может полностью превращаться в работу, а работа не может полностью (без компенсации) перейти в тепло, пошатнули базовые постулаты Клаузиуса, Томсона (Кельвина) и Планка, полностью отвергнув одни, либо наложив серьёзные ограничения на другие. В XX веке благодаря работам Н. Шиллера, К. Каратеодори, Т. Афанасьевой-Эренфест, А. Гухмана, Н. И. Белоконя и др. в обосновании второго начала термодинамики появилось новое аксиоматическое направление. Выяснилось, что принцип существования энтропии может быть обоснован независимо от направления наблюдаемых в природе самопроизвольных процессов, а для определения абсолютной температуры и энтропии не требуется, как заметил Гельмгольц, ни рассмотрения круговых процессов, ни допущения о существовании идеальных газов.
Метод Шиллера-Каратеодори[править | править код]
В 1909 г. крупный немецкий математик Константин Каратеодори, а ещё ранее Н. Шиллер обосновали принцип существования энтропии не путём исследования состояний реальных термодинамических систем, а на основе математического рассмотрения выражений обратимого теплообмена как дифференциальных полиномов (форм Пфаффа). В основу метода был положен
• Постулат Каратеодоре:
Вблизи каждого равновесного состояния системы возможны такие её состояния, которые не могут быть достигнуты при помощи обратимого адиабатического процесса.
Теорема Каратеодори утверждает, что если дифференциальный полином Пфаффа обладает тем свойством, что в произвольной близости некоторой точки существуют другие точки, недостижимые посредством последовательных перемещений по пути , то существуют интегрирующие делители этого полинома и уравнения .
Критически к постулату Каратеодори относился М. Планк. С его точки зрения «содержащиеся в нём высказывание не является общеприменимым к естественным процессам… . Никто ещё и никогда не ставил опытов с целью достижения всех смежных состояний какого-либо определённого состояния адиабатическим путем». Системе Каратеодори Планк противопоставляет свою систему, основанную на постулате: «Образование теплоты посредством трения необратимо», которым, по его мнению, исчерпывается содержание второго начала термодинамики. Между тем, метод Каратеодори, получил высокую оценку в работе Т. Афанасьевой-Эренфест «Необратимость, односторонность и второе начало термодинамики» (1928 г.). В своей замечательной статье Афанасьева-Эренфест пришла к ряду важнейших выводов, в частности:
1. Основное содержание второго начала состоит в том, что элементарное количество теплоты , которым система обменивается в квазистатическом процессе, может быть представлено в виде , где ─ универсальная функция температуры, называемая абсолютной температурой, а ─ функция параметров состояния системы, получившая название энтропии. Само же выражение представляет собой принцип существования энтропии.
2. Принципиальное отличие неравновесных процессов от равновесных состоит в том, что в условиях неоднородности температурного поля внутри термодинамической системы, а также потерь работы в необратимых процессах на трение, сопротивление, возможен переход системы к состоянию с другой энтропией без обмена теплотой с окружающей средой. (Этот процесс позднее в трудах Н. И. Белоконя получил название «внутреннего теплообмена» или теплообмена рабочего тела). Внутренний теплообмен в изолированной системе всегда необратим и следствием его является «односторонность».
3. Одностороннее изменение энтропии в равной степени мыслимо и как неуклонное её возрастание или как неуклонное убывание. Физические предпосылки, такие как адиабатическая недостижимость и необратимость реальных процессов, не выражают никаких требований относительно преимущественного направления течения самопроизвольных процессов.
4. Для согласования полученных выводов с опытными данными для реальных процессов необходимо принять постулат, сфера действия которого определяется границами применимости этих данных. Таким постулатом является принцип возрастания энтропии.
А. Гухман, оценивая работу Каратеодори, считает, что она «отличается формальной логической строгостью и безупречностью в математическом отношении… Вместе с тем в стремлении к наибольшей общности Каратеодори придал своей системе настолько абстрактную и сложную форму, что она оказалась фактически недоступной для большинства физиков того времени». Относительно постулата адиабатической недостижимости Гухман замечает, что как физический принцип он не может быть положен в основу теории, имеющей универсальное значение, так как не обладает свойством самоочевидности. «Всё предельно ясно в отношении простой…системы…Но эта ясность полностью утрачивается в общем случае гетерогенной системы, усложнённой химическими превращениями и испытывающей воздействие внешних полей»[38]. Он также говорит и о том, насколько права была Афанасьева-Эренфест, настаивая на необходимости полного отделения проблемы существования энтропии, от всего, что связано с идеей необратимости реальных процессов"[39]. Относительно построения основ термодинамики Гухман полагает, что «самостоятельной отдельной проблемы существования энтропии нет. Вопрос сводится к распространению на случай термического взаимодействия опыта изучения всех других энергетических взаимодействий, завершающихся установлением единообразного по форме уравнения для элементарного количества воздействия Эта экстраполяция даёт основания принять её в качестве правдоподобной гипотезы и тем самым постулировать существование энтропии. (Постулирование принципа существования энтропии на основании общечеловеческого опыта существенно ограничивает сферу его действия как фундаментального закона природы).
Н. И. Белоконь в своей монографии „Термодинамика“ дал детальный анализ многочисленных попыток обоснования второго начала термодинамики как объединённого принципа существования и возрастания энтропии на основе одного лишь постулата необратимости. Он показал, что попытки такого обоснования не могут быть оправданы, во-первых, потому, что вывод о существовании энтропии и абсолютной температуры не имеет никакого отношения к необратимости явлений природы, поскольку эти функции существуют независимо от возрастания или убывания энтропии изолированных систем, во-вторых, указание о направлении наблюдаемых необратимых явлений снижает уровень общности второго начала термодинамики и, в-третьих, использование постулата Томсона — Планка о невозможности полного превращения тепла в работу противоречит результатам исследований систем с отрицательной абсолютной температурой, в которых может быть осуществлено полное превращение тепла в работу, но невозможно полное превращение работы в тепло. Вслед за Т. Афанасьевой-Эренфест Н. И. Белоконь утверждает, что различие содержания, уровня общности и сферы применения принципов существования и возрастания энтропии совершенно очевидно:
1. Из принципа существования энтропии вытекает ряд важнейших дифференциальных уравнений термодинамики. Его научное и практическое значение трудно переоценить.
2. Принцип возрастания энтропии изолированных систем есть утверждение о необратимом течении наблюдаемых в природе явлений. Этот принцип используется в суждениях о наиболее вероятном направлении течения физических и химических процессов. Из него вытекают все неравенства термодинамики. Относительно обоснования принципа существования энтропии по методу Шиллера ─ Каратеодори Белоконь отмечает, что в построениях по этому методу совершенно обязательным является использование теоремы Каратеодори об условиях существования интегрирующих делителей дифференциальных полиномов однако, необходимость использования этой теоремы „должна быть признана очень стеснительной, так как общая теория дифференциальных полиномов рассматриваемого типа (форм Пфаффа) представляет известные трудности и излагается лишь в специальных трудах по высшей математике.“ В большинстве курсов термодинамики теорема Каратеодори даётся без доказательства, либо приводится доказательство в нестрогом, упрощённом виде[40].
Анализируя построение принципа существования энтропии равновесных систем по схеме К. Каратеодори Н. И. Белоконь обращает внимание на использовании необоснованного допущения о возможности одновременного включения температуры и ─ функции в состав независимых переменных состояния равновесной системы и приходит к выводу, что постулат Каратеодори эквивалентен группе общих условий существования интегрирующих делителей дифференциальных полиномов но недостаточен для установления существования первичного интегрирующего делителя , то есть для обоснования принципа существования абсолютной температуры и энтропии. Далее он утверждает, что при построении принципа существования абсолютной температуры и энтропии на основе теоремы Каратеодори должен быть использован такой постулат, который был бы эквивалентен теореме о несовместимости адиабаты и изотермы. В этих корректиpованных построениях становится совершенно излишним постулат Каратеодори, так как он является частным следствием необходимой теоремы о несовместимости адиабаты и изотермы.»[41].
Метод Н. И. Белоконя[править | править код]
По этому методу второе начало термодинамики разделено на два независимых принципа (начала): 1. Принцип существования абсолютной температуры и энтропии (второе начало термостатики). 2. Принцип возрастания энтропии (второе начало термодинамики).
Каждый из этих принципов получил обоснование на основании независимых постулатов.
• Постулат второго начала термостатики (Белоконя): Температура есть единственная функция состояния, определяющая направление самопроизвольного теплообмена, то есть между телами и элементами тел, не находящимися в тепловом равновесии, невозможен одновременный самопроизвольный (по балансу) переход тепла в противоположных направлениях — от тел более нагретых к телам менее нагретым и обратно[42].
Постулат Белоконя самоочевиден, так как является частным выражением причинной связи и однозначности законов природы. Например, если существует причина, в силу которой в данной системе тепло переходит от более нагретого тела к менее нагретому, то эта же причина будет препятствовать переходу тепла в противоположном направлении и наоборот. Этот постулат полностью симметричен в отношении направления необратимых явлений, так как не содержит никаких указаний о наблюдаемом направлении необратимых явлений в нашем мире ─ мире положительных абсолютных температур.
- Следствия второго начала термостатики:
Следствие I. Невозможно одновременное (в рамках одной и той же пространственно- временной системы положительных или отрицательных абсолютных температур) осуществление полных превращений тепла в работу и работы в тепло.
Следствие II. (теорема несовместимости адиабаты и изотермы). На изотерме равновесной термодинамической системы, пересекающей две различные адиабаты той же системы, теплообмен не может быть равен нулю.
Следствие III (теорема теплового равновесия тел). В равновесных круговых процессах двух термически сопряженных тел , образующих адиабатически изолированную систему оба тела возвращаются на исходные адиабаты и в исходное состояние одновременно.
На основании следствий постулата второго начала термостатики Н. И. Белоконь предложил схемы построения принципа существования абсолютной температуры и энтропии для обратимых и необратимых процессов [43].
- Постулат второго начала термодинамики:
Работа может быть непосредственно и полностью превращена в тепло путём трения или электронагрева.
Следствие I.Тепло не может быть полностью превращено в работу (принцип исключенного Perpetuum mobile II рода):
Следствие II. КПД или холодопроизводительность любой необратимой тепловой машины при заданных температурах внешних источников всегда меньше КПД или холодопроизводительности обратимых машин, работающих между теми же источниками.
Снижение КПД и холодопроизводительности реальных тепловых машин связано с неравновесным теплообменом из-за разности температур источников тепла и рабочего тела и за счёт необратимых потерь работы на трение и внутренние сопротивления. Из этого следствия и следствия I второго начала термостатики непосредственно вытекает невозможность осуществления Perpetuum mobile I и II рода.
Границы применимости второго начала термодинамики[править | править код]
В системе идей Клаузиуса и его последователей оба принципа существования и возрастания энтропии основываются на постулате необратимости (постулаты Клаузиуса, Томсона-Кельвина, Планка и др.), причём во главу угла поставлен принцип возрастания энтропии, который возводится в ранг универсального закона природы, стоящего рядом с законом сохранения энергии. Абсолютизация Клаузиусом принципа возрастания энтропии приобрела смысл важнейшего космологического закона природы, следствием которого стала антинаучная концепция «тепловой смерти Вселенной»[44]. Таким образом, любое нарушение этого фундаментального закона привело бы к обрушению всех следствий из него, что существенно ограничило бы сферу влияния термодинамики. Характерным в этом смысле является высказывание М. Планка, утверждавшего, что с необратимостью «стоит и падает термодинамика». В этом смысле выводы статистической физики о вероятностном характере принципа необратимости и открытие систем с отрицательными абсолютными температурами должны привести к краху второго начала, а вместе с ним и самой термодинамики. Однако это не произошло. Ошибочный вывод М. Планка о «падении термодинамики» с падением постулата необратимости непосредственно связан с сложившимся исторически, объединении в одном законе принципов существования и возрастания энтропии и придание принципу возрастания энтропии смысла второго начала термодинамики. На неравноценность указанных принципов и несовместимость их в одном начале термодинамики обратила внимание Т. Афанасьева-Эренфест. По её словам, одно и то же начало представляется в двух совершенно различных обликах: 1) как утверждение существования интегрирующего множителя для известного выражения dQ и 2) как утверждение о неуклонном возрастании энтропии при реальных адиабатических процессах. Представляется трудным уместить в одно отчетливое обозримое поле зрения эти оба положения и схватить логическое тождество второго начала и принципа возрастания энтропии[45].
Благодаря ревизии второго начала термодинамики на первый план в качестве фундаментального закона термодинамики выходит принцип существования энтропии, а принцип возрастания энтропии изолированных систем является принципом локальным, статистическим, который, по словам Афанасьевой-Эренфест, выполняется «только в некоторые эпохи».[46]
Гипотеза «тепловой смерти Вселенной»[править | править код]
Некритическое обобщение закономерностей земного опыта, в частности, распространение выводов второго начала термодинамики о возрастании энтропии изолированных систем на системы галактического размера, где значительную роль в формировании новых звёздных систем играют гравитационные силы, и на Вселенную в целом приводило в прошлом к антинаучному выводу о «тепловой смерти Вселенной». Согласно современным данным Метагалактика представляет собой расширяющуюся систему, которая является нестационарной, и поэтому вопрос о тепловой смерти Вселенной нельзя даже ставить[47].
Однако сам термин «тепловая смерть Вселенной» иногда используется для обозначения сценария будущего развития вселенной, согласно которому Вселенная так и будет расширяться до бесконечности во тьму пространства, пока не обратится в рассеянный холодный прах[48].
Второе начало термодинамики и критика эволюционизма[править | править код]
Второе начало термодинамики (в формулировке неубывания энтропии) иногда используется критиками эволюционной теории с целью показать, что развитие природы в сторону усложнения невозможно[49][50]. Однако подобное применение физического закона является некорректным, так как энтропия не убывает только в замкнутых системах (сравн. с диссипативной системой), в то время как живые организмы и планета Земля в целом являются открытыми системами.
В процессе жизнедеятельности живые организмы превращают энергию одного вида (электромагнитную солнечную, химическую) в энергию другого вида (тепловую), тем самым ускоряя суммарное увеличение энтропии Вселенной. Несмотря на «локальное» уменьшение энтропии путем «упорядоченных» процессов, происходит суммарное увеличение энтропии вселенной, а живые организмы являются в некотором роде катализаторами этого процесса. Таким образом, наблюдается выполнение второго закона термодинамики и нет никакого парадокса возникновения и существования живых организмов вопреки глобальной тенденции вселенной к увеличению «беспорядка».
См. также[править | править код]
Примечания[править | править код]
- ↑ Термин (др.-греч. ἐντροπία) образован Р. Клаузиусом из слова τροπη — превращение, и приставки ἐν — в, внутрь (Второе начало термодинамики, 1934, с. 156).
- ↑ 1 2 3 Химическая энциклопедия, т. 1, 1988, с. 432.
- ↑ 1 2 Базаров И. П., Термодинамика, 2010, с. 49.
- ↑ Эта дефиниция не накладывает ограничений на вид термодинамической системы, поэтому вполне корректно рассуждать об энтропии неравновесных систем, в том числе открытых и релятивистских.
- ↑ 1 2 3 БСЭ, 3-е изд., т. 5, 1971, с. 495.
- ↑ 1 2 3 Физика. Большой энциклопедический словарь, 1998, с. 95.
- ↑ 1 2 Сивухин Д. В., Общий курс физики т. II, 2005, с. 85.
- ↑ Второе начало термодинамики, 1934, с. 16—69.
- ↑ Второе начало термодинамики, 1934, с. 165.
- ↑ «Если бы мы не признали эту аксиому действительной при всех температурах, нам пришлось бы допустить, что можно ввести в действие автоматическую машину и получать путем охлаждения моря или земли механическую работу в любом количестве, вплоть до исчерпания всей теплоты суши и моря или, в конце концов, всего материального мира» (Второе начало термодинамики, 1934, с. 165).
- ↑ 1 2 БРЭ, т. 6, 2006, с. 80—81.
- ↑ Второе начало термодинамики, 1934, с. 133.
- ↑ Гиббс Дж. В., Термодинамика. Статистическая механика, 1982, с. 61—350.
- ↑ Герасимов Я. И. и др., Курс физической химии, т. 1, 1970, с. 117.
- ↑ Больцман Л., Избранные труды, 1984, с. 190—235.
- ↑ Термодинамическая вероятность — число способов, которыми может быть реализовано состояние физической системы. В термодинамике макросостояние физической системы характеризуется определёнными значениями плотности, давления, температуры и других измеримых макроскопических величин. Одному и тому же макросостоянию хаотически перемещающихся частиц могут соответствовать различные квантовые микросостояния с одинаковой энергией (см. кратность вырождения энергетического уровня). Термодинамическая вероятность W равна числу микросостояний, реализующих данное макросостояние, из чего следует, что W есть безразмерное целое число, большее или равное 1, и не является вероятностью в математическом смысле; менее упорядоченным состояниям соответствует большее значение W или, что то же самое, эти состояния имеют больший статистический вес. Наименьшее значение W = 1 имеет самая упорядоченная система — идеальный кристалл при температуре абсолютного нуля. Термодинамическая вероятность связана с одной из основных макроскопических характеристик системы — энтропией — уравнением Больцмана. Для вычисления W существенно, считают ли частицы системы различимыми или неразличимыми.
- ↑ Бродянский В. М., Вечный двигатель, 1989, с. 114.
- ↑ Helmholtz H. v., Studien zur Statik monocyklischer Systeme, 1884.
- ↑ Гухман А. А., Об основаниях термодинамики, 2010, с. 352.
- ↑ Гельфер Я. М., История и методология термодинамики и статистической физики, 1981, с. 209—212.
- ↑ «Формулировка второго закона требует, чтобы при любом адиабатном процессе, при котором параметры состояния возвращаются к своим первоначальным значениям, температура также приводилась к своей первоначальной величине. Это требование выполняется прежде всего тогда, когда приращение температуры не будет зависеть от промежуточных значений параметров состояния, т. е. прежде всего когда любая из температур адиабатного процесса определится только в функции соответствующих параметров… А это обстоятельство, очевидно, соответствует тому условию, чтобы уравнение dQ = 0 имело интеграл» (Отчеты и протоколы физико-математического общества при университете св. Владимира. Киев, 1899, с. 8. Цитируется по книге «Гельфер Я. М., История и методология термодинамики и статистической физики», 1981, с. 210).
- ↑ Каратеодори К., Об основах термодинамики.
- ↑ Ehrenfest-Afanassjewa T. Zur Axiomatisierung des zweiten Hauptsatzes der Thermodynamik (1), 1925.
- ↑ Ehrenfest-Afanassjewa T. Zur Axiomatisierung des zweiten Hauptsatzes der Thermodynamik (2), 1925.
- ↑ Афанасьева-Эренфест Т. А., Необратимость, односторонность и второе начало термодинамики, 1928.
- ↑ Ehrenfest-Afanassjewa T. Die Grundlagen der Thermodynamik, 1956.
- ↑ Белоконь Н. И.,Термодинамика, 1954, с. 5—6.
- ↑ Вукалович М. П., Техническая термодинамика, 1968, с. 94—95.
- ↑ 1 2 Белоконь Н. И.,Термодинамика, 1954, с. 131.
- ↑ Сивухин Д. В., Общий курс физики т. II, 2005, с. 88.
- ↑ Сивухин Д. В., Общий курс физики т. II, 2005, с. 90.
- ↑ Базаров И. П., Термодинамика, 2010, с. 58.
- ↑ Базаров И. П., Термодинамика, 2010, с. 75.
- ↑ Шамбадаль П., Развитие и приложение энтропии, 1967, с. 61— 64.
- ↑ Н. И. Белоконь и А. А. Гухман рассмотрели (см. [www.libgen.io/book/index.php?md5=FC21B1FC68883FDE2AA5A47698FC5903 Белоконь Н. И., Термодинамика, 1954, с. 223] (недоступная ссылка), [www.libgen.io/book/index.php?md5=73B2F7F042354D238360376572B70AE1 Гухман А. А., Об основаниях термодинамики, 2010, с. 340—341)] (недоступная ссылка) ситуацию, в которой постулат Клаузиуса заменён на его антитезу («антипостулат»: теплота не может переходить сама собой от более горячего тела к более холодному), и показали, что замена постулата Клаузиуса физически абсурдной посылкой противоположного содержания не отражается ни на существе получаемых с его помощью результатов, ни на способе их получения, то есть конечные выводы не находятся в логической зависимости от исходной посылки.
- ↑ Белоконь Н. И.,Термодинамика, 1954, с. 197—198.
- ↑ Белоконь Н. И.,Термодинамика, 1954, с. 223—226.
- ↑ Гухман А. А., Об основаниях термодинамики, 2010, с. 370.
- ↑ Гухман А. А., Об основаниях термодинамики, 2010, с. 366.
- ↑ Белоконь Н. И.,Термодинамика, 1954, с. 244.
- ↑ Белоконь Н. И.,Термодинамика, 1954, с. 245—246.
- ↑ Белоконь Н. И., Основные принципы термодинамики, 1968, с. 55—56.
- ↑ Белоконь Н. И.,Термодинамика, 1954, с. 166—184.
- ↑ Гухман А. А., Об основаниях термодинамики, 2010, с. 351.
- ↑ Афанасьева-Эренфест Т. А., Необратимость, односторонность и второе начало термодинамики, 1928, с. 3.
- ↑ Афанасьева-Эренфест Т. А., Необратимость, односторонность и второе начало термодинамики, 1928, с. 26—27.
- ↑ Базаров И. П., Термодинамика, 2010, с. 82─84.
- ↑ Космологическая постоянная. Дата обращения: 17 октября 2017. Архивировано 18 октября 2017 года.
- ↑ John Rennie «15 Answers to Creationist Nonsense», Scientific American 287 (1): 78-85, 2002.
- ↑ Марков А. Рождение сложности. Эволюционная биология сегодня: неожиданные открытия и новые вопросы. — М.: «Издательство Астрель», 2010. — С. 199. — 527 с. — 3000 экз. — ISBN 978-5-271-24663-0.
Литература[править | править код]
- Ehrenfest-Afanassjewa T. Zur Axiomatisierung des zweiten Hauptsatzes der Thermodynamik (нем.) // Zeitschrift für Physik. — 1925. — Vol. 33, Nr. 1. — P. 933–945.
- Ehrenfest-Afanassjewa T. Berichtigung zu der Arbeit: Zur Axiomatisierung des zweiten Hauptsatzes der Thermodynamik (нем.) // Zeitschrift für Physik. — 1925. — Vol. 34, Nr. 1. — P. 638.
- Ehrenfest-Afanassjewa T. Die Grundlagen der Thermodynamik. — Leiden: E. J. Brill, 1956. — XII + 131 p.
- Helmholtz Hermann von. Studien zur Statik monocyklischer Systeme (нем.) // Sitzungsberichte der Königlich Preussischen Akademie der Wissenschaften zu Berlin. — 1884. — Nr. 1. Halbband. — P. 159—177.
- Афанасьева-Эренфест Т. А. Необратимость, односторонность и второе начало термодинамики // Журнал прикладной физики. — 1928. — Т. 5, № 3—4. — С. 3—30.
- Базаров И. П. Термодинамика. — 5-е изд. — СПб.—М.—Краснодар: Лань, 2010. — 384 с. — (Учебники для вузов. Специальная литература). — ISBN 978-5-8114-1003-3.
- Белоконь Н. И. Термодинамика. — М.: Госэнергоиздат, 1954. — 416 с.
- Белоконь Н. И. Основные принципы термодинамики. — М.: Недра, 1968. — 112 с.
- Больцман Л. Избранные труды / Отв. ред. Л. С. Полак. — М.: Наука, 1984. — 590 с. — (Классики науки).
- Большая Советская Энциклопедия / Гл. ред. А. М. Прохоров. — 3-е изд.. — М.: Советская Энциклопедия, 1971. — Т. 5: Вешин — Газли. — 640 с. Архивная копия от 6 сентября 2018 на Wayback Machine
- Большая российская энциклопедия / Гл. ред. Ю. С. Осипов. — М.: Большая Российская энциклопедия, 2006. — Т. 6: Восьмеричный путь — Германцы. — 768 с. — ISBN 5-85270-335-4.
- Бродянский В. М. Вечный двигатель — прежде и теперь. От утопии — к науке, от науки — к утопии. — М.: Энергоатомиздат, 1989. — 256 с. — (Научно-популярная библиотека школьника). — ISBN 5-283-00058-3.
- Вукалович М. П. Техническая термодинамика. — М.: Энергия, 1968. — 496 с.
- Второе начало термодинамики: Сади Карно — В. Томсон-Кельвин — Р. Клаузиус — Л. Больцман — М. Смолуховский / Под. ред. и с пред. А. К. Тимирязева. — М.—Л.: Гостехиздат, 1934. — 311 с.
- Гельфер Я. М. История и методология термодинамики и статистической физики. — 2-е изд., перераб. и доп. — М.: Высшая школа, 1981. — 536 с.
- Герасимов Я. И., Древинг В. П., Еремин Е. Н. и др. Курс физической химии / Под общ. ред. Я. И. Герасимова. — 2-е изд. — М.: Химия, 1970. — Т. I. — 592 с.
- Гиббс Дж. В. Термодинамика. Статистическая механика / Отв. ред. Д. Н. Зубарев. — М.: Наука, 1982. — 584 с. — (Классики науки)..
- Гухман А. А. Об основаниях термодинамики. — 2-е изд. — М.: ЛКИ, 2010. — 384 с. — ISBN 978-5-382-01105-9.
- Каратеодори К. Об основах термодинамики // Развитие современной физики / Отв. ред. Б. Г. Кузнецов. — М.: Наука, 1964. — С. 3—22.
- Сивухин Д. В. Общий курс физики. — 5-е изд. — М.: Физматлит, 2005. — Т. II. — 544 с. — ISBN 5-9221-0601-5.
- Физика. Большой энциклопедический словарь / Гл. ред. А. М. Прохоров. — М.: Большая Российская энциклопедия, 1998. — 944 с. — ISBN 5-85270-306-0.
- Химическая энциклопедия / Гл. ред. И. Л. Кнунянц. — М.: Советская энциклопедия, 1988. — Т. 1: Абл — Дар. — 624 с.
- Шамбадаль П.,. Развитие и приложение понятия энтропии. — М.: Наука, 1967. — 280 с.
Некоторые внешние ссылки в этой статье ведут на сайты, занесённые в спам-лист |




















































