Ибрутиниб
| Ибрутиниб | |
|---|---|
 | |
| Химическое соединение | |
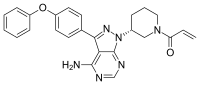
| ИЮПАК | 1-[(3R)-3-[4-Amino-3-(4-phenoxyphenyl)-1H-pyrazolo[3,4-d]pyrimidin-1-yl]piperidin-1-yl]prop-2-en-1-one |
| Брутто-формула | C25H24N6O2 |
| Молярная масса | 440.4971 |
| CAS | 936563-96-1 |
| PubChem | 24821094 |
| DrugBank | 09053 |
| Состав | |
| Классификация | |
| АТХ | L01XE27 |
| Фармакокинетика | |
| Связывание с белками плазмы | 97.3% |
| Метаболизм | Hepatic (CYP3A & CYP2D6) |
| Период полувывед. | 4-6 hours |
| Экскреция | Faeces (80%), urine (10%) |
Ибрутиниб (Imbruvica, PCI-32765) — противоопухолевое средство, предназначенное для лечения злокачественных B-лимфопролиферативных заболеваний[1][2]. Препарат представляет собой ковалентный селективный ингибитор тирозинкиназы Брутона, которая играет важную роль в поддержании жизнеспособности злокачественных клеток[3].
Препарат был одобрен в США для лечения мантийноклеточной лимфомы (МКЛ), хронического лимфоцитарного лейкоза (ХЛЛ) и макроглобулинемии Вальденстрёма. Ведутся клинические испытания ибрутиниба для лечения прочих B-лимфопролиферативных заболеваний, таких как диффузная B-крупноклеточная лимфома и миеломная болезнь.
История[править | править код]
Ибрутиниб был впервые синтезирован сотрудниками Celera Genomics как часть серии малых молекул, способных ковалентно и селективно связываться с остатком Cys-481 в АТФ-связывающем кармане тирозинкиназы Брутона и блокировать её ферментативную активность. О своём открытии компания сообщила в 2007 году[3]. В апреле 2006 года компания Pharmacyclics приобрела права на эти ингибиторы тирозинкиназы Брутона для дальнейшей доклинической разработки в контексте аутоиммунных и B-лимфопролиферативных заболеваний[4][5].
Препарат был одобрен Управлением по санитарному надзору за качеством пищевых продуктов и медикаментов (FDA) США для лечения пациентов с мантийноклеточной лимфомой (МКЛ), которые уже прошли хотя бы один курс терапии другими препаратами, в 2013 году[6] и для лечения хронического лимфоцитарного лейкоза (ХЛЛ) при том же условии в 2014 году[7][8]. Позднее ибрутиниб был также одобрен как препарат первой линии для лечения ХЛЛ с делецией короткого плеча 17-й хромосомы (2014) и макроглобулинемии Вальденстрёма (2015)[9]. Ведутся клинические испытания препарата для лечения прочих B-лимфопролиферативных заболеваний, таких как диффузная B-крупноклеточная лимфома и миеломная болезнь.
Механизм действия[править | править код]
Основной механизм действия ибрутиниба связан с селективным необратимым ковалентным ингибированием тирозинкиназы Брутона. Тирозинкиназа Брутона является компонентом сигнального пути B-клеточного рецептора и необходима для нормального созревания и функционирования B-лимфоцитов[10]. Соответственно, ингибирование этой киназы при помощи ибрутиниба противодействует росту злокачественных B-клеток, зависимых от B-клеточного рецептора, таких как клетки ХЛЛ, МКЛ и В-клеточной лимфомы[11].
Ибрутиниб блокирует автофосфорилирование тирозинкиназы Брутона в злокачественных В-клетках при их стимуляции, а также фосфорилирование (активацию) фосфолипазы С γ и киназ ERK1/2 и AKT, расположенных ниже тирозинкиназы Брутона в сигнальном пути[5][12][13]. Кроме того, ибрутиниб подавляет активность ещё одного важного для B-клеток сигнального пути — NF-κB — ex vivo и in vivo[14].
Ибрутиниб ингибирует пролиферацию и способствует апоптозу клеток ХЛЛ[12][13][14]. Препарат также нарушает взаимодействие злокачественных клеток с микроокружением, поддерживающим их жизнеспособность. Так, ибрутиниб подавляет стимулирующее действие CD40L, BAFF, интерлейкина 6, интерлейкина 4, фактора некроза опухоли, фибронектина и мезенхимальных стромальных клеток на выживание опухолевых клеток[12].
Ибрутиниб ингибирует хемотаксис лейкозных клеток различного происхождения к хемокинам CXCL12 и CXCL13 и снижает их адгезию к стромальным клеткам костного мозга[13][15][16][17]. В результате, в начале лечения ибрутинибом появляется характерный временный лимфоцитоз, вызванный выходом злокачественных клеток из лимфатических узлов в кровяное русло, и параллельное уменьшение лимфаденопатии[18][19].
Показания к применению[править | править код]
Ибрутиниб может быть прописан пациентам с мантийноклеточной лимфомой и хроническим лимфолейкозом при условии, что они уже прошли хотя бы один курс терапии другими препаратами. Ибрутиниб может быть выбран как препарат первой линии для лечения хронического лимфлейкоза с делецией короткого плеча 17-й хромосомы и для лечения макроглобулинемии Вальденстрёма[20].
Стандартная доза препарата для лечения МКЛ составляет 560 мг, для лечения ХЛЛ и МВ — 420 мг[20].
Побочные эффекты[править | править код]
К наиболее серьёзным побочным эффектам ибрутиниба относятся[20]:
- кровотечения — кровотечения третьей и выше степени наблюдали у примерно 6 % пациентов;
- инфекции — инфекции третьей и выше степени наблюдали у 14—26 % пациентов;
- цитопении — частота нейтропении доходит до 29 %, тромбоцитопении — до 17 %, анемии — до 9 %;
- фибрилляция предсердий — зарегистрирована в 6—9 % случаев;
- вторичные злокачественные опухоли — у 5—14 % пациентов, проходящих лечение ибрутинибом, в это время были обнаружены прочие злокачественные опухоли.
Наиболее частыми (≥20 % случаев) побочным эффектами ибрутиниба являются[20]:
- тромбоцитопения;
- нейтропения;
- диарея;
- анемия;
- усталость;
- скелетно-мышечные боли;
- инфекции верхних дыхательных путей;
- сыпь;
- тошнота;
- повышенная температура тела;
- периферические отёки;
- гематомы;
- одышка;
- запор;
- боль в животе;
- рвота;
- пониженный аппетит.
Стоимость[править | править код]
Стоимость месяца терапии ибрутинибом в США в 2013 г составляла около 11000 долларов[21]. Лечение является непрерывным.
Примечания[править | править код]
- ↑ Imbruvica. Дата обращения: 11 декабря 2014. Архивировано 20 декабря 2014 года.
- ↑ IMBRUVICA- ibrutinib capsule, HUMAN PRESCRIPTION DRUG LABEL (англ.). DailyMed. U. S. National Library of Medicine.
- ↑ 1 2 Pan Z., Scheerens H., Li S. J., Schultz B. E., Sprengeler P. A., Burrill L. C., Mendonca R. V., Sweeney M. D., Scott K. C., Grothaus P. G., Jeffery D. A., Spoerke J. M., Honigberg L. A., Young P. R., Dalrymple S. A., Palmer J. T. Discovery of selective irreversible inhibitors for Bruton's tyrosine kinase. (англ.) // ChemMedChem. — 2007. — Vol. 2, no. 1. — P. 58—61. — doi:10.1002/cmdc.200600221. — PMID 17154430.
- ↑ Pharmacyclics. Дата обращения: 12 апреля 2017. Архивировано 13 апреля 2017 года.
- ↑ 1 2 Honigberg L. A., Smith A. M., Sirisawad M., Verner E., Loury D., Chang B., Li S., Pan Z., Thamm D. H., Miller R. A., Buggy J. J. The Bruton tyrosine kinase inhibitor PCI-32765 blocks B-cell activation and is efficacious in models of autoimmune disease and B-cell malignancy. (англ.) // Proceedings of the National Academy of Sciences of the United States of America. — 2010. — Vol. 107, no. 29. — P. 13075—13080. — doi:10.1073/pnas.1004594107. — PMID 20615965.
- ↑ Пресс-релиз. Дата обращения: 11 декабря 2014. Архивировано 3 января 2015 года.
- ↑ Пресс-релиз 1, ХЛЛ. Дата обращения: 11 декабря 2014. Архивировано 15 декабря 2014 года.
- ↑ Пресс-релиз 2, ХЛЛ. Дата обращения: 11 декабря 2014. Архивировано 15 декабря 2014 года.
- ↑ Пресс-релиз МВ. Дата обращения: 11 апреля 2017. Архивировано 1 февраля 2015 года.
- ↑ Seda V., Mraz M. B-cell receptor signalling and its crosstalk with other pathways in normal and malignant cells. (англ.) // European journal of haematology. — 2015. — Vol. 94, no. 3. — P. 193—205. — doi:10.1111/ejh.12427. — PMID 25080849.
- ↑ Burger J. A. Bruton's tyrosine kinase (BTK) inhibitors in clinical trials. (англ.) // Current hematologic malignancy reports. — 2014. — Vol. 9, no. 1. — P. 44—49. — doi:10.1007/s11899-013-0188-8. — PMID 24357428.
- ↑ 1 2 3 Herman S. E., Gordon A. L., Hertlein E., Ramanunni A., Zhang X., Jaglowski S., Flynn J., Jones J., Blum K. A., Buggy J. J., Hamdy A., Johnson A. J., Byrd J. C. Bruton tyrosine kinase represents a promising therapeutic target for treatment of chronic lymphocytic leukemia and is effectively targeted by PCI-32765. (англ.) // Blood. — 2011. — Vol. 117, no. 23. — P. 6287—6296. — doi:10.1182/blood-2011-01-328484. — PMID 21422473.
- ↑ 1 2 3 Ponader S., Chen S. S., Buggy J. J., Balakrishnan K., Gandhi V., Wierda W. G., Keating M. J., O'Brien S., Chiorazzi N., Burger J. A. The Bruton tyrosine kinase inhibitor PCI-32765 thwarts chronic lymphocytic leukemia cell survival and tissue homing in vitro and in vivo. (англ.) // Blood. — 2012. — Vol. 119, no. 5. — P. 1182—1189. — doi:10.1182/blood-2011-10-386417. — PMID 22180443.
- ↑ 1 2 Herman S. E., Mustafa R. Z., Gyamfi J. A., Pittaluga S., Chang S., Chang B., Farooqui M., Wiestner A. Ibrutinib inhibits BCR and NF-κB signaling and reduces tumor proliferation in tissue-resident cells of patients with CLL. (англ.) // Blood. — 2014. — Vol. 123, no. 21. — P. 3286—3295. — doi:10.1182/blood-2014-02-548610. — PMID 24659631.
- ↑ Zaitseva L., Murray M. Y., Shafat M. S., Lawes M. J., MacEwan D. J., Bowles K. M., Rushworth S. A. Ibrutinib inhibits SDF1/CXCR4 mediated migration in AML. (англ.) // Oncotarget. — 2014. — Vol. 5, no. 20. — P. 9930—9938. — doi:10.18632/oncotarget.2479. — PMID 25294819.
- ↑ Rushworth S. A., Pillinger G., Abdul-Aziz A., Piddock R., Shafat M. S., Murray M. Y., Zaitseva L., Lawes M. J., MacEwan D. J., Bowles K. M. Activity of Bruton's tyrosine-kinase inhibitor ibrutinib in patients with CD117-positive acute myeloid leukaemia: a mechanistic study using patient-derived blast cells. (англ.) // The Lancet. Haematology. — 2015. — Vol. 2, no. 5. — P. e204—211. — doi:10.1016/S2352-3026(15)00046-0. — PMID 26688095.
- ↑ Bernard S., Danglade D., Gardano L., Laguillier C., Lazarian G., Roger C., Thieblemont C., Marzec J., Gribben J., Cymbalista F., Varin-Blank N., Ledoux D., Baran-Marszak F. Inhibitors of BCR signalling interrupt the survival signal mediated by the micro-environment in mantle cell lymphoma. (англ.) // International journal of cancer. — 2015. — Vol. 136, no. 12. — P. 2761—2774. — doi:10.1002/ijc.29326. — PMID 25388373.
- ↑ Advani R. H., Buggy J. J., Sharman J. P., Smith S. M., Boyd T. E., Grant B., Kolibaba K. S., Furman R. R., Rodriguez S., Chang B. Y., Sukbuntherng J., Izumi R., Hamdy A., Hedrick E., Fowler N. H. Bruton tyrosine kinase inhibitor ibrutinib (PCI-32765) has significant activity in patients with relapsed/refractory B-cell malignancies. (англ.) // Journal of clinical oncology : official journal of the American Society of Clinical Oncology. — 2013. — Vol. 31, no. 1. — P. 88—94. — doi:10.1200/JCO.2012.42.7906. — PMID 23045577.
- ↑ Chang B. Y., Francesco M., De Rooij M. F., Magadala P., Steggerda S. M., Huang M. M., Kuil A., Herman S. E., Chang S., Pals S. T., Wilson W., Wiestner A., Spaargaren M., Buggy J. J., Elias L. Egress of CD19(+)CD5(+) cells into peripheral blood following treatment with the Bruton tyrosine kinase inhibitor ibrutinib in mantle cell lymphoma patients. (англ.) // Blood. — 2013. — Vol. 122, no. 14. — P. 2412—2424. — doi:10.1182/blood-2013-02-482125. — PMID 23940282.
- ↑ 1 2 3 4 Ибрутиниб, инструкция. Дата обращения: 14 апреля 2017. Архивировано 18 января 2017 года.
- ↑ Cancer drug costs for a month of treatment at initial FDA approval. Дата обращения: 25 октября 2018. Архивировано 18 февраля 2018 года.